Elektroķīmiskās metodes– visdinamiskāk attīstās to pielietojuma ziņā vides monitoringā. Visbiežāk izmantotās metodes MOS sistēmās ir voltammetrija (ieskaitot polarogrāfiju), potenciometrija (tostarp jonometrija), kulometrija un konduktometrija.
Elektroķīmiskās analīzes metodes izmanto dažādu barotnes elektrisko īpašību atkarību no tajā analizējamo vielu kvantitatīvā satura un kvalitatīvā sastāva:
· mainīt potenciāls elektrodu atkarībā no fizikālajiem un ķīmiskajiem procesiem, kas notiek vielā ( potenciometrisks metode), t.sk. jonu selektīvo elektrodu selektīvās reakcijas, kas ir individuāli jutīgas pret lielu skaitu katjonu un anjonu ( jonometrisks metode);
· mainīt elektriskā vadītspēja (strāva) un vielas dielektriskā konstante atkarībā no barotnes veida un tās sastāvdaļu koncentrācijas ( konduktometriskais Un amperometriskais metodes);
· izmaiņas elektroenerģijas daudzums kad analizējamā viela nokļūst elektroķīmiskajā šūnā ( kulonometriskais metode);
· analizētā savienojuma atgūšana uz dzīvsudraba piloša vai rotējoša elektroda, kā likums, analizējot vielu niecīgus daudzumus dažādos agregācijas stāvokļos ( polarogrāfisks vai voltammetrisks metode).
Visu šīs grupas ierīču polarogrāfiem ir visaugstākā jutība, kas vienāda ar 0,005–1 μg/ml parauga.
Volametrija ietver elektroķīmiskās analīzes metožu grupu, kuras pamatā ir polarizācijas līkņu izpēte. Šīs metodes ir polarogrāfija Un amperometriskā titrēšana – ir daudz šķirņu un modifikāciju. Visbiežāk pastāvīga strāva polarogrāfija.
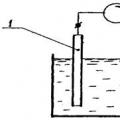
Polarogrāfiskā iekārta sastāv no līdzstrāvas avota, sprieguma dalītāja, krītoša (parasti dzīvsudraba) vai rotējoša elektroda un palīgelektroda (parasti arī dzīvsudraba vai cita) elektroda. Lai mērītu strāvu, sistēmai ir pievienots mikroampermetrs. Elektrodus kopā ar testa šķīdumu ievieto elektrolizatorā (šūnā).
Spriegums, kas tiek pielikts elektrolītiskajam elementam, izraisa anoda un katoda polarizāciju E= f a– f k +iR, Kur i– strāvas stiprums; UZ —šķīduma izturība; f a un f k– anoda un katoda potenciāli.
Ja samazina šķīduma pretestību, pievienojot spēcīgu elektrolītu (fons), tad vērtība iR(iespējams šķīduma kritums) var neņemt vērā.
Anoda potenciāls elementu darbības laikā paliek praktiski nemainīgs, jo strāvas blīvums ir zems un anoda salīdzinoši lielā virsma nav polarizēta. Tad piloša polarizējošā katoda potenciāls ar mazu virsmu būs vienāds ar: E= -f k. Bieži polarogrāfiskajos mērījumos dzīvsudraba slāņa vietā trauka apakšā tiek izmantots nepolarizējošs piesātināts kalomela elektrods, kura potenciāls tiek pieņemts vienāds ar nulli.
Polarogrāfiskos datus iegūst, mērot strāvu, kas iet caur elektrolītisko elementu, atkarībā no potenciāla, kas tiek pielietots elektrodiem. Strāvas grafisko atkarību no potenciāla sauc par polarogrāfisko vilni ( rīsi. 2).
Elektrolīzes sākumā pie zemām uzliktā EML vērtībām strāvas stiprums būs gandrīz nemainīgs un palielināsies tikai ļoti lēni. Tā ir tā sauktā atlikušā strāva, kas saglabājas visā elektrolīzes laikā.
Rīsi. 2. 10–3 M cinka hlorīda šķīduma un 1 M kālija hlorīda šķīduma (1. līkne) un 1 M kālija hlorīda šķīduma (2. līkne) polarogramma
Tiklīdz tiek sasniegts jonu samazināšanas potenciāls (piemēram, noteiktajiem cinka joniem tas ir vienāds ar -1,0 V), to izlāde sākas uz dzīvsudraba piliena:
Zn 2+ + 2 +Hg ® Zn (Hg).
Pie katoda veidojas atšķaidīta cinka amalgama Zn (Hg), kas sadalās tā sastāvdaļās, tiklīdz krītošais piliens saskaras ar anodu:
Zn (Hg) – 2 ® Zn 2+ +Hg.
Pie cinka jonu samazināšanas potenciāla strāvas stiprums strauji palielinās ( rīsi. 2), bet pēc noteiktas vērtības sasniegšanas, neskatoties uz pielietotā EML pieaugumu, tā paliek gandrīz nemainīga. Šo strāvu sauc par ierobežojošu vai difūziju; tās vērtība parasti ir proporcionāla nosakāmās vielas koncentrācijai.
Veicot polarogrammas, pētāmajam elektrolītam tiek pievienots vienaldzīgs elektrolīts ar katjoniem, kas reducējas daudz grūtāk nekā analizējamais katjons, piemēram, KCl, KNO 3, NH 4 Cl; koncentrācijā, kas 100–1000 reižu lielāka par nosakāmās vielas koncentrāciju. Šo elektrolītu sauc par "fonu". Tas ir izveidots testa risinājumā, lai palielinātu elektrovadītspēju un ekranētu indikatora elektroda (katoda) elektrisko lauku. Tāpēc analizējamās vielas katjonus nepiesaista katoda elektriskais lauks, bet gan difūzijas dēļ virzās uz to.
Vissvarīgākā polarogrammas īpašība ir pusviļņa potenciāls E 1/2 un polarogrāfisko viļņu augstumu h(ierobežot difūzijas strāvu). Tiek izmantots pusviļņa potenciāls kvalitāti polarogrāfiskā analīze. Dažādu vielu pusviļņu potenciāli, kas sakārtoti negatīvās vērtības pieauguma secībā, veido tā saukto “polarogrāfisko spektru”. Tā kā pusviļņa potenciāls būtiski ir atkarīgs no šķīduma sastāva (analizējamā barotne), fons vienmēr ir norādīts polarogrāfiskajās tabulās.
IN kvantitatīvi Polarogrāfiskajā analīzē koncentrācijas mērīšanai tiek izmantotas kalibrēšanas grafika, piedevu, salīdzinājumu un aprēķinu metodes.
Starp dažādām polarogrāfijas iespējām, metode diferenciālā impulsa polarogrāfija (DIP) ) ir visefektīvākais vides monitoringa problēmu risināšanā, galvenokārt tā augstās jutības dēļ. DIP metode ļauj novērtēt visu vielu saturu, ko nosaka klasiskā polarogrāfija. Citu polarogrāfijas metožu vidū tas ir īpaši ērts pēdu analīzei kvadrātveida vilnis polarogrāfija, kas nodrošina noteikšanas robežu tuvu DIP, bet tikai atgriezenisku elektrodu procesu gadījumā, un tāpēc šo metodi bieži izmanto smago metālu pēdu noteikšanai. Ar DIP metodi var noteikt arī virsmaktīvās vielas, kas maina elektroda dubultā elektriskā slāņa kapacitāti.
Smago metālu jonu mikrosatura noteikšanai var izmantot metodes inversijas elektroķīmiskā analīze (IEA) vai citā veidā, atdalīšanas voltammetriskā analīze (IVA ), kurā nosakāmie metāli tiek iepriekš uzklāti uz elektroda un pēc tam izšķīdināti polarogrāfiskās kontroles laikā. Šī opcija kopā ar DIP ir viena no jutīgākajām elektroķīmiskās analīzes metodēm. IEA (IVA) aparatūras dizains ir salīdzinoši vienkāršs, kas ļauj veikt analīzi uz lauka, un pēc šī principa var darboties arī automatizētas nepārtrauktas kontroles (monitoringa) stacijas.
IEA (IVA) metodes nodrošina Cu, Pb, Bi, Sb, As, Sn In, Ga, Ag, Tl, Cd, Zn, Hg, Au, Ge, Te, Ni, Co jonu un daudzu anjonu noteikšanu. Svarīga IEA (IEA) metožu priekšrocība ir (atšķirībā no citām metodēm, piemēram, tādām kā atomu absorbcijas spektrometrija) spēja atšķirt brīvos jonus no tiem saistītajām ķīmiskajām formām, kas ir svarīgi arī analizējamo vielu fizikāli ķīmisko īpašību novērtēšanai no vides analītiskās kontroles viedokļa (piemēram, novērtējot ūdens kvalitāti). Daudzas organiskās vielas var noteikt arī ar IEA (IEA) metodēm pēc to adsorbcijas uzkrāšanās uz elektrodu virsmas.
Ar polarogrāfijas metodēm var noteikt arī dažādu metālu aerosolus rūpniecisko telpu atmosfērā un gaisā pēc to uztveršanas atbilstošos filtros, kam seko koncentrātu pārnešana šķīdumā. Organiskos savienojumus, kas atrodas atmosfērā gāzu un tvaiku veidā, var noteikt polarogrāfiski pēc tam, kad tie ir absorbēti ar īpaši izvēlētiem šķīdumiem. Metālus un dažādus savienojumus bioloģiskajos materiālos pēc to ekstrakcijas parasti nosaka polarogrāfiski. Visus polarogrāfiskos mērījumus, tostarp IEA (IVA), var pilnībā automatizēt, kas ir būtiski, veicot sērijveida analīzi.
Viena no svarīgākajām polarogrāfijas pielietošanas jomām ir skābekļa noteikšana ūdenī. Šim nolūkam tiek izmantoti amperometriskie detektori, kas ģenerē strāvu, kas ir proporcionāla skābekļa koncentrācijai šķīdumā.
Uzklājot enzīmu uz detektora membrānas virsmas, ir iespējams iegūt dažādus enzīmu amperometriskos sensorus, kas ir ērti bioķīmiskām un klīniskām analīzēm. Šādi sensori tiek izmantoti arī vides uzraudzības sistēmās.
Elektrodi, kas darbojas pēc elektrokatalītiskā principa, ir piemēroti dažādu gāzu (SO 2, H 2 S, CO, NO x) uzraudzībai ražošanas telpu gaisā. Šo gāzu elektroķīmiskās reakcijas (spēlējot katalizatora lomu), kas notiek uz elektroda virsmas, elektrodu sistēmā rada strāvu, kas ir funkcionāli saistīta ar gāzu koncentrāciju gaisā.
Polarogrāfijas izmantošana neaprobežojas tikai ar atsevišķu paraugu analīzi, un metode pakāpeniski pāriet uz nepārtrauktas gāzu un šķidrumu analīzes principiem.
Volametriskie polarogrāfiskie detektori ir veiksmīgi izmantoti augstas izšķirtspējas šķidruma hromatogrāfijā (HPLC). Šajā gadījumā ļoti selektīvas atdalīšanas metodes kombinācija ar jutīgu noteikšanas metodi rada ievērojamu ar hromatogrāfijas metodi noteikto vielu diapazona paplašināšanos (ļoti toksisku vielu, herbicīdu, zāļu, augšanas stimulantu u.c. pēdas).
Sīkāka informācija par metodi ir atrodama specializētajā literatūrā.
Potenciometrija– vielu koncentrācijas noteikšanas metode, kuras pamatā ir atgriezenisko galvanisko elementu emf mērīšana.
Praksē tiek izmantotas divas analītiskās metodes: tiešā veidā potenciometrija lai noteiktu daļiņu aktivitāti, ko var aprēķināt, izmantojot Nernsta vienādojumu no galvaniskās šūnas emf, un potenciometriskā titrēšana , kurā ķīmisko vielu aktivitātes izmaiņas titrēšanas procesā izraisa galvaniskās šūnas emf izmaiņas.
Iekārtas potenciometriskās titrēšanas veikšanai un tiešai potenciometrijai ir vienādas. Potenciometriskā mērīšanas ķēde ietver indikatora elektrodu un atsauces elektrodu ar stabilu pastāvīgu potenciālu, kā arī sekundāro ierīci. Metodes principiālā diagramma ir parādīta rīsi. 3.

1 – indikatora elektrods; 2 - atsauces elektrods
Rīsi. 3. Potenciometriskā šūna
Elektrodu pāra potenciāls ir nemainīgs. Mainot analizējamās vielas koncentrāciju šķīdumā, mainās ķēdes EMF. Indikatora elektrodi parasti ir četri veidi, atkarībā no izmantotās membrānas, kas atdala elektrodu šķīdumu no testa šķīduma: 1) elektrodi ar homogēnu membrānu, kas izgatavoti no pulverveida vai kristāliska materiāla; 2) elektrodi ar heterogēnu membrānu, kuros elektroda aktīvā viela ir sadalīta, piemēram, silikona gumijā; 3) elektrodi ar šķidru membrānu, kurā membrāna ir šķīdums, kas uzklāts uz neitrālu vielu, piemēram, porains stikls; 4) stikla elektrodi ar dažādu stikla ķīmisko sastāvu.
Indikatora elektrodi iegūst tā šķīduma potenciālu, kurā tie ir ievietoti. Ir divi laipns indikatora elektrodi:
1) vienaldzīgi elektrodi (neiznīcināmi elektrolīzes laikā);
2) elektrodi, kas mērījumu laikā mainās (oksidējas vai reducējas).
Loma vienaldzīgi elektrodi(tos dažkārt sauc par elektrodiem trešais veida) ir dot vai iegūt elektronus, t.i. būt elektrības vadītājiem. Šādi elektrodi var būt izgatavoti no zelta, pulēta platīna, grafīta un citiem materiāliem. Mainīgu elektrodu piemēri (dažreiz saukti par elektrodiem) vispirms veida) var būt vara, cinka un citu metālu plāksnes, kā arī hinhidrona un ūdeņraža indikatorelektrodi. Turklāt indikatora elektrodi var būt jonu selektīvie membrānas elektrodi daudzu katjonu noteikšanai: Li +, Pb +, Cs +, Tl +, NH +, Na +, K +, Ag + utt. Kā atskaites elektrodi ( standarta elektrodi), kura potenciāls saglabājas nemainīgs visā mērījuma laikā, visbiežāk tiek izmantoti, piemēram, normālie un decinormālie kalomela (kalomeļa) elektrodi ar potenciālu attiecīgi +0,282 V un +0,334 V, kā arī piesātinātā sudraba hlorīda elektrods. ar potenciālu +0,201 V.
Ideālā gadījumā galvaniskās šūnas EML tiešu potenciometrisko mērījumu var saistīt ar Nernsta vienādojumu ar nosakāmās daļiņas aktivitāti vai koncentrāciju, ja ir zināmi attiecīgie aktivitātes koeficienti:
![]()
Kur E 0 – standarta elektrodu potenciāls, V; R– gāzes konstante; T- absolūtā temperatūra; F – Faradeja numurs; n– zaudēto vai iegūto elektronu skaits; , [reducēts] – attiecīgi oksidēto un reducēto formu līdzsvara koncentrācijas, mol/dm 3 .
Ja aizvietojam konstantu atsauces vērtības un pārejam no naturālā logaritma uz decimāldaļu, tad temperatūrai 25°C iegūstam:

Svarīgākais rādītājs vides stāvokļa raksturošanā ir šīs vides pH vērtība, kuras noteikšanā ( pH-metrija ) pašlaik parasti veic, izmantojot stikla indikatora (mērīšanas) elektrodus. Ilgtermiņa mērījumiem ir izstrādāti speciāla dizaina stikla elektrodi ar papildu ierīcēm, lai nodrošinātu stikla membrānas tīrīšanu. Stikla elektrodi, kas pārklāti ar daļēji caurlaidīgu membrānu ar elektrolīta plēvi, kalpo arī par pamatu dažāda veida zondēm ( sensori ), ko izmanto ūdens un gaisa analīzē ražošanas apstākļos vairākiem piesārņotājiem (NH 3, CO 2, NO x, SO 2, H 2 S utt.).
Process jonu selektīvo elektrodu (ISE) izveides jomā ļauj uzraudzīt jonus F – , I – , Br – , Cl – , CN – , SCN – , NO 3 – , NO 2 – , ClO 4 – , S 2 –, Na+ , K + Ca 2+, Ag +, Cu 2+, Cd 2+, Pb 2+ koncentrācijas robežās no 10 –2 līdz 10 –7 mol/l (aptuveni 1-10 –5 mg/ml). Monitoringam, izmantojot ISE, ir raksturīgs ātrums, vienkāršība un lielākas iespējas veikt nepārtrauktus mērījumus. Ir izstrādātas ISE, kas ir selektīvas plašai organisko vielu klasei, kā arī to masas izomēriem, virsmaktīvām vielām un mazgāšanas līdzekļiem, kas atrodas ražošanas teritorijas gaisā un rūpniecības uzņēmumu ūdenssaimniecības režīmā.
Potenciometriju izmanto arī dažādu redoksu (O/R) sistēmu redokspotenciālu mērīšanai ūdenī. Parasti mērījumu rezultāti atbilst jauktam potenciālam, jo ūdenī parasti vienlaikus pastāv vairākas O/W sistēmas.
Jāatzīmē, ka daudzsološa ir pusvadītāju metāla oksīda ķīmiski selektīvo un jonu selektīvo lauka efekta tranzistoru (HSFT, ISFT) bāzes sensoru izmantošana. Selektivitāte šajās sistēmās tiek panākta, izvēloties membrānas sastāvu un uz tranzistora vārtiem uzklātā slāņa. Sistēma ir iegremdēta analizējamajā šķīdumā, un potenciālu starpība starp atsauces elektrodu un tranzistora vārtiem modulē strāvu, kas plūst starp tā avotu un noteci. Pateicoties membrānas vai nogulsnētā slāņa selektivitātei, modulētā strāva kļūst par attiecīgās šķīduma sastāvdaļas aktivitātes funkciju. Pusvadītāju sensori veido dažādu gāzu un tvaiku monitoru un analizatoru pamatu. Šādu sensoru mazais izmērs ļauj tos apvienot mozaīkas veidā uz viena substrāta, lai iegūtu analizatoru, kas var kontrolēt virkni kaitīgu vielu. Signālus no atsevišķiem mozaīkā iekļautajiem sensoriem var secīgi un periodiski reģistrēt analītiskās sistēmas mērīšanas centrs.
Mikroelektronikas attīstība ļauj konstruēt kompaktus zondes tipa analizatorus, izmantojot modernus ISE. Šajā gadījumā zondes rokturī var uzstādīt ķēdi, kas apstrādā reakciju no vides kontroles objekta, un pat displeju.
Speciālajā literatūrā jūs varat uzzināt sīkāku informāciju par metodi, , , .
Kulonometriskais analīzes metode ir elektrodu reakcijas strāvas mērīšana, kurā pētāmā viela ar analizēto plūsmu nonāk kulometriskajā šūnā. Kulometriskās šūnas shematiskā diagramma ir parādīta rīsi. 4.

1 – katoda kamera; 2 – anoda kamera; 3 – mikroampermetrs
Rīsi. 4. Kulometriskās šūnas shēma
Kulometriskā analīze balstās uz elektroenerģijas daudzuma mērīšanu, kas iztērēts, kvantitatīvi veicot noteiktu elektroķīmisko procesu noteiktā paraugā, t.i. ar nosacījumu, ka pašreizējā efektivitāte ir 100%. Tas ir elektroenerģijas daudzums, izmantojot strāvas-laika integratoru, kas virknē savienots ar mērelementu, vai kulonometru-elektrolizatoru, kurā ar simtprocentīgu strāvas efektivitāti tiek veikts elektroķīmisks process, ko papildina viela, kuras daudzumu var viegli un precīzi atjaunot.
Saskaņā ar Faradeja likums:
m( x)/M(x) = m(k)/M(k),
Kur m(x), m(k) – nosakāmās vielas masa X un attiecīgi kulonometrā izdalītā viela; M(x), M(k) – vielas ekvivalentu molārā masa X un kulonometrā izdalītā viela, g/mol.

Aprēķinu var veikt arī, izmantojot vienādojumu, kas apraksta Faradeja likumu:
![]()
ja analīzes laikā mēra strāvas stiprumu i, A un laiks t, s, iztērēti elektroķīmiskā procesa veikšanai.
Citā šīs metodes modifikācijā, ko sauc
kulometriskā titrēšana
, titrants tiek ģenerēts elektrolītiski analizētajā šķīdumā ar noteiktu strāvu. Titranta patēriņu analītiskajā reakcijā aizstāj ar lādiņu, kas plūst caur šķīdumu, kad titrants tiek ģenerēts, līdz tiek sasniegts ekvivalences punkts.
Viens no Kulometrisko metožu priekšrocības ir tas, ka titrēšanas standartizācijas process bieži vien nav nepieciešams, jo aprēķini ir balstīti uz Faradeja konstanti, t.i. metode ir absolūta un ļauj novērtēt nosakāmās vielas daudzumu, nevis tās koncentrāciju. Kulometrijas ar noteiktu potenciālu trūkums ir analīzes procedūras ilgums, kas saistīts ar nepieciešamību pilnībā pabeigt elektrolīzi. Datortehnoloģijas ļauj samazināt šo laiku, paredzot elektrolīzes beigas, matemātiski apstrādājot strāvas-laika līkni elektrolīzes sākumposmiem un aprēķinot elektrības daudzumu vai vielas koncentrāciju šķīdumā. Analizējot daudzkomponentu paraugus, to var izmantot skenēšanas kulometrija , kurā elektrolīzes potenciāls tiek mainīts nepārtraukti vai pakāpeniski. Šādām sistēmām kulonometriskā titrēšana ir vēlama, nevis tieša kulometrija, jo 100% strāvas efektivitāti titrēšanas procesā var viegli sasniegt, pareizi izvēloties titrēšanas reaģentu un darba vides sastāvu. Kulometriskā titrēšana ir piemērojama vielu noteikšanai no 0,01 līdz 100 mg (dažreiz zem 1 μg). Darba parauga tilpums parasti ir no 10 līdz 50 ml. Metodei raksturīga augsta precizitāte, relatīvā kļūda nepārsniedz vairākas procenta desmitdaļas pat ar kulometrisko mikrogramu satura titrēšanu. Optimālos apstākļos titrēšanu var veikt ar ļoti zemām kopējām kļūdām 0,01% (rel.). Dažādas skābju-bāzes, redoks; Nokrišņu un kompleksometriskās titrēšanas iespējas var veikt kulometriski.
Ir izstrādāti un ražoti kulometriskie gāzes analizatori un akvaanalizatori (“kulometri”) sēra dioksīda un sērūdeņraža (sulfātu un sulfīdu), ozona (un ūdeņraža peroksīda), hlora gaisā (un aktīvā hlora ūdenī) noteikšanai, oglekļa monoksīds un slāpekļa dioksīds gaisā (nitrāti un nitrīti ūdenī). Kulometriju izmanto arī kā elektroķīmiskās noteikšanas rīku šķidrumu hromatogrāfijā.
Sīkāka informācija par metodi ir atrodama specializētajā literatūrā.
Konduktometriskā metode analīzes pamatā ir šķīduma elektriskās vadītspējas mērīšana. Konduktometriskā analīzes metode sastāv no elektrolīta šķīduma pretestības izmaiņu mērīšanas, kad maisījuma sastāvdaļa tiek absorbēta. Konduktometriskās iekārtas tiek izmantotas, piemēram, lai noteiktu oglekļa monoksīdu un dioksīdu, benzīna tvaikus, amonjaku un citus.
Elektriskā vadītspēja ir pretestības apgrieztā vērtība R, tā izmērs ir cm (Siemens) t.i. æ = 1/ R.
Šķīduma elektrovadītspēja ir atkarīga no jonu skaita šķīduma tilpuma vienībā, t.i. par koncentrēšanos AR, par šo jonu mobilitāti – V. Pamatojoties uz zināmām attiecībām
![]()
Kur Z– attālums starp elektrodiem; S – elektrodu laukums; k– proporcionalitātes koeficients.
Konkrētam elektrodu pārim ar nemainīgu attālumu starp tiem S/Z= konst. Tad
![]() ,
,
Kur k 1 = k(S/Z).
Veicot aprēķinus konduktometrijā, tiek izmantots jēdziens “elektriskā vadītspēja” æ 0:
![]()
Aprēķinos ir ērti izmantot ekvivalento elektrisko vadītspēju, kas ir vienāda ar:
Kur P - molu ekvivalentu skaits 1 cm 3 šķīduma. Ekvivalentā elektrovadītspēja l ¥ bezgalīgā atšķaidījumā ir vienāda ar katjonu kustīgumu summu U un anjonu V.
Vāja elektrolīta šķīduma ekvivalentās elektriskās vadītspējas attiecība pret šī elektrolīta ekvivalento elektrisko vadītspēju bezgalīgā atšķaidījumā ir vienāda ar šī elektrolīta disociācijas pakāpi a:
Neskatoties uz nespecifiskumu, šo metodi diezgan bieži izmanto vides monitoringa sistēmās, salīdzinot ar citām elektroķīmiskajām metodēm. Tas izskaidrojams ar to, ka, novērtējot piesārņojumu, piemēram, ūdeni un atmosfēru, ir iespējama nevis pakāpeniska, bet gan ražošanas procesu izejas (galīgā) kontrole. Tā kā ūdens elektrovadītspēja ir ārkārtīgi zema, bieži vien pietiek novērtēt kopējo piesārņotāju saturu, ko nodrošina konduktometrija. Tipiski konduktometrisko metožu izmantošanas piemēri vides monitoringā ir mazgāšanas līdzekļu analizatori notekūdeņos, sintētisko komponentu koncentrācija apūdeņošanas sistēmās un dzeramā ūdens kvalitāte (sāļums). Konduktometriskos analizatorus izmanto nepārtrauktai gaisa un nokrišņu piesārņotāju, piemēram, SO 2 un H 2 SO 4, uzraudzībai. Papildus tiešā konduktometrija var izmantot noteiktu piesārņojuma veidu noteikšanai netiešs metodes, kas nodrošina ļoti efektīvus iepriekš uzskaitīto vielu satura aprēķinus, kas mijiedarbojas pirms mērīšanas ar īpaši izvēlētiem reaģentiem un reģistrētās elektriskās vadītspējas izmaiņas izraisa tikai attiecīgo produktu klātbūtne reakcijā. Tādā veidā var noteikt slāpekļa oksīdus pēc to preamonjaka katalītiskās reducēšanas, kā arī HCl, HBr un CO 2 pēc iepriekšējas reakcijas ar Ba(OH) 2 vai NaOH. Aprakstīto CO 2 noteikšanas principu var izmantot arī netiešai organisko vielu noteikšanai ūdenī.
Papildus klasiskajai konduktometrijai ir arī augstfrekvences versija ( oscilometrija ), kurā indikatora elektrodu sistēma nesaskaras ar paraugu. Šis princips bieži tiek ieviests nepārtrauktās vadītspējas analizatoros.
Elektroķīmiskās analīzes metodes ir aprakstītas arī vairākās izglītojošās un īpašās publikācijās.
LITERATŪRA
1. Drugovs Yu.S., Rodins A.A.Vides analītiskā ķīmija.
Sanktpēterburga: 2002. – 464 lpp.
2. Paškevičs M.A., Šuiskis V.F. Vides monitorings. Apmācība. Sanktpēterburgas Valsts universitāte. – Sanktpēterburga, 2002. – 90 lpp.
3. Ketrāls Roberts V. Ķīmiskie sensori. M.: Zinātniskā pasaule, 2000. – 144 lpp.
4. Turjans Ja.I., Ruvinskis O.E., Zaicevs P.M.Polarogrāfiskā katalimetrija. M.: Ķīmija, 1998. – 272 lpp.
5. Budņikovs G.K., Maistrenko V.N., Murinovs Yu.I. Voltammetrija ar modificētiem un ultramikroelektrodiem. M.: Nauka, 1994. gads. – 239 lpp.
6. Brainina Kh.Z., Neiman E.Ya., Slepushkin V.V. Inversijas elektroanalītiskās metodes. M.: 1988. – 240 lpp.
7. Salikhdžanova R.F. un utt. Polarogrāfi un to izmantošana praktiskajā analīzē un pētniecībā. M.: Ķīmija, 1988. – 192 lpp.
8. Kaplan B.Ya., Pats R.G., Salikhdzhanova R.F. Maiņstrāvas voltammetrija. M.: Ķīmija, 1985. – 264.
9. Bonds A.M. Polarogrāfijas metodes analītiskajā ķīmijā. M.: Ķīmija, 1983.
10. Efremenko O.A. Potenciometriskā analīze. M.: MMA im. VIŅI. Sečenova, 1998.
11. Atsauces rokasgrāmata jonu selektīvo elektrodu pielietošanai. M.: Mir, 1986.
12. Korita I. Joni, elektrodi, membrānas. M.: Mir, 1983.
13. Nikolsky B.V., Materova E.A. Jonu selektīvie elektrodi. L.: Ķīmija, 1980. gads.
14. Efremenko O.A.Kulometriskā titrēšana. M.: MMA im. VIŅI. Sečenova, 1990.
15. Hudjakova T.A., Koreškovs A.P. Konduktometriskā analīzes metode. Mācību grāmata augstskolām. M.: Augstskola, 1975. – 207 lpp.
16. Budņikovs G.K., Maistrenko V.N., Vjaseļevs M.R. Mūsdienu elektriskās analīzes pamati. M.: Ķīmija, 2000.
17. Prokhorova G.V. Ievads elektroķīmiskajās analīzes metodēs. M.: Maskavas Valsts universitātes izdevniecība, 1991. – 97 lpp.
18. Elektroanalītiskās metodes vides monitoringā. /Red. R. Kalvoda, R. Zyka, K. Štuļiks un citi M.: Ķīmija, 1990. – 240 lpp.
19. Plambeks Dž.Elektroķīmiskās analīzes metodes. Teorijas pamati un pielietojums./Trans. no angļu valodas M.: Mir, 1986.
Darba apraksts
Mūsdienu ražošanas nozares un cilvēku sociālā dzīve izvirza savus specifiskus uzdevumus fizikālajām un ķīmiskajām analīzes metodēm produktu kvalitātes kontrolei. Viena no galvenajām fizikāli ķīmiskajām analīzes metodēm ir elektroķīmiskās analīzes metodes.
Šīs metodes var ātri un diezgan precīzi noteikt daudzus produktu kvalitātes rādītājus.
Vielas sastāva analīzes elektroķīmiskās metodes tiek plaši izmantotas dažādās nozarēs. Tie ļauj automatizēt produktu kvalitātes rezultātu saņemšanu un labot pārkāpumus, neapturot ražošanu. Pārtikas rūpniecībā šīs metodes nosaka produkta skābju-bāzes līdzsvaru, kaitīgo un toksisko vielu klātbūtni un citus rādītājus, kas ietekmē ne tikai pārtikas kvalitāti, bet arī nekaitīgumu.
Elektroķīmiskās analīzes iekārtas ir salīdzinoši lētas, pieejamas un viegli lietojamas. Tāpēc šīs metodes plaši izmanto ne tikai specializētās laboratorijās, bet arī daudzās nozarēs.
Šajā sakarā mērķis ir šī ku
IEVADS 2
3. TEORĒTISKĀ DAĻA
1.1. Fizikāli ķīmisko analīzes metožu vispārīgie raksturlielumi 3
1.2. Elektroķīmisko metožu raksturojums 4
1.3 Elektroķīmisko analīzes metožu klasifikācija 5
2 EKSPERIMENTĀLI PRAKTISKĀ DAĻA 15
SECINĀJUMS 21
ATSAUCES 22
Ievads
1. nodaļa. Vispārīgi jēdzieni. Elektroķīmisko analīzes metožu klasifikācija
2. nodaļa. Potenciometriskās analīzes metodes (potenciometrija)
1 Metodes princips
3 Potenciometriskā titrēšana
3. nodaļa. Konduktometriskā analīzes metode
1 Metodes princips. Pamatjēdzieni
2 Konduktometrijas princips
3 Konduktometriskā titrēšana
4. nodaļa. Konduktometriskā analīze (konduktometrija)
1 Metodes būtība
2 Kvantitatīvā polarogrāfiskā analīze
3 Polarogrāfijas pielietojumi
5. nodaļa. Amperometriskā titrēšana
6. nodaļa. Kulometriskā analīze (kulometrija)
1 Metodes princips
3 Kulometriskā titrēšana
Secinājums
Bibliogrāfija
IEVADS
Elektroķīmiskās analīzes metodes ir kvalitatīvas un kvantitatīvās analīzes metožu kopums, kas balstās uz elektroķīmiskām parādībām, kas notiek pētāmajā vidē vai saskarnē un ir saistītas ar izmaiņām analizējamās vielas struktūrā, ķīmiskajā sastāvā vai koncentrācijā.
Elektroķīmiskās analīzes metodes iedala piecās galvenajās grupās: potenciometrija, voltammetrija, kulometrija, konduktometrija un amperometrija.
Šo metožu izmantošana kvantitatīvā analīzē ir balstīta uz elektroķīmiskā procesa laikā izmērīto parametru vērtību atkarību no atdalītās vielas analizētajā šķīdumā, kas piedalās šajā elektroķīmiskajā procesā. Šādi parametri ietver elektriskā potenciāla un elektroenerģijas daudzuma starpību. Elektroķīmiskie procesi ir procesi, kurus vienlaikus pavada ķīmiska reakcija un sistēmas elektrisko īpašību maiņa, ko šādos gadījumos var saukt par elektroķīmisko sistēmu. Analītiskajā praksē elektroķīmiskā sistēma parasti satur elektroķīmisko elementu, kurā ir trauks, kurā ir elektriski vadošs testa šķīdums, kurā ir iegremdēti elektrodi.
Ir tiešas un netiešas elektroķīmiskās metodes. Tiešajās metodēs tiek izmantota strāvas stipruma (potenciāla utt.) atkarība no nosakāmās sastāvdaļas koncentrācijas. Netiešajās metodēs mēra strāvas stiprumu (potenciālu utt.), lai atrastu ar piemērotu titrantu nosakāmā komponenta titrēšanas beigu punktu, tas ir, tiek izmantota izmērītā parametra atkarība no titranta tilpuma.
1. NODAĻA. VISPĀRĪGI JĒDZIENI. ELEKTROĶĪMISKĀS ANALĪZES METOŽU KLASIFIKĀCIJA
Elektroanalītiskā ķīmija ietver elektroķīmiskās analīzes metodes, kuru pamatā ir elektrodu reakcijas un elektroenerģijas pārnešana caur šķīdumiem.
Elektroķīmisko metožu izmantošana kvantitatīvā analīzē balstās uz elektroķīmisko procesu izmērīto parametru vērtību (elektriskā potenciāla starpība, strāva, elektroenerģijas daudzums) atkarību izmantošanu no analizējamās vielas satura analizējamajā šķīdumā. šis elektroķīmiskais process. Elektroķīmiskie procesi ir procesi, kurus pavada vienlaicīga ķīmisko reakciju norise un sistēmas elektrisko īpašību maiņa, ko šādos gadījumos var saukt par elektroķīmisko sistēmu. Analītiskajā praksē elektroķīmiskā sistēma parasti satur elektroķīmisko elementu, tostarp trauku ar elektriski vadošu testa šķīdumu, kurā ir iegremdēti elektrodi.
Elektroķīmisko analīzes metožu klasifikācija. Elektroķīmiskās analīzes metodes tiek klasificētas dažādos veidos.Klasifikācija balstās uz sistēmas elektriskās enerģijas avota raksturu. Ir divas metožu grupas:
a) Metodes, neuzspiežot ārēju (ārēju) potenciālu.
Elektriskās enerģijas avots ir pati elektroķīmiskā sistēma, kas ir galvaniskais elements (galvaniskā ķēde). Šīs metodes ietver potenciometriskās metodes. Elektromotora spēks - EMF - un elektrodu potenciāli šādā sistēmā ir atkarīgi no analizējamās vielas satura šķīdumā.
b) Metodes ar ārējā (ārpusējā) potenciāla uzspiešanu. Šīs metodes ietver:
konduktometriskā analīze - balstīta uz šķīdumu elektriskās vadītspējas mērīšanu atkarībā no to koncentrācijas;
voltammetriskā analīze - balstās uz strāvas mērīšanu kā pielietotās zināmās potenciālu starpības un šķīduma koncentrācijas funkciju;
kulonometriskā analīze - balstās uz elektrības daudzuma mērīšanu, kas iziet cauri šķīdumam atkarībā no tā koncentrācijas;
elektrogravimetriskā analīze - balstās uz elektroķīmiskās reakcijas produkta masas mērīšanu.
Klasifikācija pēc elektroķīmisko metožu pielietošanas metodes. Ir tiešas un netiešas metodes.
a) Tiešās metodes. Elektroķīmisko parametru mēra kā zināmu šķīduma koncentrācijas funkciju un pēc attiecīgās mērierīces rādījumiem konstatē nosakāmās vielas saturu šķīdumā.
b) Netiešās metodes ir titrēšanas metodes, kurās titrēšanas beigas nosaka, pamatojoties uz sistēmas elektrisko parametru mērījumiem.
Saskaņā ar šo klasifikāciju izšķir, piemēram, tiešo konduktometriju un konduktometrisko titrēšanu.
2. NODAĻA. POTENCIOMETRISKĀS ANALĪZES METODE (POTENCIOMETRIJA)
1 Metodes princips
Potenciometriskā analīze (potenciometrija) balstās uz emf un elektrodu potenciālu mērīšanu atkarībā no analizējamā šķīduma koncentrācijas.
Ja elektroķīmiskajā sistēmā - galvaniskajā šūnā - uz elektrodiem notiek reakcija:
aA+bB↔dD + eE
ar n elektronu pārnesi, tad šīs reakcijas emf E Nernsta vienādojumam ir šāda forma:
E꞊E˚- RTnFlnaDda Eea(A)a aBb
kur, kā parasti, E° ir reakcijas standarta EMF (standarta elektrodu potenciālu atšķirība), R ir gāzes konstante, T ir absolūtā temperatūra, kurā notiek reakcija, F ir Faradeja skaitlis; a(A), a(B), a(D) un i(E) - reaģentu aktivitātes, kas piedalās reakcijā. Vienādojums (10.1) ir spēkā atgriezeniski strādājoša galvaniskā elementa emf.
Telpas temperatūrai vienādojumu (10.1) var attēlot šādā formā:
E꞊E˚- 0,059nlnaDda Eea(A)a aBb
Apstākļos, kad reaģentu aktivitātes ir aptuveni vienādas ar to koncentrāciju, vienādojums (1) kļūst par vienādojumu (3):
꞊E˚- RTnFlncDdc EecAa aBb
kur c(A), c(B), c(E), c(D) ir reaģentu koncentrācijas. Telpas temperatūrai šo vienādojumu var attēlot kā (4):
꞊E˚- 0,059nlncDdc EecAa aBb
Potenciometriskiem mērījumiem elektroķīmiskajā šūnā izmanto divus elektrodus: indikatorelektrodu, kura potenciāls ir atkarīgs no analizējamās (potenciālu noteicošās) vielas koncentrācijas analizējamajā šķīdumā, un atsauces elektrodu, kura potenciāls paliek nemainīgs. analīzes apstākļos. Tāpēc EML lielumu, ko nosaka vienādojumi (1)-4, var aprēķināt kā starpību starp šo divu elektrodu reālajiem potenciāliem.
Potenciometrijā tiek izmantoti šāda veida elektrodi: pirmā, otrā veida elektrodi, redokselektrodi, membrānas elektrodi.
Pirmā veida elektrodi ir elektrodi, kas ir atgriezeniski ar elektroda materiālam kopīgu katjonu. Ir trīs pirmā veida elektrodi.
a) Metāls M iegremdēts tā paša metāla sāls šķīdumā. Uz šādu elektrodu virsmas notiek atgriezeniska reakcija:
Mn++ne = M
Šāda pirmā veida elektroda reālais potenciāls ir atkarīgs no metālu katjonu aktivitātes a(Mn+), un to raksturo vienādojumi (5)-8.
Kopumā jebkurai temperatūrai:
꞊E˚+ RTnFln a(Mn+)
Telpas temperatūrai:
꞊E˚+ 0,059nln a(Mn+)
Zemās koncentrācijās c(Mn+), kad a(Mn+) metālu katjonu aktivitāte ir aptuveni vienāda ar to koncentrāciju:
꞊E˚+ RTnFln c(Mn+)
Telpas temperatūrai:
b) Gāzes elektrodi, piemēram, ūdeņraža elektrodi, ieskaitot standarta ūdeņraža elektrodu. Atgriezeniski strādājoša gāzes ūdeņraža elektroda potenciālu nosaka ūdeņraža jonu aktivitāte, t.i. šķīduma pH vērtība istabas temperatūrā ir vienāda ar:
꞊E˚+ 0,059 lg a(H30+) = 0,059 lg a(H3O+) = -0,059 рН
tā kā ūdeņraža elektrodam standarta potenciālu uzskata par nulli ( £° =0), un saskaņā ar elektrodu reakciju: H++e = N elektronu skaits, kas piedalās šajā reakcijā, ir vienāds ar vienu: n = 1. c) Amalgamas elektrodi, kas ir metāla amalgama, kas iegremdēta šķīdumā, kas satur tā paša metāla katjonus. Šādu pirmā veida elektrodu potenciāls ir atkarīgs no a(Mn+) metāla katjonu aktivitātes šķīdumā un no a(M) metāla aktivitātes amalgamā: ꞊E˚+ RTnFlna(Mn+)a(M) Amalgamas elektrodi ir ļoti atgriezeniski. Otrā tipa elektrodi ir atgriezeniski anjoni. Izšķir šādus otrā tipa elektrodu veidus. a) metāls, kura virsma ir pārklāta ar tā paša metāla slikti šķīstošu sāli, kas iegremdēts šķīdumā, kas satur anjonus, kas veido šo slikti šķīstošo sāli. Kā piemēru var minēt sudraba hlorīda elektrodu Ag|AgCl, KS1 vai kalomela elektrodu Hg|Hg2Cl2, KS1. Sudraba hlorīda elektrods sastāv no sudraba stieples, kas pārklāta ar ūdenī viegli šķīstošu sāli AgCI, kas iegremdēta kālija hlorīda ūdens šķīdumā. Pie sudraba hlorīda elektroda notiek atgriezeniska reakcija Kalomela elektrods sastāv no metāliska dzīvsudraba, kas pārklāts ar slikti šķīstoša dzīvsudraba(1) hlorīda Hg2Cl2 pastu – kalomelu, saskaroties ar kālija hlorīda ūdens šķīdumu. Pie kalomela elektroda notiek atgriezeniska reakcija: Cl2 + 2e = 2Hg + 2SG. Otrā veida elektrodu reālais potenciāls ir atkarīgs no anjonu aktivitātes un atgriezeniskajam elektrodam, uz kura notiek reakcija: Ne = M + An- aprakstīts ar Nernsta vienādojumiem (9)-(12). Kopumā jebkurā pieņemamā temperatūrā T: ꞊E˚- RTnFln a(An-) Telpas temperatūrai: ꞊E˚- 0,059nln a(An-) Apstākļiem, kuros anjonu aktivitāte ir aptuveni vienāda ar to koncentrāciju c(A"~): E꞊E˚- RTnFln c(An-) Telpas temperatūrai: ꞊E˚- 0,059nln c(An-) Piemēram, sudraba hlorīda un kalomela elektrodu reālos potenciālus E1 un E2 istabas temperatūrā var attēlot šādi: ꞊E1˚- 0,0591g a(Cl-),꞊E2˚- 0,0591g a(Cl-). Otrā tipa elektrodi ir ļoti atgriezeniski un stabili darbībā, tāpēc tos bieži izmanto kā atsauces elektrodus, kas spēj stabili uzturēt nemainīgu potenciāla vērtību. b) Otrā tipa gāzes elektrodi, piemēram, hlora elektrods Pt, Cl2 KS1. Otrā tipa gāzes elektrodus kvantitatīvā potenciometriskā analīzē izmanto reti. Redokselektrodi sastāv no inerta materiāla (platīna, zelta, volframa, titāna, grafīta utt.), kas iegremdēts šķīdumā, kas satur oksidētu Ox un šīs vielas reduktās sarkanās formas. Ir divu veidu redokselektrodi: a) elektrodi, kuru potenciāls nav atkarīgs no ūdeņraža jonu aktivitātes, piemēram, Pt | FeCl3, FeCI2, Pt | K3, K4 utt.; b) elektrodi, kuru potenciāls ir atkarīgs no ūdeņraža jonu aktivitātes, piemēram, hinhidrona elektrods. Pie redokselektroda, kura potenciāls nav atkarīgs no ūdeņraža jonu aktivitātes, notiek atgriezeniska reakcija: Vērsis + ne = Sarkans Šāda redokselektroda reālais potenciāls ir atkarīgs no konkrētās vielas oksidēto un reducēto formu aktivitātes, un atgriezeniski funkcionējošam elektrodam atkarībā no apstākļiem (pēc analoģijas ar iepriekš apskatītajiem potenciāliem) apraksta Nernsta vienādojumi ( 13)-(16): ꞊E˚+ RTnFln a (Ox)a (sarkans)꞊E˚+ 0,059nlg a (Ox)a (sarkans)꞊E˚+ RTnFln c(Ox)c (sarkans)꞊E˚+ 0,059 nlg c (Ox) c (sarkans) Ja elektrodu reakcijā piedalās ūdeņraža joni, tad to aktivitāte (koncentrācija) tiek ņemta vērā katram konkrētajam gadījumam atbilstošajos Nernsta vienādojumos. Membrānas jeb jonu selektīvie elektrodi ir elektrodi, kas ir atgriezeniski noteiktiem joniem (katjoniem vai anjoniem), ko sorbē cieta vai šķidra membrāna. Šādu elektrodu reālais potenciāls ir atkarīgs no to jonu aktivitātes šķīdumā, kurus absorbē membrāna. Cietie membrānas elektrodi satur ļoti plānu membrānu, kuras abās pusēs atrodas dažādi šķīdumi, kas satur vienus un tos pašus nosakāmos jonus, bet ar dažādām koncentrācijām: šķīdums (standarta) ar precīzi zināmu nosakāmo jonu koncentrāciju un analizējamais šķīdums ar nezināmu nosakāmo jonu koncentrāciju. Tā kā abos šķīdumos ir atšķirīga jonu koncentrācija, joni dažādās membrānas pusēs tiek sorbēti nevienādos daudzumos, un atšķiras arī elektriskais lādiņš, kas rodas no jonu sorbcijas dažādās membrānas pusēs. Tā rezultātā rodas membrānas potenciāla atšķirība. Jonu noteikšanu, izmantojot membrānas jonu selektīvos elektrodus, sauc par jonometriju. Kā minēts iepriekš, potenciometriskajos mērījumos elektroķīmiskā šūna ietver divus elektrodus - indikatorelektrodu un atsauces elektrodu. Šūnā radītā EML lielums ir vienāds ar potenciālu starpību starp šiem diviem elektrodiem. Tā kā etalona elektroda potenciāls potenciometriskās noteikšanas apstākļos paliek nemainīgs, EMF ir atkarīgs tikai no indikatora elektroda potenciāla, t.i. par noteiktu jonu aktivitātēm (koncentrācijām) šķīdumā. Tas ir pamats potenciometriskai konkrētās vielas koncentrācijas noteikšanai analizētajā šķīdumā. Lai potenciometriski noteiktu vielas koncentrāciju šķīdumā, tiek izmantota gan tiešā potenciometrija, gan potenciometriskā titrēšana, lai gan otro metodi izmanto daudz biežāk nekā pirmo. Vielas koncentrācijas noteikšanu tiešā potenciometrijā parasti veic, izmantojot kalibrēšanas līknes metodi vai standarta pievienošanas metodi. a) Kalibrēšanas grafika metode. Sagatavo 5–7 standartšķīdumu sēriju ar zināmu analizējamās vielas saturu. Nosakāmās vielas koncentrācija un jonu stiprums standartšķīdumos nedrīkst būtiski atšķirties no analizējamā šķīduma koncentrācijas un jonu stipruma: šādos apstākļos noteikšanas kļūdas samazinās. Visu šķīdumu jonu stiprums tiek uzturēts nemainīgs, ievadot vienaldzīgu elektrolītu. Standarta šķīdumus secīgi ievada elektroķīmiskajā (potenciometriskajā) šūnā. Parasti šī šūna ir stikla vārglāze, kurā ir ievietots indikatora elektrods un atsauces elektrods. Standarta šķīdumu EMF mēra, rūpīgi mazgājot elektrodus un stiklu ar destilētu ūdeni pirms elementa piepildīšanas ar katru standartšķīdumu. Pamatojoties uz iegūtajiem datiem, tiek izveidots kalibrēšanas grafiks EMF-log c koordinātēs, kur c ir analizējamās vielas koncentrācija standartšķīdumā. Parasti šis grafiks ir taisna līnija. Pēc tam analizēto šķīdumu pievieno elektroķīmiskajai šūnai (pēc šūnas mazgāšanas ar destilētu ūdeni) un izmēra šūnas emf. Izmantojot kalibrēšanas grafiku, tiek atrasts log c(X), kur c(X) ir analizējamās vielas koncentrācija analizētajā šķīdumā. b) Standarta pievienošanas metode. Zināmu tilpumu V(X) analizējamā šķīduma ar koncentrāciju c(X) pievieno elektroķīmiskajai šūnai un mēra šūnas emf. Pēc tam tam pašam šķīdumam pievieno precīzi izmērītu nelielu standarta šķīduma V(st) tilpumu ar zināmu, pietiekami lielu analizējamās vielas koncentrāciju c(st) un vēlreiz nosaka šūnas emf. Aprēķina analizējamās vielas koncentrāciju c(X) analizētajā šķīdumā, izmantojot formulu (10.17): c(X)= c(st) V (st)V X+ V (st) Kur △ E ir starpība starp divām izmērītajām EML vērtībām, n ir elektronu skaits, kas piedalās elektrodu reakcijā. Tiešās potenciometrijas pielietojums. Metodi izmanto ūdeņraža jonu (šķīdumu pH), anjonu un metālu jonu koncentrācijas noteikšanai (jonometrija). Lietojot tiešo potenciometriju, svarīga loma ir piemērota indikatora elektroda izvēlei un precīzam līdzsvara potenciāla mērījumam. Nosakot šķīdumu pH, kā indikatorelektrodi tiek izmantoti elektrodi, kuru potenciāls ir atkarīgs no ūdeņraža jonu koncentrācijas: stikla, ūdeņraža, hinhidrona un daži citi. Biežāk tiek izmantots membrānas stikla elektrods, kas ir atgriezenisks ūdeņraža jonos. Šāda stikla elektroda potenciālu nosaka ūdeņraža jonu koncentrācija, tāpēc ķēdes, kurā ir stikla elektrods kā indikators, EML istabas temperatūrā apraksta ar vienādojumu: K + 0,059 рН, kur konstante K ir atkarīga no membrānas materiāla un atsauces elektroda rakstura. Stikla elektrods ļauj noteikt pH diapazonā pH = 0-10 (biežāk diapazonā pH = 2-10) un ir ļoti atgriezenisks un stabils darbībā. Hinhidrona elektrods, ko bieži izmantoja pagātnē, ir redokselektrods, kura potenciāls ir atkarīgs no ūdeņraža jonu koncentrācijas. Tas sastāv no platīna stieples, kas iegremdēta skābes šķīdumā (parasti HC1), kas piesātināts ar hinhidronu, ekvimolekulāru hinona un hidrohinona savienojumu ar sastāvu C6H402 C6H4(OH)2 (tumši zaļš pulveris, nedaudz šķīst ūdenī). Hinhidrona elektroda shematisks apzīmējums: Pt | hinhidrons, HC1. Pie hinhidrona elektroda notiek redoksreakcija: C6H402 + 2H+ + 2e = C6H4(OH)2 Hinhidrona elektroda potenciālu istabas temperatūrā apraksta ar formulu E°-0,059рН. Hinhidrona elektrods ļauj izmērīt šķīdumu pH diapazonā pH = 0-8,5. Pie pH< 0 хингидрон гидролитически расщепляется: при рН >8,5 hidrohinons, kas ir vāja skābe, iziet neitralizācijas reakciju.Hinhidrona elektrodu nevar izmantot spēcīgu oksidētāju un reducētāju klātbūtnē. Membrānas jonu selektīvie elektrodi tiek izmantoti, kā minēts iepriekš, jonometrijā kā indikatori dažādu katjonu (Li+, Na+, K+ Mg2t, Ca2+, Cd2+, Fe2+, Ni2+ uc) jonu (F-, Cl-, Br -, I-, S2- utt.). Tiešās potenciometrijas priekšrocības ietver mērījumu vienkāršību un ātrumu; mērījumiem ir nepieciešams neliels risinājumu apjoms. 3 Poteniometriskā titrēšana Potenciometriskā titrēšana ir metode, lai noteiktu titrētāja tilpumu, kas iztērēts analizējamās vielas titrēšanai analizētajā šķīdumā, mērot EML (titrēšanas procesa laikā), izmantojot galvanisko ķēdi, kas sastāv no indikatora elektroda. un atsauces elektrodu. Potenciometriskajā titrēšanā analizē šķīdumu, kas atrodas elektroķīmiskajā šūnā, titrē piemērots titrants, fiksējot titrēšanas beigas ar krasām izmērītās ķēdes EMF izmaiņām - indikatora elektroda potenciālu, kas ir atkarīgs no atbilstošo jonu koncentrācijas un krasi mainās ekvivalences punktā. Indikatora elektroda potenciāla izmaiņas titrēšanas procesā tiek mērītas atkarībā no pievienotā titranta tilpuma. Pamatojoties uz iegūtajiem datiem, tiek konstruēta potenciometriskā titrēšanas līkne un pēc šīs līknes tiek noteikts patērētā titranta tilpums degvielas šūnā. Potenciometriskajai titrēšanai nav jāizmanto indikatori, kas maina krāsu degvielas elementa tuvumā. Potenciometriskās titrēšanas pielietošana. Metode ir universāla, to var izmantot, lai norādītu titrēšanas beigas visos titrēšanas veidos: skābju-bāzes, redoksu, kompleksimetriskā, nogulsnēšanas un titrējot neūdens vidē. Stikla, dzīvsudraba, jonu selektīvie, platīna un sudraba elektrodi tiek izmantoti kā indikatorelektrodi, bet kalomela, sudraba hlorīda un stikla elektrodi tiek izmantoti kā atsauces elektrodi. Metodei ir augsta precizitāte un liela jutība: tā ļauj titrēt duļķainā, krāsainā, neūdens vidē un atsevišķi noteikt maisījuma sastāvdaļas vienā analizējamā šķīdumā, piemēram, atsevišķi noteikt hlorīda un jodīda jonus argentometriskās titrēšanas laikā. Potenciometriskās titrēšanas metodes tiek izmantotas, lai analizētu daudzas ārstnieciskas vielas, piemēram, askorbīnskābi, sulfātus, barbiturātus, alkaloīdus utt. Par konduktometriskās analīzes pamatlicēju tiek uzskatīts vācu fiziķis un fizikālis ķīmiķis F.V.G. Kolraušs (1840-1910), kurš pirmo reizi 1885. gadā ierosināja vienādojumu, kas nosaka saistību starp spēcīgu elektrolītu šķīdumu elektrovadītspēju un to koncentrāciju. IN 40. gadu vidus XX gadsimts tika izstrādāta augstfrekvences konduktometriskā titrēšanas metode. Kopš 60. gadu sākuma. XX gadsimts Konduktometriskos detektorus sāka izmantot šķidrumu hromatogrāfijā. 1 Metodes princips. Pamatjēdzieni Konduktometriskā analīze (konduktometrija) balstās uz sakarības izmantošanu starp elektrolītu šķīdumu elektrovadītspēju (elektrisko vadītspēju) un to koncentrāciju. Elektrolītu šķīdumu - otrā tipa vadītāju - elektrovadītspēja tiek vērtēta, pamatojoties uz to elektriskās pretestības mērījumiem elektroķīmiskajā šūnā, kas ir stikla trauks (stikls), kurā ir ielodēti divi elektrodi, starp kuriem tiek ievietots testa elektrolīta šķīdums. atrodas. Caur šūnu tiek izvadīta maiņstrāva. Elektrodus visbiežāk izgatavo no metāla platīna, kas, lai palielinātu elektrodu virsmu, tiek pārklāts ar porainā platīna slāni, elektroķīmiski nogulsnējot platīna savienojumus no šķīdumiem (platinizēti platīna elektrodi). Lai izvairītos no komplikācijām, kas saistītas ar elektrolīzes un polarizācijas procesiem, konduktometriskie mērījumi tiek veikti mainīgā elektriskajā laukā. Elektrolīta šķīduma slāņa elektriskā pretestība starp elektrodiem, tāpat kā pirmā veida vadītāju elektriskā pretestība, ir tieši proporcionāla šī slāņa garumam (biezumam) l un apgriezti proporcionāla elektrodu virsmas laukumam S: R= ρ lS lkS kur proporcionalitātes koeficientu p sauc par īpatnējo elektrisko pretestību, bet apgriezto vērtību k = 1/p sauc par īpatnējo elektrisko vadītspēju (elektrisko vadītspēju). Tā kā elektriskā pretestība R tiek mērīta omos, elektrolīta šķīduma slāņa biezums l ir cm, bet elektrodu virsmas laukums S ir cm2, īpatnējo elektrovadītspēju k mēra vienībās Ohm-1 cm-1 vai, tā kā Ohm-1 ir Siemens (Sm), tad - Sm vienībās cm-1. Fizikālā nozīmē īpatnējā elektrovadītspēja ir elektrolīta slāņa elektrovadītspēja, kas atrodas starp kuba malām, kura malas garums ir 1 cm un kas skaitliski vienāds ar strāvu, kas iet caur elektrolīta šķīduma slāni ar šķērsgriezuma laukumu 1 cm2 ar pielietoto elektriskā potenciāla gradientu 1 V/cm. Īpatnējā elektrovadītspēja ir atkarīga no elektrolīta un šķīdinātāja rakstura, no šķīduma koncentrācijas un temperatūras. Palielinoties elektrolīta šķīduma koncentrācijai, tā īpatnējā elektriskā vadītspēja vispirms palielinās, pēc tam iziet cauri maksimumam un pēc tam samazinās. Šāda veida elektriskās vadītspējas izmaiņas ir saistītas ar šādiem iemesliem. Sākotnēji, palielinoties elektrolītu koncentrācijai, jonu - strāvu nesošo daļiņu - skaits palielinās gan stipriem, gan vājiem elektrolītiem. Tāpēc palielinās šķīduma elektriskā vadītspēja (elektriskā strāva, kas iet caur to). Tad, palielinoties šķīduma koncentrācijai, palielinās tā viskozitāte (samazinot jonu kustības ātrumu) un elektrostatiskā mijiedarbība starp joniem, kas novērš elektriskās strāvas palielināšanos un pie pietiekami augstām koncentrācijām palīdz to samazināt. Vāju elektrolītu šķīdumos, palielinoties koncentrācijai, elektrolītu molekulu disociācijas pakāpe samazinās, kas izraisa jonu - vadošo daļiņu - skaita samazināšanos un īpatnējās elektriskās vadītspējas samazināšanos. Spēcīgu elektrolītu šķīdumos lielās koncentrācijās ir iespējama jonu asociēto savienojumu veidošanās (jonu dvīņi, tīņi utt.), kas arī veicina elektriskās vadītspējas samazināšanos. Elektrolītu šķīdumu īpatnējā elektrovadītspēja palielinās, palielinoties temperatūrai, jo samazinās šķīdumu viskozitāte, kas izraisa jonu kustības ātruma palielināšanos, bet vājiem elektrolītiem - arī to jonizācijas pakāpes palielināšanos. (disociācija jonos). Tāpēc kvantitatīvie konduktometriskie mērījumi jāveic nemainīgā temperatūrā, termostatējot konduktometrisko elementu. Papildus īpatnējai elektrovadītspējai konduktometrijā izmanto ekvivalentu elektrovadītspēju X un molāro elektrovadītspēju p. Fizikālā izteiksmē ekvivalentā elektrovadītspēja X ir 1 cm bieza elektrolīta šķīduma slāņa elektrovadītspēja, kas atrodas starp identiskiem elektrodiem ar tādu laukumu, ka starp tiem esošā elektrolīta šķīduma tilpums satur 1 g-ekv izšķīdušās vielas. Šajā gadījumā par ekvivalenta molāro masu uzskata identisku daļiņu ar lādiņa vienības numuru (“lādiņš”), piemēram, H+, Br -, 12Ca2+, 13Fe3+ utt. Ekvivalentā elektrovadītspēja palielinās, samazinoties elektrolīta šķīduma koncentrācijai. Maksimālā ekvivalentās elektriskās vadītspējas vērtība tiek sasniegta ar bezgalīgu šķīduma atšķaidīšanu. Ekvivalentā elektrovadītspēja, tāpat kā īpatnējā vadītspēja, palielinās, palielinoties temperatūrai. Ekvivalentā elektrovadītspēja X ir saistīta ar īpatnējo elektrisko vadītspēju k ar attiecību (20): λ= 1000 kc Tiešajā konduktometrijā vielas koncentrāciju analizējamajā šķīdumā nosaka pēc šī šķīduma īpatnējās elektrovadītspējas mērījumu rezultātiem. Apstrādājot mērījumu datus, tiek izmantotas divas metodes: aprēķina metode un kalibrēšanas grafika metode. Aprēķina metode. Saskaņā ar (10.20) vienādojumu elektrolīta ekvivalenta c molāro koncentrāciju šķīdumā var aprēķināt, ja ir zināma īpatnējā elektrovadītspēja k un ekvivalentā elektrovadītspēja. : c = 1000 kλ Īpatnējo elektrovadītspēju nosaka eksperimentāli, pamatojoties uz termostatētas konduktometriskās šūnas elektriskās pretestības mērījumu. Šķīduma ekvivalentā elektrovadītspēja λ vienāds ar katjonu mobilitātes summu λ+ un anjons X λ -:
λ = λ + + λ-
Ja ir zināmas katjona un anjona mobilitātes, tad koncentrāciju var aprēķināt, izmantojot formulu (24): c = 1000 kλ + + λ- To dara, ar tiešo konduktometriju nosakot slikti šķīstoša elektrolīta koncentrāciju tā piesātinātajā šķīdumā (kalcijs, bārija sulfāti, sudraba halogenīdi utt.). Kalibrēšanas grafika metode. Tiek sagatavota virkne standarta šķīdumu, no kuriem katrs satur precīzi zināmu analizējamās vielas koncentrāciju, un to elektrovadītspēju mēra nemainīgā temperatūrā termostatētā konduktometriskā šūnā. Pamatojoties uz iegūtajiem datiem, tiek izveidots kalibrēšanas grafiks, kurā uz abscisu ass tiek attēlota standartšķīdumu koncentrācija, bet pa ordinātu asi - īpatnējās elektriskās vadītspējas vērtības. Saskaņā ar (24) vienādojumu uzzīmētais grafiks parasti attēlo taisnu līniju salīdzinoši nelielā koncentrācijas izmaiņu diapazonā. Plašā koncentrāciju diapazonā, kad (24) vienādojumā iekļautā katjona un anjona kustīgums var ievērojami mainīties, tiek novērotas novirzes no lineārās atkarības. Pēc tam stingri tādos pašos apstākļos tiek izmērīta analizējamā šķīdumā noteiktā elektrolīta īpatnējā elektrovadītspēja k(X) ar nezināmu koncentrāciju c(X) un no grafika atrod vēlamo vērtību c(X). Tā, piemēram, nosaka bārija saturu barīta ūdenī – piesātinātā bārija hidroksīda šķīdumā. Tiešās konduktometrijas pielietojums. Tiešās konduktometrijas metodi raksturo vienkāršība un augsta jutība. Tomēr metode nav īpaši selektīva. Tiešā konduktometrija analīzē ir ierobežota. To izmanto slikti šķīstošo elektrolītu šķīdības noteikšanai, destilēta ūdens un šķidro pārtikas produktu (piena, dzērienu u.c.) kvalitātes kontrolei, kopējā sāls satura noteikšanai minerālūdenī, jūras, upju ūdenī un dažos citos gadījumos. . 3 Konduktometriskā titrēšana Konduktometriskajā titrēšanā titrēšanas gaitu uzrauga analizētā šķīduma elektriskās vadītspējas izmaiņas, kas atrodas konduktometriskajā šūnā starp diviem inertiem elektrodiem (parasti izgatavoti no platinizēta platīna). Pamatojoties uz iegūtajiem datiem, tiek uzzīmēta konduktometriskā titrēšanas līkne, kas atspoguļo titrētā šķīduma elektriskās vadītspējas atkarību no pievienotā titrēšanas tilpuma. Titrēšanas beigu punkts visbiežāk tiek atrasts, ekstrapolējot titrēšanas līknes posmus apgabalā, kurā mainās tās slīpums.Šajā gadījumā nav nepieciešams izmantot indikatorus, kas maina krāsu TE tuvumā. Konduktometriskajā titrēšanā izmanto dažāda veida reakcijas: skābju-bāzes, redoksu, izgulsnēšanos, kompleksu veidošanās procesus. Konduktometriskās titrēšanas pielietošana. Konduktometriskās titrēšanas metodei ir vairākas priekšrocības. Titrēšanu var veikt duļķainā, krāsainā, necaurspīdīgā vidē. Metodes jutība ir diezgan augsta - līdz ~10~* mol/l; noteikšanas kļūda svārstās no 0,1 līdz 2%. Analīzi var automatizēt. Metodes trūkumi ietver zemu selektivitāti. Augstfrekvences (radiofrekvences) konduktometriskās titrēšanas jēdziens. Titrēšanas gaita tiek uzraudzīta, izmantojot modificētu maiņstrāvas konduktometrisko paņēmienu, kurā maiņstrāvas frekvence var sasniegt apmēram miljonu svārstību sekundē. Parasti elektrodus novieto (uzliek) titrēšanas trauka (vadītspējas šūnas) ārpusē tā, lai tie nesaskartos ar titrējamo šķīdumu. Pamatojoties uz mērījumu rezultātiem, tiek uzzīmēta konduktometriskā titrēšanas līkne. Titrēšanas beigu punktu nosaka, ekstrapolējot titrēšanas līknes sadaļas reģionā, kurā mainās tās slīpums. 4. NODAĻA. KONDUKTOMETRISKĀ ANALĪZE (CONDUCTOMETRY) 4.1 Metodes būtība Polarogrāfiskā analīze (polarogrāfija) balstās uz šādu sakarību izmantošanu starp elektroķīmiskās (šajā gadījumā polarogrāfiskās) šūnas, kurai tiek pielietots ārējais potenciāls, elektriskajiem parametriem un tajā esošā analizējamā šķīduma īpašībām. a) Kvalitatīvajā polarogrāfiskajā analīzē tiek izmantota attiecība starp ārējā elektriskā potenciāla lielumu, kas tiek pielietots mikroelektrodam, pie kura noteiktos apstākļos uz mikroelektroda tiek novērota analizējamās vielas samazināšanās (vai oksidēšanās), un reducējamās vielas raksturu (vai oksidēts). b) Kvantitatīvā polarogrāfiskā analīzē tiek izmantota attiecība starp difūzās elektriskās strāvas lielumu un nosakāmās (reducējošās vai oksidējošās) vielas koncentrāciju analizējamajā šķīdumā. Elektriskie parametri - pielietotā elektriskā potenciāla lielums un difūzijas strāvas lielums - tiek noteikti, analizējot iegūtās polarizācijas jeb strāvas-sprieguma līknes, kas grafiski atspoguļo elektriskās strāvas atkarību polarogrāfiskajā šūnā no pielietotais mikroelektroda potenciāls. Tāpēc polarogrāfiju dažreiz sauc par tiešo voltammetriju. Klasisko polarogrāfisko analīzes metodi, izmantojot dzīvsudraba pilināmo elektrodu, 1922. gadā izstrādāja un ierosināja čehu zinātnieks Jaroslavs Heirovskis (1890-1967), lai gan pašu dzīvsudraba pilināšanas elektrodu jau 1903. gadā izmantoja čehu fiziķis B. Kučera. 1925. g. J. Heirovskis un M. Šikata izstrādāja pirmo polarogrāfu, kas ļāva automātiski ierakstīt polarizācijas līknes. Pēc tam tika izstrādātas dažādas polarogrāfijas metodes modifikācijas. Vidējās difūzijas strāvas iD vērtību nosaka Ilkoviča vienādojums (25): kur K ir proporcionalitātes koeficients, c ir polarogrāfiski aktīvās depolarizējošās vielas koncentrācija (mmol/l); iD mēra mikroampēros kā starpību starp ierobežojošo strāvu un atlikušo strāvu. Proporcionalitātes koeficients K Ilkoviča vienādojumā ir atkarīgs no vairākiem parametriem un ir vienāds ar K=607nD12m23τ16 kur n ir elektronu skaits, kas piedalās elektrodu redoksreakcijā; D ir reducējošās vielas difūzijas koeficients (cm2/s); t ir dzīvsudraba masa, kas izplūst no kapilāra sekundē (mg); t ir dzīvsudraba piliena veidošanās laiks (sekundēs) pie pusviļņa potenciāla (parasti tas ir 3-5 s). Tā kā difūzijas koeficients D ir atkarīgs no temperatūras, proporcionalitātes koeficients K Ilkoviča vienādojumā mainās līdz ar temperatūru. Ūdens šķīdumiem temperatūras diapazonā no 20-50 °C polarogrāfiski aktīvo depolarizējošo vielu difūzijas koeficients palielinās par aptuveni 3%, temperatūrai paaugstinoties par vienu grādu, kas noved pie vidējās difūzijas strāvas iD palielināšanās par ~1. -2%. Tāpēc polarogrāfiju veic nemainīgā temperatūrā, termostatējot polarogrāfisko šūnu parasti 25 ± 0,5 ° C temperatūrā. Dzīvsudraba masa t un pilienu veidošanās laiks t ir atkarīgi no dzīvsudraba pilināmā elektroda īpašībām un dzīvsudraba kolonnas augstuma kapilārā un ar kapilāru savienotajā rezervuārā. Dzīvsudraba pilināmā mikroelektroda stikla kapilāra ārējais diametrs parasti ir 3-7 mm, iekšējais diametrs no 0,03 līdz 0,05 mm, garums 6-15 cm.Dzīvsudraba kolonnas augstums no kapilāra apakšējā gala. līdz dzīvsudraba virsmas augšējam līmenim rezervuārā ir 40-80 cm; Indiferentā elektrolīta saturam analizētajā polarogrāfētajā šķīdumā jābūt aptuveni 100 reižu lielākam par nosakāmās depolarizējošās vielas saturu, un fona elektrolīta jonus nedrīkst izvadīt polarogrāfiskos apstākļos, kamēr nav izlādējusies polarogrāfiski aktīvā viela. Polarogrāfiju veic, kā šķīdinātāju izmantojot ūdeni, ūdens-organiskos maisījumus (ūdens – etanols, ūdens – acetons, ūdens – dimetilformamīds u.c.) un neūdens vidi (etanolu, acetonu, dimetilformamīdu, dimetilsulfoksīdu u.c.). Pirms polarogrāfijas sākšanas caur analizējamo šķīdumu tiek izvadīta inertas gāzes (slāpekļa, argona utt.) strāva, lai noņemtu izšķīdušo skābekli, kas arī rada polarogrāfisku viļņu samazinājuma dēļ saskaņā ar šādu shēmu: 2Н+ + 2е = Н202 Н202 + 2Н+ + 2е = 2Н20 Dažkārt - sārmainu šķīdumu gadījumā - tā vietā, lai izvadītu inertas gāzes strāvu, analizētajam šķīdumam pievieno nelielu daudzumu aktīvā reducētāja - nātrija sulfīta, metola, kas, reaģējot ar to, saista izšķīdušo skābekli. 4.2. Kvantitatīvā polarogrāfiskā analīze No iepriekš minētā izriet, ka kvantitatīvā polarogrāfiskā analīze balstās uz difūzijas strāvas iD mērīšanu kā funkciju no polarogrāfiski aktīvās depolarizējošās vielas koncentrācijas, kas noteikta polarogrāfētajā šķīdumā. Analizējot iegūtās polarogrammas, analizējamās vielas koncentrāciju nosaka, izmantojot kalibrēšanas līknes, standarta piedevu un standartšķīdumu metodes. a) Visbiežāk tiek izmantota kalibrēšanas līknes metode. Izmantojot šo metodi, tiek sagatavota virkne standartšķīdumu, no kuriem katrs satur precīzi zināmu analizējamās vielas koncentrāciju. Katrs šķīdums tiek polarogrāfēts (pēc tam, kad caur to ir izpūsta inertas gāzes strāva) vienādos apstākļos, iegūst polarogrammas un nosaka E12 (vienādi visiem šķīdumiem) un difūzijas strāvas iD (atšķiras visiem šķīdumiem) vērtības. . Pamatojoties uz iegūtajiem datiem, iD-c koordinātēs tiek izveidots kalibrēšanas grafiks, kas parasti ir taisna līnija saskaņā ar Ilkoviča vienādojumu. Pēc tam analizējamajam šķīdumam ar nezināmu analizējamās vielas koncentrāciju c(X) veic polarogrāfiju, iegūst polarogrammu, mēra difūzijas strāvu iD(X) un no kalibrēšanas grafika nosaka koncentrāciju c(X). . b) Standarta pievienošanas metode. Tiek iegūta analizējamā šķīduma polarogramma ar nezināmu analizējamās vielas koncentrāciju c(X) un atrasta difūzijas strāvas vērtība, t.i. polarogrammas augstums h. Pēc tam analizējamajam šķīdumam pievieno precīzi zināmu analizējamās vielas daudzumu, palielinot tā koncentrāciju par vērtību c(st), vēlreiz tiek veikta polarogrāfija un tiek atrasta jauna difūzijas strāvas vērtība - polarogrammas augstums h + △ h. Saskaņā ar Ilkoviča vienādojumu (25), mēs varam rakstīt: h = Kc(X), △ h = Kc(st), kur h △ h = c(X)c(st) un c(X) = h △ hc(st) c) Standarta risinājuma metode. Identiskos apstākļos polarogrāfiju veic diviem šķīdumiem: analizējamam šķīdumam ar nezināmu koncentrāciju c(X) un standarta šķīdumam ar precīzi zināmu nosakāmās vielas koncentrāciju c(st). No iegūtajām polarogrammām tiek atrasti polarogrāfisko viļņu augstumi h(X) un h(st), kas atbilst difūzijas strāvai attiecīgi koncentrācijās c(X) un c(st). Saskaņā ar Ilkoviča vienādojumu (25) mums ir: (X) = Kc(X), h(st) = Kc(st), Standartšķīdumu sagatavo tā, lai tā koncentrācija būtu pēc iespējas tuvāka nosakāmā šķīduma koncentrācijai. Šādos apstākļos noteikšanas kļūda tiek samazināta līdz minimumam. 3 Polarogrāfijas pielietojumi Metodes pielietojums. Polarogrāfiju izmanto, lai noteiktu nelielu daudzumu neorganisko un organisko vielu. Ir izstrādāti tūkstošiem kvantitatīvās polarogrāfiskās analīzes metožu. Ir piedāvātas metodes gandrīz visu metālu katjonu, vairāku anjonu (bromāta, jodāta, nitrāta, permanganāta jonu), dažādu klašu organisko savienojumu, kas satur diazo grupas, karbonilgrupas, peroksīda, epoksīda grupas, oglekļa-oglekļa dubultsaites, polarogrāfiskai noteikšanai. , kā arī saista oglekli-halogēnu, slāpekli-skābekli, sēru-sēru. Farmakopejas metodi izmanto salicilskābes, norsulfazola, B vitamīna alkaloīdu, folijskābes, kellīna pulverī un tabletēs, nikotīnamīda, piridoksīna hidrohlorīda, arsēna preparātu, sirds glikozīdu, kā arī skābekļa un dažādu piemaisījumu noteikšanai farmācijā. Metodei ir augsta jutība (līdz 10"5-10T6 mol/l); selektivitāte; salīdzinoši laba rezultātu reproducējamība (līdz ~2%); plašs pielietojumu klāsts; ļauj analizēt vielu maisījumus bez to atdalīšanas, krāsots šķīdumi, nelieli šķīdumu tilpumi (polarogrāfisko šūnu tilpums var būt pat 1 ml); veikt analīzi šķīduma plūsmā; automatizēt analīzi." Metodes trūkumi ietver dzīvsudraba toksicitāti, tā diezgan vieglo oksidēšanos oksidējošu vielu klātbūtnē un izmantoto iekārtu relatīvo sarežģītību. Citi polarogrāfijas metodes varianti. Papildus iepriekš aprakstītajai klasiskajai polarogrāfijai, kurā tiek izmantots pilošs dzīvsudraba mikroelektrods ar vienmērīgi pieaugošu elektrisko potenciālu uz tā pie nemainīgas elektriskās strāvas, ir izstrādāti arī citi polarogrāfijas metodes varianti - atvasinātā, diferenciālā, impulsa, oscilogrāfiskā polarogrāfija; maiņstrāvas polarogrāfija - arī dažādās versijās. 5. NODAĻA. AMPEROMETRISKĀ TITRĒŠANA Metodes būtība. Amperometriskā titrēšana (potenciostatiskā polarizācijas titrēšana) ir voltammetriskās metodes veids (kopā ar polarogrāfiju). Tas ir balstīts uz strāvas mērīšanu starp elektroķīmiskās šūnas elektrodiem, kuriem tiek pielikts noteikts spriegums, atkarībā no pievienotā titranta tilpuma. Saskaņā ar Ilkoviča vienādojumu (25): Difūzijas strāva iD polarogrāfiskajā šūnā ir lielāka, jo lielāka ir polarogrāfiski aktīvās vielas koncentrācija c. Ja analizējamam titrētajam šķīdumam, kas atrodas polarogrāfiskajā šūnā, pievienojot titrantu, šādas vielas koncentrācija samazinās vai palielinās, tad attiecīgi samazinās vai palielinās arī difūzijas strāva. Ekvivalences punktu nosaka straujas difūzijas strāvas samazināšanās vai palielināšanās izmaiņas, kas atbilst titrētās vielas reakcijas beigām ar titrantu. Izšķir amperometrisko titrēšanu ar vienu polarizējamu elektrodu, ko sauc arī par titrēšanu, ierobežojot strāvu, polarogrāfisko vai polarimetrisko titrēšanu, un amperometrisko titrēšanu ar diviem identiskiem polarizējamiem elektrodiem vai titrēšanu “līdz strāva pilnībā apstājas”, biamperometrisko titrēšanu. Amperometriskā titrēšana ar vienu polarizējamu elektrodu. Tas ir balstīts uz strāvas mērīšanu polarogrāfiskajā šūnā atkarībā no pievienotā titranta daudzuma pie nemainīga ārējā potenciāla uz mikroelektroda, kas ir nedaudz augstāks par pusviļņa potenciālu titrētās vielas X vai titranta T strāvas-sprieguma līknē. Parasti izvēlētais ārējais potenciāls atbilst strāvu ierobežojošajam apgabalam uz polarogrammas X vai T Titrēšana tiek veikta iekārtā, kas sastāv no līdzstrāvas avota ar regulējamu spriegumu, kuram virknē ir pievienots galvanometrs un polarogrāfiskās titrēšanas šūna. Šūnas darba (indikācijas) elektrods var būt dzīvsudraba pilināmais elektrods, stacionārs vai rotējošs platīna vai grafīta elektrods. Izmantojot cietos elektrodus, titrēšanas laikā ir nepieciešams maisīt šķīdumu. Par atsauces elektrodu izmanto sudraba hlorīda vai kalomela elektrodus. Fons ir, atkarībā no apstākļiem, dažādi polarogrāfiski neaktīvi elektrolīti pie noteiktā potenciāla (HN03, H2S04, NH4NO3 utt.). Pirmkārt, X un T tiek iegūtas strāvas un sprieguma līknes (polarogrammas) tādos pašos apstākļos, kādos paredzēts veikt amperometrisko titrēšanu. Pamatojoties uz šīm līknēm, tiek izvēlēta potenciāla vērtība, pie kuras tiek sasniegta polarogrāfiski aktīvā X vai T ierobežojošā strāvas vērtība. Izvēlētā potenciāla vērtība tiek uzturēta nemainīga visā titrēšanas procesā. Amperometriskajai titrēšanai izmantotajai titranta koncentrācijai T jābūt aptuveni 10 reizes lielākai par koncentrāciju X; šajā gadījumā titrēšanas laikā praktiski nav jāievieš korekcija šķīduma atšķaidīšanai. Pretējā gadījumā ir izpildīti visi nosacījumi, kas nepieciešami polarogrammu iegūšanai. Termostatēšanas prasības ir mazāk stingras nekā tiešai polarogrāfijai, jo titrēšanas beigas nosaka nevis difūzijas strāvas absolūtā vērtība, bet gan krasas tās vērtības izmaiņas. Analizēto šķīdumu, kas satur X, pievieno polarogrāfiskajai šūnai, un mazās porcijās pievieno titrantu T, katru reizi mērot strāvu i. Strāvas i lielums ir atkarīgs no polarogrāfiski aktīvās vielas koncentrācijas. Ekvivalences punktā i vērtība krasi mainās. Pamatojoties uz amperometriskās titrēšanas rezultātiem, tiek veidotas titrēšanas līknes. Amperometriskā titrēšanas līkne ir grafisks attēlojums strāvas izmaiņām / kā pievienotā titranta tilpuma V funkciju. Titrēšanas līkne tiek attēlota koordinātēs strāva i - pievienotā titranta T tilpums (vai titrēšanas pakāpe). Atkarībā no titrējamās vielas X un titrētāja T rakstura amperometriskās titrēšanas līknes var būt dažāda veida. Biamperometrisko titrēšanu veic, enerģiski maisot šķīdumu iekārtā, kas sastāv no līdzstrāvas avota ar potenciometru, no kura caur jutīgu mikroampermetru uz elektroķīmiskās šūnas elektrodiem tiek piegādāta regulējama potenciāla starpība (0,05-0,25 V). Pirms titrēšanas titrējamo šķīdumu pievieno pēdējam un titrējošo vielu pievieno pa daļām, līdz strāva pēkšņi apstājas vai parādās, kā to nosaka mikroampermetra rādījums. Elektroķīmiskajā šūnā izmantotie platīna elektrodi tiek periodiski tīrīti, tos ~30 minūtes iegremdējot verdošā koncentrētā slāpekļskābē, kas satur dzelzs hlorīda piedevas, pēc tam elektrodus mazgājot ar ūdeni. Biamperometriskā titrēšana ir farmakopejas metode; izmanto jodometrijā, nitritometrijā, akvametrijā un titrēšanai neūdens vidē. 6. NODAĻA. KULOMETRISKĀ ANALĪZE (KULOMETRIJA) 1 Metodes principi elektroķīmiskā konduktometrija titrēšanas kulometrija Kulometriskā analīze (kulometrija) balstās uz attiecības izmantošanu starp vielas masu m, kas reaģēja elektrolīzes laikā elektroķīmiskajā šūnā, un elektroenerģijas daudzumu Q, kas iziet cauri elektroķīmiskajai šūnai tikai šīs vielas elektrolīzes laikā. Saskaņā ar Faradeja vienoto elektrolīzes likumu masa m (gramos) ir saistīta ar elektroenerģijas daudzumu Q (kulonos) ar sakarību (27) kur M ir elektrolīzes laikā reaģējušās vielas molārā masa, g/mol; n ir elektronu skaits, kas piedalās elektrodu reakcijā; 96487 C/mol ir Faradeja skaitlis. Elektrolīzes laikā caur elektroķīmisko elementu izvadītais elektroenerģijas daudzums Q (C) ir vienāds ar elektriskās strāvas i (A) un elektrolīzes laika reizinājumu. τ ( punktā c): Ja mēra elektroenerģijas daudzumu Q, tad saskaņā ar (27) var aprēķināt masu m. Tas ir taisnība gadījumā, ja viss elektroenerģijas daudzums Q, kas elektrolīzes laikā tiek izvadīts caur elektroķīmisko elementu, tiek iztērēts tikai a elektrolīzes procesam. dotā viela; blakus procesi ir jāizslēdz. Citiem vārdiem sakot, strāvas jaudai (efektivitātei) jābūt 100%. Tā kā saskaņā ar M. Faradeja vienoto elektrolīzes likumu, lai noteiktu elektrolīzes laikā reaģētās vielas masu t (g), ir nepieciešams izmērīt elektroenerģijas daudzumu Q, kas iztērēts nosakāmās vielas elektroķīmiskajai transformācijai. , kulonos, metodi sauc par kulonometriju. Kulonometrisko mērījumu galvenais uzdevums ir pēc iespējas precīzāk noteikt elektroenerģijas daudzumu Q. Kulometriskā analīze tiek veikta vai nu amperostatiskā (galvanostatiskā) režīmā, t.i. ar pastāvīgu elektrisko strāvu i=const, vai ar kontrolētu konstantu darba elektroda potenciālu (potenciostatiskā kulometrija), kad elektrolīzes procesā mainās (samazinās) elektriskā strāva. Pirmajā gadījumā, lai noteiktu elektroenerģijas daudzumu Q, pietiek pēc iespējas precīzāk izmērīt elektrolīzes laiku t(s), līdzstrāvu /(A) un aprēķināt Q vērtību, izmantojot formulu (10.28). Otrajā gadījumā Q vērtību nosaka vai nu ar aprēķinu, vai izmantojot ķīmiskos kulonometrus. Ir tiešā kulometrija un netiešā kulometrija (kulometriskā titrēšana). Metodes būtība. Tiešo kulonometriju ar pastāvīgu strāvu izmanto reti. Biežāk kulometriju izmanto ar kontrolētu nemainīgu darba elektroda potenciālu vai tiešu potenciostatisku kulometriju. Tiešā potenciostatiskā kulometrijā nosakāmā viela tiek tieši elektrolizēta. Tiek mērīts elektroenerģijas daudzums, kas iztērēts šīs vielas elektrolīzē, un, izmantojot vienādojumu, tiek aprēķināta nosakāmās vielas masa m. Elektrolīzes procesā darba elektroda potenciāls tiek uzturēts nemainīgs, E = const, kam parasti tiek izmantotas ierīces - potenciostati. Potenciāla E konstantā vērtība tiek izvēlēta iepriekš, pamatojoties uz strāvas-sprieguma (polarizācijas) līkni, kas konstruēta koordinātēs strāva i - potenciāls E (kā tas tiek darīts polarogrāfijā), kas iegūta tādos pašos apstākļos, kādos notiks elektrolīze. Izpildīts. Parasti tiek izvēlēta potenciāla vērtība E, kas atbilst analizējamās vielas ierobežojošajam strāvas apgabalam un ir nedaudz augstāka par tās pusviļņa potenciālu E12 (par -0,05–0,2 V). Pie šīs potenciāla vērtības, tāpat kā polarogrāfijā, fona elektrolītam nevajadzētu pakļaut elektrolīzi. Elektrolīzes procesam turpinoties ar nemainīgu potenciālu, elektriskā strāva šūnā samazinās, jo samazinās elektroaktīvās vielas koncentrācija, kas piedalās elektrodu reakcijā. Šajā gadījumā elektriskā strāva laika gaitā samazinās saskaņā ar eksponenciālu likumu no sākotnējās vērtības i0 laikā t = O līdz vērtībai i laikā t: kur koeficients k ir atkarīgs no reakcijas rakstura, elektroķīmiskās šūnas ģeometrijas, darba elektroda laukuma, nosakāmās vielas difūzijas koeficienta, šķīduma maisīšanas ātruma un tā tilpuma. Metodes elektrības daudzuma noteikšanai caur šķīdumu tiešā potenciostatiskā kulometrijā. Q vērtību var noteikt ar aprēķinu metodēm vai izmantojot ķīmisko kulonometru. a) Daudzuma Q aprēķins no laukuma zem līknes i pret m. Lai noteiktu Q bez ievērojamas kļūdas, metode prasa gandrīz pilnīgu elektrolīzes procesa pabeigšanu, t.i. ilgu laiku. Praksē, kā minēts iepriekš, laukumu mēra ar atbilstošu m vērtību 0,001i0 (0,1% no i0). b) Q vērtības aprēķins, pamatojoties uz In / no m atkarību. Saskaņā ar to mums ir: Q = 0∞i0e-k τ d τ =i00∞e-k τ d τ =i0k Tāpēc ka ∞i0e-k τ d τ = - k-1 e-k∞-e-k0= k-10-1=k-1 Tiešās kulonometrijas pielietojums. Metodei ir augsta selektivitāte, jutība (līdz 10~8-10~9 g vai līdz ~10~5 mol/l), reproducējamība (līdz ~1-2%), un tā ļauj noteikt mikropiemaisījumu saturu. Metodes trūkumi ietver lielo darba intensitāti un analīzes ilgumu, kā arī nepieciešamību pēc dārgām iekārtām. Ar tiešo kulometriju var noteikt - katodiskās reducēšanas laikā - metālu jonus, organiskos nitro- un halogēna atvasinājumus; anodiskās oksidācijas laikā - hlorīds, bromīds, jodīds, tiocianāta anjoni, metālu joni zemākos oksidācijas pakāpēs, pārvēršot tos augstākās oksidācijas pakāpēs, piemēram: As(IH) -> As(V),Cr(II) -> Cr(III) ), Fe(II) -» Fe(III), T1(I) -> Tl(III) utt. Farmaceitiskajā analīzē tiešo kulometriju izmanto, lai noteiktu askorbīnskābi un pikrīnskābi, novokaīnu, hidroksihinolīnu un dažos citos gadījumos. Kā minēts iepriekš, tiešā kulometrija ir diezgan darbietilpīga un laikietilpīga. Turklāt dažos gadījumos blakus procesi sāk manāmi notikt pat pirms galvenās elektroķīmiskās reakcijas pabeigšanas, kas samazina strāvas efektivitāti un var izraisīt būtiskas analīzes kļūdas. Tāpēc biežāk tiek izmantota netiešā kulometrija – kulometriskā titrēšana. 3 Kulometriskā titrēšana Metodes būtība. Kulonometriskajā titrācijā analizējamā viela X, kas atrodas šķīdumā elektroķīmiskajā šūnā, reaģē ar “titrantu” T – vielu, kas nepārtraukti veidojas (ģenerējas) uz ģeneratora elektroda šķīdumā esošās palīgvielas elektrolīzes laikā. Titrēšanas beigas - brīdis, kad visa analizējamā viela X ir pilnībā reaģējusi ar radīto “titrantu” T, tiek fiksēts vai nu vizuāli ar indikatora metodi, ievadot šķīdumā atbilstošu indikatoru, kas maina krāsu pie TE, vai arī izmantojot instrumentālās metodes. - potenciometriski, amperometriski, fotometriski. Tādējādi kulometriskajā titrēšanā titrēšanas līdzeklis netiek pievienots no biretes titrējamajam šķīdumam. Titranta lomu spēlē viela T, kas nepārtraukti tiek ģenerēta elektroda reakcijas laikā uz ģeneratora elektroda. Acīmredzot pastāv analoģija starp parasto titrēšanu, kad titrētājs tiek ievadīts no ārpuses titrētajā šķīdumā un, pievienojot to, reaģē ar analizējamo vielu, un vielas T ģenerēšanu, kas, veidojoties, arī reaģē. ar analītu. Tāpēc aplūkojamo metodi sauc par “kulometrisko titrēšanu”. Kulometriskā titrēšana tiek veikta amperostatiskā (galvanostatiskā) vai potenciostatiskā režīmā. Biežāk kulometriskā titrēšana tiek veikta amperostatiskā režīmā, saglabājot nemainīgu elektrisko strāvu visā elektrolīzes laikā. Pievienotā titranta tilpuma vietā kulometriskajā titrācijā mēra elektrolīzes laiku t un strāvu i. Vielas T veidošanās procesu kulometriskajā šūnā elektrolīzes laikā sauc par titranta veidošanos. Kulometriskā titrēšana pie pastāvīgas strāvas. Kulometriskās titrēšanas laikā amperostatiskā režīmā (pie nemainīgas strāvas) tiek mērīts laiks t, kurā tika veikta elektrolīze, un, izmantojot formulu, tiek aprēķināts elektrolīzes laikā patērētās elektroenerģijas daudzums Q, pēc kura tiek noteikta analizējamās vielas X masa. attiecība. Tā, piemēram, sālsskābes HC1 šķīduma standartizāciju ar kulometriskās titrēšanas metodi veic, titrējot standartizētā HC1 saturošā šķīduma ūdeņraža jonus H30+, kas elektriski ģenerēti pie platīna katoda ar hidroksīda joniem OH- elektrolīzes laikā. ūdens: Н20 + 2е = 20Н- + Н2 Iegūtais titrants - hidroksīda joni - reaģē ar H30+ joniem šķīdumā: H30+ + OH- = 2H20 Titrēšanu veic indikatora fenolftaleīna klātbūtnē un pārtrauc, kad šķīdumam parādās gaiši rozā krāsa. Zinot līdzstrāvas i lielumu (ampēros) un laiku t (sekundēs), kas pavadīts titrēšanai, elektroenerģijas daudzumu Q (kulonos) aprēķina, izmantojot formulu (28) un tajā esošā izreaģētā HC1 masu (gramos). formulā (27) standartizētā HC1 šķīduma alikvotā daļā, kas pievienota kulometriskajai šūnai (ģeneratora traukā). Kulometriskās titrēšanas nosacījumi. No iepriekš minētā izriet, ka kulometriskās titrēšanas veikšanas nosacījumiem jānodrošina 100% strāvas efektivitāte. Lai to izdarītu, jums ir jāizpilda vismaz šādas prasības. a) Papildu reaģentam, no kura tiek ģenerēts titrants pie darba elektroda, šķīdumā ir jābūt lielā pārpalikumā salīdzinājumā ar nosakāmo vielu (~ 1000 reižu pārpalikums). Šādos apstākļos parasti tiek novērstas sānu elektroķīmiskās reakcijas, no kurām galvenā ir fona elektrolīta, piemēram, ūdeņraža jonu, oksidēšana vai reducēšana: Н+ + 2е = Н2 b) Līdzstrāvas vērtībai i=const elektrolīzes laikā jābūt mazākai par palīgreaģenta difūzijas strāvas vērtību, lai izvairītos no reakcijas, kurā iesaistīti fona elektrolīta joni. c) Nepieciešams pēc iespējas precīzāk noteikt elektrolīzes laikā patērētās elektroenerģijas daudzumu, kas prasa precīzi reģistrēt laika skaitīšanas sākumu un beigas un elektrolīzes strāvas lielumu. Kulometriskā titrēšana pie nemainīga potenciāla. Potenciostatisko režīmu kulometriskajā titrēšanā izmanto retāk. Kulometriskā titrēšana potenciostatiskā režīmā tiek veikta pie nemainīgas potenciāla vērtības, kas atbilst vielas izlādes potenciālam uz darba elektroda, piemēram, metāla katjonu M "* katodiskās reducēšanas laikā uz platīna darba elektroda. Kā reakcija Rezultātā potenciāls paliek nemainīgs, līdz reaģē visi metāla katjoni, pēc tam tas strauji samazinās, jo šķīdumā vairs nav potenciālu noteicošu metāla katjonu. Kulometriskās titrēšanas pielietošana. Kulonometriskajā titrēšanā var izmantot visu veidu titrimetriskās analīzes reakcijas: skābes-bāzes, redoksu, izgulsnēšanas, kompleksēšanas reakcijas. Tādējādi nelielus skābju daudzumus var noteikt ar kulometrisko skābju-bāzes titrēšanu ar elektroģenerētiem OH-joniem, kas veidojas ūdens elektrolīzes laikā pie katoda: Н20 + 2е = 20Н" + Н2 Bāzes var titrēt arī ar ūdeņraža joniem H+, kas ūdens elektrolīzes laikā rodas pie anoda: Н20-4е = 4Н+ + 02 Ar redoksbromometrisko kulometrisko titrēšanu iespējams noteikt arsēna(III), antimona(III), jodīdu, hidrazīna, fenolu un citu organisko vielu savienojumus. Broms, kas tiek elektriski ģenerēts pie anoda, darbojas kā titrants: VG -2e = Vg2 Ar nokrišņu kulometrisko titrēšanu var noteikt halogenīdu jonus un organisko sēru saturošus savienojumus ar elektroģenerētiem sudraba katjoniem Ag+, cinka katjonus Zn2+ ar elektroģenerētiem ferocianīda joniem utt. Metāla katjonu kompleksometrisko kulometrisko titrēšanu var veikt ar EDTA anjoniem, kas elektroģenerēti uz dzīvsudraba (I) kompleksonāta katoda. Kulometriskajai titrēšanai ir augsta precizitāte, plašs pielietojums kvantitatīvā analīzē, ļauj noteikt nelielu daudzumu vielu, zemas izturības savienojumus (jo tie reaģē uzreiz pēc to veidošanās), piemēram, varu (1), sudrabu (H) , alva (P), titāns (III), mangāns (III), hlors, broms utt. Metodes priekšrocības ietver arī to, ka nav nepieciešama titranta sagatavošana, standartizācija un uzglabāšana, jo tas nepārtraukti veidojas elektrolīzes laikā un nekavējoties tiek patērēts reakcijā ar nosakāmo vielu. SECINĀJUMS Elektroķīmiskās analīzes metodes balstās uz procesiem, kas notiek uz elektrodiem vai starpelektrodu telpā. Elektroķīmiskās analīzes metodes ir vienas no vecākajām fizikāli ķīmiskajām analīzes metodēm (dažas aprakstītas 19. gadsimta beigās). To priekšrocība ir gan aprīkojuma, gan analīzes metožu augstā precizitāte un salīdzinošā vienkāršība. Augstu precizitāti nosaka ļoti precīzi likumi, ko izmanto elektroķīmiskajās analīzes metodēs, piemēram, Faradeja likums. Liela ērtība ir tā, ka tiek izmantotas elektriskās ietekmes, un tas, ka šīs ietekmes rezultāts (atbilde) tiek iegūts elektriskā signāla veidā. Tas nodrošina lielu lasīšanas ātrumu un precizitāti un paver plašas automatizācijas iespējas. Elektroķīmiskās analīzes metodes izceļas ar labu jutību un selektivitāti, dažos gadījumos tās var klasificēt kā mikroanalīzi, jo dažkārt analīzei pietiek ar mazāk nekā 1 ml šķīduma. Viņu instruments ir elektroķīmiskā šūna, kas ir trauks ar elektrolīta šķīdumu, kurā ir iegremdēti vismaz divi elektrodi. Atkarībā no risināmās problēmas, trauka forma un materiāls, elektrodu skaits un veids, šķīdums un analīzes apstākļi (pielietotais spriegums (strāva) un reģistrētais analītiskais signāls, temperatūra, maisīšana, attīrīšana ar inertu gāzi utt.). ) var atšķirties. Nosakāmā viela var būt gan elektrolīta, kas piepilda elementu, gan viena no elektrodiem. Mūsdienu pasaulē svarīga loma ir elektroķīmiskajām analīzes metodēm. Mūsu laikā rūpes par vidi ir īpaši svarīgas. Izmantojot šīs metodes, ir iespējams noteikt ļoti daudz dažādu organisko un neorganisko vielu saturu. Tagad tie ir efektīvāki bīstamo vielu identificēšanā.
Nosūtiet savu labo darbu zināšanu bāzē ir vienkārši. Izmantojiet zemāk esošo veidlapu
Studenti, maģistranti, jaunie zinātnieki, kuri izmanto zināšanu bāzi savās studijās un darbā, būs jums ļoti pateicīgi.
Publicēts http://www.allbest.ru
Krievijas Federācijas Izglītības un zinātnes ministrija
Federālā valsts budžeta izglītības iestāde
augstākā izglītība
"Irkutskas Nacionālā pētniecības tehniskā universitāte"
Krāsaino metālu metalurģijas katedra
(nodaļas nosaukums)
"Elektroķīmiskās izpētes metodes"
Abstrakts par disciplīnu
“Metalurģijas procesu pētīšanas fizikāli ķīmiskās metodes”
Aizpildījis skolēns no grupas MCM-16-1
Zaharenkovs R.I.
Pārbaudījis MCM nodaļas pasniedzējs
Kuzmina M.Ju.
Irkutska 2017
IEVADS
Elektroķīmija ir fizikālās ķīmijas nozare, kas aplūko sistēmas, kas satur jonus (elektrolītu šķīdumus vai kausējumus), un procesus, kas notiek uz divu fāžu robežas, piedaloties lādētām daļiņām.
Pirmās idejas par ķīmisko un elektrisko parādību attiecībām bija zināmas 18. gadsimtā, jo tika veikts milzīgs skaits fizikālu un ķīmisku eksperimentu ar elektrisko un zibens izlādi ar lādiņiem, kas atradās Leidenas burkās, taču tie visi bija nejauši. dabu, jo trūkst pastāvīga spēcīga elektriskās enerģijas avota. Elektroķīmijas izcelsme ir saistīta ar L. Galvani un A. Volta vārdiem. Pētot vardes fizioloģiskās funkcijas, Galvani nejauši izveidoja elektroķīmisko ķēdi. Tas sastāvēja no diviem dažādiem metāliem un sagatavotas vardes kājas. Ķepa bija gan elektrolīts, gan elektriskās strāvas indikators, taču secinājums sniegts nepareizi, t.i., pēc Galvani domām, šī ķēdē radusies elektriskā strāva bija dzīvnieku izcelsmes, t.i., bija saistīta ar elektrisko strāvu funkcionālajām īpašībām. vardes ķermenis (teorija “dzīvnieku elektrība”).
Pareizu Galvani eksperimentu interpretāciju sniedza A. Volta. Viņš radīja pirmo galvanisko elementu bateriju - voltaic kolonnu. Akumulatora šūnas sastāvēja no vara un cinka diskiem, un elektrolīts bija sūkļa materiāls, kas iemērc sālsūdenī vai skābē. Tieši šis savienojums ļāva iegūt elektrisko strāvu. Drīz, pateicoties izcilo zinātnieku A. Volta, J. Daniela, B. S. Jacobi, P. R. Bagrationa, G. Plante un citu darbiem, parādījās jaudīgi galvaniskie elementi un baterijas, viegli lietojamas. Tad A. Volta izstrādāja virkni metāla spriegumu. Ja saskaras un pēc tam atdala divus dažādus metālus, tad izmantojot fiziskus līdzekļus, piemēram, elektroskopu, var redzēt, ka viens metāls ir ieguvis pozitīvu lādiņu, bet otrs negatīvu. Šī metālu sērija, kurā katrs iepriekšējais metāls ir pozitīvi uzlādēts, bet pēc saskares ar jebkuru nākamo, t.i., Volta sēriju, izrādījās līdzīga sprieguma sērijai.
Tālāk 19. gadsimta sākumā tika izstrādāta elektrolīze, un M. Faradejs noteica elektrolīzes kvantitatīvos likumus. Zinātnieki sniedza lielu ieguldījumu elektroķīmijas attīstībā: S. A. Arrhenius, V. F. Ostwald, R. A. Colley, P. Debye, W. Nernst, G. Helmholtz uc Tagad elektroķīmija ir sadalīta teorētiskajā un lietišķajā. Izmantojot elektroķīmiskas metodes, tas ir saistīts ar citām fizikālās ķīmijas nozarēm, kā arī ar analītisko ķīmiju un citām zinātnēm.
elektroķīmiskā potenciometrija konduktometrija kulometrija
1 . ELEKTROĶĪMISKĀS PĒTNIECĪBAS METODES
Nepieciešamība izmantot dažādas metodes elektroķīmisko procesu pētīšanai ir saistīta ar plašo elektronu pārneses ātruma variāciju diapazonu elektrodu reakcijās. Katrai no metodēm ir noteikta robeža apmaiņas strāvas blīvuma noteiktajai vērtībai, virs kuras nevar noteikt elektrodu reakcijas elektroķīmiskos parametrus. Attiecībā uz katru konkrēto objektu ir jāizvēlas tā metode, kas nodrošina maksimālu ticamas informācijas apjomu. Veicot elektroķīmiskos pētījumus, jāzina izejvielu un reakcijas produktu ķīmiskais sastāvs. Lai noteiktu elektrolīta sastāvu, tiek izmantotas dažādas fizikālās un ķīmiskās metodes: spektrofotometriskā, potenciometriskā, analītiskā un citas. Veicot elektroķīmiskos pētījumus, jāievēro šādi nosacījumi.
1. Maksimālā izmantoto reaģentu tīrība; stingri jāzina elektrodu sastāvs, kā arī to virsmu stāvoklis. Jāraugās, lai mērījumu laikā elektrodu virsma netiktu mainīta.
2. Elektroķīmiskās šūnas un tajā izvietoto elektrodu konstrukcijai jānodrošina vienmērīgs strāvas sadalījums pa visu darba elektroda virsmu.
3. Mērījumi jāveic stingri kontrolētā temperatūrā.
4. Uzturēt nemainīgu spiedienu un gāzes fāzes sastāvu virs elektrolīta. Parasti pētījumi tiek veikti inertās gāzes vidē (N 2, Ar, Ne, He H 2), jo skābeklis gāzes fāzē var būtiski ietekmēt procesa mehānismu.
5. Nepieciešams nodrošināt tādus eksperimentālos apstākļus, kuros potenciālais kritums elektriskā dubultslāņa difūzajā daļā būtu minimāls vai precīzi zināms. Lai samazinātu šo potenciālu, parasti tiek izmantots fona elektrolīts, kura koncentrācijai jābūt ne mazāk kā 20 reizes lielākai par galvenās vielas koncentrāciju. Tomēr vispirms ir jāpārliecinās, vai fona elektrolīts neizkropļo pētāmās reakcijas polarizācijas līkni.
6. Precīzs darba elektrodu potenciāla mērījums. Lai to izdarītu, ir jānovērš difūzijas potenciāls starp pētāmo elektrolītu un atsauces elektroda elektrolītu. Šis potenciāls iegūst maksimālo vērtību, tuvojoties ierobežojošajai strāvai un var būtiski izkropļot mērījumu rezultātus. Lai novērstu difūzijas potenciālu starp pētāmo elektrolītu un atsauces elektroda elektrolītu, ir vēlams: a) izvēlēties atsauces elektrodu, kuram ir tāds pats elektrolīta sastāvs kā pētāmajam. Piemēram, pētot hlorīda šķīdumos, ir ērti izmantot sudraba hlorīda, kalomela un hlora elektrodus; skābos sulfāta šķīdumos - dzīvsudraba-sulfāta elektrodi utt.; b) izmantot atsauces elektrodu ar elektrolītu, kura robežās ar pētāmo elektrolītu var aprēķināt difūzijas potenciālu, izmantojot zināmas formulas.
Mērot šķīdumos ar nemainīgu jonu stiprumu un pie lielām fona koncentrācijām - ar nemainīgu jonu koncentrāciju, principā var izmantot jebkuru atsauces elektrodu. Difūzijas potenciāls šajā gadījumā var būt ļoti liels, bet arī nemainīgs – to var aprēķināt vai noteikt eksperimentāli.
Visos gadījumos, kad tiek pētīta elektroķīmisko procesu kinētika, ir nepieciešams izmērīt strāvas blīvumu. Parasti viņi sāk, izmantojot analītiskās ķīmijas un kulometrijas metodes, lai noteiktu, vai elektrodā notiek tikai viena pētāmā reakcija, vai arī to sarežģī blakusreakcijas. Blakusreakciju gadījumā ir jānoskaidro, kāda strāvas daļa ir saistīta tikai ar pētāmās reakcijas realizāciju (konstruēt pētāmajai reakcijai tā saukto daļējās polarizācijas raksturlielumu).
Elektrodu reakcijas mehānismu visvienkāršāk var interpretēt tikai tādā gadījumā, kad izejviela tiek pārvērsta vienā produktā ar 100% strāvas efektivitāti. Pārbaudot reakcijas atbilstību Faradeja likumam vai veicot kulometriskos mērījumus, varat vienlaikus noteikt elektronu skaitu, kas piedalās kopējā elektrodu reakcijā. Zinot izejvielas un reakcijas produkta sastāvu, kā arī kopējo pārnesto elektronu skaitu, ir iespējams pierakstīt kopējās elektrodu reakcijas vienādojumu.
Nākamais solis elektrodu reakcijas mehānisma izpētē ir noskaidrot, kurš posms ir ierobežojošs.
Ja ierobežojošais posms ir izlādes-jonizācijas stadija un visas pārējās notiek atgriezeniski, tad procesa galvenos kinētiskos parametrus var noteikt grafiski vai analītiski, piemērojot polarizācijas raksturlielumiem lēnās izlādes teorijas vienādojumus.
1.1 Elektroķīmiskās analīzes metodes
Elektroķīmiskās metodesanalīze ir kvalitatīvas un kvantitatīvās analīzes metožu kopums, kas balstās uz elektroķīmiskām parādībām, kas notiek pētāmajā vidē vai saskarnē un ir saistītas ar izmaiņām analizējamās vielas struktūrā, ķīmiskajā sastāvā vai koncentrācijā.
Ir tiešas un netiešas elektroķīmiskās metodes. Tiešās metodes izmanto strāvas stipruma (potenciāla utt.) atkarību no nosakāmās sastāvdaļas koncentrācijas. Izmantojot netiešās metodes, mēra strāvas stiprumu (potenciālu utt.), lai atrastu analizējamās vielas titrēšanas beigu punktu ar piemērotu titrētāju, t.i. Tiek izmantota izmērītā parametra atkarība no titranta tilpuma.
Jebkura veida elektroķīmiskiem mērījumiem ir nepieciešama elektroķīmiskā ķēde vai elektroķīmiskā šūna, kuras neatņemama sastāvdaļa ir analizētais šķīdums.
Elektroķīmiskās metodes tiek klasificētas atkarībā no analīzes procesā izmērīto parādību veida. Ir divas elektroķīmisko metožu grupas:
1. Metodes bez sveša potenciāla uzlikšanas, pamatojoties uz potenciālu starpības mērīšanu, kas rodas elektroķīmiskajā šūnā, kas sastāv no elektroda un trauka ar testa šķīdumu. Šo metožu grupu sauc potenciometrisks. Potenciometriskās metodes izmanto elektrodu līdzsvara potenciāla atkarību no jonu koncentrācijas, kas piedalās elektroķīmiskajā reakcijā uz elektrodiem.
2. Metodes ar sveša potenciāla uzlikšanu, pamatojoties uz mērījumiem:
a) Šķīdumu elektrovadītspēja? konduktometrija;
b) elektroenerģijas daudzums, kas iet caur šķīdumu? kulometrija;
c) Strāvas atkarība no pielietotā potenciāla? voltamperometrija;
d) laiks, kas nepieciešams, lai notiktu elektroķīmiskā reakcija - hronoelektroķīmiskās metodes(hronovoltammetrija, hronokonduktometrija).
Šīs grupas metodēs elektroķīmiskās šūnas elektrodiem tiek pielietots ārējs potenciāls.
Elektroķīmiskās analīzes instrumentu galvenais elements ir elektroķīmiskā šūna. Metodēs, neuzliekot svešu potenciālu, tā ir galvaniskais elements, kurā ķīmisko redoksreakciju rezultātā rodas elektriskā strāva. Šūnā, piemēram, galvaniskajā šūnā, ar analizējamo šķīdumu saskaras divi elektrodi - indikatorelektrods, kura potenciāls ir atkarīgs no vielas koncentrācijas, un elektrods ar nemainīgu potenciālu - atsauces elektrods, pret kuru tiek pakļauts tiek mērīts indikatora elektroda potenciāls. Potenciālu starpību mēra, izmantojot īpašas ierīces - potenciometrus.
Metodēs ar sveša potenciāla uzspiešanu, elektroķīmiskā šūna, tā nosaukts tāpēc, ka pie šūnas elektrodiem pielietota potenciāla ietekmē notiek elektrolīze - vielas oksidēšanās vai reducēšanās. Konduktometriskajā analīzē tiek izmantota konduktometriskā šūna, kurā mēra šķīduma elektrisko vadītspēju. Pēc pielietošanas metodes elektroķīmiskās metodes var klasificēt tiešajās, kurās vielu koncentrāciju mēra pēc ierīces rādījumiem, un elektroķīmiskajā titrēšanā, kur ekvivalences punkta indikāciju fiksē, izmantojot elektroķīmiskos mērījumus. Atbilstoši šai klasifikācijai tiek izdalīta potenciometriskā un potenciometriskā titrēšana, konduktometrija un konduktometriskā titrēšana u.c.
Elektroķīmisko noteikšanu instrumenti papildus elektroķīmiskajai šūnai, maisītājam un slodzes pretestībai ietver ierīces potenciālu starpības, strāvas, šķīduma pretestības un elektroenerģijas daudzuma mērīšanai. Šos mērījumus var veikt ar rādītājinstrumentiem (voltmetru vai mikroampermetru), osciloskopiem un automātiskajiem ierakstīšanas potenciometriem. Ja elektriskais signāls no šūnas ir ļoti vājš, tad to pastiprina, izmantojot radio pastiprinātājus. Metožu ierīcēs ar ārēju potenciālu uzlikšanu svarīga daļa ir ierīce, kas nodrošina elementu ar atbilstošu stabilizētas līdzstrāvas vai maiņstrāvas potenciālu (atkarībā no metodes veida). Elektroķīmiskās analīzes ierīču barošanas blokā parasti ietilpst taisngriezis un sprieguma stabilizators, kas nodrošina pastāvīgu iekārtas darbību.
1.2 Potenciometrija
Potenciometrijas pamatā ir elektrisko potenciālu atšķirības mērīšana, kas rodas starp atšķirīgiem elektrodiem, kas iegremdēti šķīdumā ar nosakāmo vielu. Elektriskais potenciāls rodas pie elektrodiem, kad uz tiem notiek redoks (elektroķīmiska) reakcija. Redoksreakcijas notiek starp oksidētāju un reducētāju, veidojot redokspārus, kuru potenciālu E nosaka Nernsta vienādojums pēc pāra komponentu [ok] un [rec] koncentrācijām:
Kur E°- standarta elektrodu potenciāls, V;
n- procesā iesaistīto elektronu skaits.
Potenciometriskos mērījumus veic, nolaižot šķīdumā divus elektrodus - indikatorelektrodu, kas reaģē uz nosakāmo jonu koncentrāciju, un standarta jeb atsauces elektrodu, pret kuru mēra indikatora potenciālu. Tiek izmantoti vairāku veidu indikatori un standarta elektrodi.
Pirmā veida elektrodi atgriezenisks attiecībā pret metāla joniem, no kuriem elektrods sastāv. Kad šādu elektrodu nolaiž šķīdumā, kas satur metāla katjonus, veidojas elektrodu pāris: M n + /M.
Otrā veida elektrodi jutīgi pret anjoniem un ir metāls M, kas pārklāts ar tā nešķīstošā sāls MA ar anjonu slāni A- pret kuriem elektrods ir jutīgs. Kad šāds elektrods nonāk saskarē ar šķīdumu, kas satur norādīto anjonu A-, rodas potenciāls E, kura vērtība ir atkarīga no sāls šķīdības reizinājuma
UTC M.A. un anjonu koncentrācija [ A-] šķīdumā.
Otrā tipa elektrodi ir sudraba hlorīds un kalomelis. Piesātinātie sudraba hlorīda un kalomela elektrodi uztur nemainīgu potenciālu un tiek izmantoti kā atskaites elektrodi, pret kuriem mēra indikatora elektroda potenciālu.
Inertie elektrodi- plāksne vai stieple, kas izgatavota no grūti oksidējamiem metāliem - platīna, zelta, pallādija. Tos izmanto E mērīšanai šķīdumos, kas satur redokspāri (piemēram, Fe 3+ /Fe 2+).
Membrānas elektrodi dažādiem tipiem ir membrāna, uz kuras rodas membrānas potenciāls E. E vērtība ir atkarīga no viena un tā paša jona koncentrāciju atšķirības dažādās membrānas pusēs. Vienkāršākais un visbiežāk izmantotais membrānas elektrods ir stikla elektrods.
Nešķīstošo sāļu sajaukšanas veids AgBr, AgCl, AgI un citi ar dažām plastmasām (gumijas, polietilēns, polistirols) noveda pie radīšanas jonu selektīvie elektrodi ieslēgts Br-, Cl-, es-, selektīvi adsorbējot norādītos jonus no šķīduma, pateicoties Paneta-Fajansa-Hāna likumam. Tā kā nosakāmo jonu koncentrācija ārpus elektroda atšķiras no koncentrācijas elektroda iekšpusē, līdzsvars uz membrānas virsmām ir atšķirīgs, kas izraisa membrānas potenciāla parādīšanos.
Lai veiktu potenciometriskās noteikšanas, no indikatora atskaites elektroda tiek samontēta elektroķīmiskā šūna, kas tiek iegremdēta analizējamajā šķīdumā un savienota ar potenciometru. Potenciometrijā izmantotajiem elektrodiem ir augsta iekšējā pretestība (500-1000 MOhm), tāpēc ir potenciometru veidi, kas ir sarežģīti elektroniski augstas pretestības voltmetri. Lai mērītu elektrodu sistēmas EMF potenciometros, tiek izmantota kompensācijas ķēde, lai samazinātu strāvu šūnas ķēdē.
Visbiežāk potenciometrus izmanto tiešiem pH mērījumiem, citu jonu koncentrāciju indikatoriem. pNa, pK, pNH2, pCl un mV. Mērījumus veic, izmantojot atbilstošus jonu selektīvos elektrodus.
PH mērīšanai izmanto stikla elektrodu un atsauces elektrodu - sudraba hlorīdu. Pirms analīžu veikšanas ir jāpārbauda pH metru kalibrēšana, izmantojot standarta buferšķīdumus, kuru fiksācija ir piestiprināta ierīcei.
pH mērītāji papildus tiešajām noteikšanām pH, pNa, pK, pNH3, pCl un citi ļauj potenciometriski titrēt nosakāmo jonu.
1.3 Potenciometriskā titrēšana
Potenciometrisko titrēšanu veic gadījumos, kad ķīmiskos indikatorus nevar izmantot vai ja nav pieejams piemērots indikators.
Potenciometriskajā titrēšanā kā indikatori tiek izmantoti potenciometra elektrodi, kas ievietoti titrētajā šķīdumā. Šajā gadījumā tiek izmantoti elektrodi, kas ir jutīgi pret titrētiem joniem. Titrēšanas procesā mainās jonu koncentrācija, kas tiek reģistrēta potenciometra mērīšanas skalā. Reģistrējot potenciometra rādījumus pH vai mV vienībās, uzzīmējiet to atkarību no titrēšanas tilpuma (titrēšanas līkni), nosakiet ekvivalences punktu un titrēšanai patērētā titranta tilpumu. Pamatojoties uz iegūtajiem datiem, tiek veidota potenciometriskā titrēšanas līkne.
Potenciometriskās titrēšanas līknes forma ir līdzīga titrēšanas līknei titrimetriskā analīzē. Titrēšanas līkne tiek izmantota, lai noteiktu ekvivalences punktu, kas atrodas titrēšanas lēciena vidū. Lai to izdarītu, titrēšanas līknes posmiem tiek uzzīmētas pieskares un titrēšanas lēciena tangensas vidū tiek noteikts ekvivalences punkts. Lielākā izmaiņu vērtība ? pH/?V iegūst līdzvērtības punktā.
Ekvivalences punktu vēl precīzāk var noteikt ar Grana metodi, ko izmanto atkarības konstruēšanai ? V/?E no titranta tilpuma. Izmantojot Gran metodi, potenciometrisko titrēšanu var veikt, nenovirzot to līdz ekvivalences punktam.
Potenciometrisko titrēšanu izmanto visos titrimetriskās analīzes gadījumos.
Skābes-bāzes titrēšanai izmanto stikla elektrodu un atsauces elektrodu. Tā kā stikla elektrods ir jutīgs pret barotnes pH izmaiņām, tad, kad tās tiek titrētas, barotnes pH izmaiņas tiek reģistrētas potenciometrā. Skābju-bāzes potenciometrisko titrēšanu veiksmīgi izmanto vāju skābju un bāzu (pK?8) titrēšanai. Titrējot skābju maisījumus, ir nepieciešams, lai to pK atšķirtos par vairāk nekā 4 vienībām, pretējā gadījumā daļa vājākās skābes tiek titrēta kopā ar stipro, un titrēšanas lēciens nav skaidri izteikts.
Tas ļauj izmantot potenciometriju, lai izveidotu eksperimentālās titrēšanas līknes, atlasītu indikatorus titrēšanai un noteiktu skābuma un bāziskuma konstantes.
Nokrišņu potenciometriskajā titrēšanā kā indikatoru izmanto elektrodu, kas izgatavots no metāla, kas veido elektrodu pāri ar nosakāmajiem joniem.
Ja izmanto kompleksometrisko titrēšanu: a) metāla elektrodu, kas ir atgriezenisks pret nosakāmā metāla jonu; b) platīna elektrodu redokspāra klātbūtnē šķīdumā. Kad vienu no redokspāra sastāvdaļām saista titrants, mainās tā koncentrācija, kas izraisa indikatora platīna elektroda potenciāla izmaiņas. Izmanto arī metāla sālim pievienotā EDTA šķīduma pārpalikuma atpakaļtitrēšanu ar dzelzs (III) sāls šķīdumu.
Redox titrēšanai izmanto atsauces elektrodu un platīna indikatorelektrodu, kas ir jutīgi pret redokspāriem.
Potenciometriskā titrēšana ir viena no visbiežāk izmantotajām instrumentālās analīzes metodēm tās vienkāršības, pieejamības, selektivitātes un plašo iespēju dēļ.
1.4 Konduktometrija. Konduktometriskā titrēšana
Konduktometrijas pamatā ir šķīduma elektriskās vadītspējas mērīšana. Ja vielas šķīdumā ievieto divus elektrodus un elektrodiem piemēro potenciālu starpību, caur šķīdumu plūdīs elektriskā strāva. Tāpat kā katru elektrības vadītāju, arī risinājumus raksturo pretestība R un tā apgrieztais lielums – elektrovadītspēja L:
Kur R- pretestība, Ohm;
Īpatnējā pretestība, Ohm. cm;
S - virsmas laukums, cm2.
Kur L - elektrovadītspēja, Ohm-1;
R- pretestība, Ohm.
Konduktometriskā analīze tiek veikta, izmantojot konduktometrus - ierīces, kas mēra šķīdumu pretestību. Pēc pretestības vērtības R noteikt risinājumu elektrovadītspēju, kas ir tās apgrieztā vērtība L.
Šķīdumu koncentrāciju nosaka ar tiešo konduktometriju un konduktometrisko titrēšanu. Tiešā konduktometrija izmanto, lai noteiktu šķīduma koncentrāciju, izmantojot kalibrēšanas grafiku. Lai izveidotu kalibrēšanas grafiku, tiek mērīta virknes šķīdumu elektriskā vadītspēja ar zināmu koncentrāciju un izveidots elektriskās vadītspējas un koncentrācijas kalibrēšanas grafiks. Pēc tam mēra analizējamā šķīduma elektrovadītspēju un no grafika nosaka tā koncentrāciju.
Biežāk lietots konduktometriskā titrēšana. Šajā gadījumā analizēto šķīdumu ievieto kamerā ar elektrodiem, šūnu novieto uz magnētiskā maisītāja un titrē ar atbilstošu titrantu. Titrantu pievieno vienādās daļās. Pēc katras titranta daļas pievienošanas izmēra šķīduma elektrisko vadītspēju un uzzīmē attiecību starp elektrisko vadītspēju un titranta tilpumu. Pievienojot titrantu, notiek izmaiņas šķīduma elektrovadītspējā. titrēšanas līkne izliek.
No n jonu kustīgums ir atkarīgs no elektriskā risinājuma vadītspēja: jo lielāka ir mobilitāte b joni, jo lielāka ir elektriskā šķīduma vadītspēja.
Konduktometriskajai titrēšanai ir vairākas priekšrocības. To var veikt duļķainā un krāsainā vidē, ja nav ķīmisko indikatoru. Metodei ir paaugstināta jutība un tā ļauj analizēt vielu atšķaidītus šķīdumus (līdz 10-4 mol/dmі). Vielu maisījumus analizē ar konduktometrisko titrēšanu, jo dažādo jonu mobilitātes atšķirības ir ievērojamas, un tās var atšķirīgi titrēt viens otra klātbūtnē.
Konduktometrisko analīzi var viegli automatizēt, ja titrēšanas šķīdums tiek piegādāts no biretes ar nemainīgu ātrumu un šķīduma elektriskās vadītspējas izmaiņas tiek reģistrētas ierakstītājā.
Šo konduktometrijas veidu sauc chrono- konduktometriskā analīze.
Skābju-bāzes titrācijā stiprās skābes, vājās skābes, vājo bāzu sāļus un stiprās skābes var noteikt ar konduktometriju.
IN izgulsnējas konduktometriskaistitrēšana titrēto šķīdumu elektrovadītspēja vispirms samazinās vai paliek noteiktā nemainīgā līmenī titrētā elektrolīta saistīšanās dēļ nogulsnēs, pēc t.i. kad parādās titranta pārpalikums, tas atkal palielinās.
IN komplekssmetriskā konduktometriskā titrēšanašķīduma elektriskās vadītspējas izmaiņas rodas sakarā ar metāla katjonu saistīšanos kompleksā ar EDTA.
Redox konduktometriskaistitro- cijas pamatojoties uz reaģējošo jonu koncentrācijas izmaiņām un jaunu jonu parādīšanos šķīdumā, kas maina šķīduma elektrovadītspēju.
Pēdējos gados ir notikusi attīstība augstfrekvences konduktometrija, kurā elektrodi nesaskaras ar šķīdumu, kas ir svarīgi, analizējot agresīvas vides un šķīdumus slēgtos traukos.
Ir izstrādātas divas iespējas - taisniaugstfrekvences konduktometrija un augstfrekvences titrēšana.
Tiešo augstfrekvences konduktometriju izmanto, lai noteiktu vielu, graudu, koksnes mitruma saturu, šķīdumu koncentrāciju slēgtos traukos - ampulās, kā arī analizējot agresīvus šķidrumus.
Augstas frekvences titrēšana tiek veikta ar īpašiem titrētājiem - TV-6, TV-6L.
Augstfrekvences konduktometrisko titrēšanu veic kā skābju-bāzes, redoksu vai nokrišņu titrēšanu gadījumos, kad nav pieejams piemērots indikators vai analizējot vielu maisījumus.
1.5 Kulometrija. Kulometriskā titrēšana
Kulometrijā vielas nosaka, mērot elektroenerģijas daudzumu, kas iztērēts to kvantitatīvajai elektroķīmiskajai transformācijai. Kulometrisko analīzi veic elektrolītiskajā šūnā, kurā ievieto nosakāmās vielas šķīdumu. Ja šūnas elektrodiem tiek pielietots atbilstošs potenciāls, notiek vielas elektroķīmiskā reducēšana vai oksidēšana. Saskaņā ar Faradeja atklātajiem elektrolīzes likumiem vielas daudzums, kas reaģē uz elektrodu, ir proporcionāls elektrības daudzumam, kas iet caur šķīdumu:
Kur g- izdalītās vielas masa, g;
n- elektrodu procesā pārnesto elektronu skaits;
F- Faradeja skaitlis (F = 96485 C/mol);
es- strāvas stiprums, A;
t- laiks, s;
M- izdalītās vielas molārā masa, g/mol.
Kulonometriskā analīze ļauj noteikt vielas, kas elektroķīmiskās reakcijas laikā nenogulsnējas uz elektrodiem vai neizplūst atmosfērā.
Ir tiešā kulometrija un kulometriskā titrēšana.. Elektriskās strāvas mērīšanas metožu augstā precizitāte un jutīgums nodrošina kulometrisko analīzi ar unikālu precizitāti 0,1-0,001%, un jutību līdz 1 10 -8? 1 10 -10 g.Tādēļ vielu mikropiemaisījumu un iznīcināšanas produktu noteikšanai izmanto kulometrisko analīzi, kas ir svarīgi, uzraugot to kvalitāti.
Lai norādītu t.i. Veicot kulometrisko titrēšanu, var izmantot ķīmiskās un instrumentālās metodes - indikatoru pievienošanu, krāsaino savienojumu noteikšanu fotometriski vai spektrofotometriski.
Atšķirībā no citām analīzes metodēm, kulometriju var pilnībā automatizēt, kas samazina nejaušās noteikšanas kļūdas. Šī funkcija tika izmantota, lai izveidotu automātiskus kulometriskos titrētājus - jutīgus instrumentus, ko izmanto īpaši precīzām analīzēm, ja citas metodes nav pietiekami jutīgas. Analizējot ūdenī slikti šķīstošas vielas, kulometriju var veikt no acetilēna melnajiem elektrodiem, kas ir labs adsorbents un pietiekami pilnībā izvada šādas vielas no reakcijas vides. Kulometriskā titrēšana ir daudzsološa instrumentālās analīzes metode. Tas var atrast plašu pielietojumu vairāku īpašu analītisko problēmu risināšanā - piemaisījumu, nelielu zāļu daudzumu analīzei, toksisko vielu, mikroelementu un citu savienojumu noteikšanai bioloģiskajā materiālā un vidē.
SECINĀJUMS
Darbā sniegts galveno elektroķīmisko pētījumu metožu apskats, detalizēti aprakstot to principu, pielietojumu, priekšrocības un trūkumus.
Elektroķīmiskās analīzes metodes ir kvantitatīvās ķīmiskās analīzes metožu grupa, kuras pamatā ir elektrolīzes izmantošana.
Metodes veidi ir elektrogravimetriskā analīze (elektroanalīze), iekšējā elektrolīze, metālu kontakta apmaiņa (cementēšana), polarogrāfiskā analīze, kulometrija utt. Jo īpaši elektrogravimetriskā analīze balstās uz vielas svēršanu, kas izdalās uz viena no elektrodiem. Metode ļauj veikt ne tikai vara, niķeļa, svina u.c. kvantitatīvās noteikšanas, bet arī atdalīt vielu maisījumus.
Turklāt elektroķīmiskās analīzes metodes ietver metodes, kuru pamatā ir elektriskās vadītspējas (konduktometrija) vai elektrodu potenciāla (potenciometrija) mērīšana. Dažas elektroķīmiskās metodes tiek izmantotas, lai atrastu titrēšanas beigu punktu (amperometriskā titrēšana, konduktometriskā titrēšana, potenciometriskā titrēšana, kulometriskā titrēšana).
IZMANTOTO ATSAUCES SARAKSTS
1. Mūsdienu elektroķīmiskās analīzes pamati. Budņikovs G.K., Maistrenko V.N., Vjaseļevs M.R., M., Mir, 2003.g.
2. J. Plambeck, red. S. G. Mayranovskis Elektroķīmiskās analīzes metodes. Teorijas un pielietojuma pamati: trans. no angļu valodas / Vidannya: Mir, 1985.
3. Damaskin B.B., Petriy O.A., Tsirlina G.A. Elektroķīmija - M.: ķīmija, 2001. 624 lpp.
4. STO 005-2015. Kvalitātes vadības sistēma. Izglītojoši un metodiskie pasākumi. Tehnisko specialitāšu kursu projektu (darbu) un galīgo kvalifikācijas darbu reģistrācija.
Ievietots vietnē Allbest.ru
...Līdzīgi dokumenti
Elektroķīmisko analīzes metožu klasifikācija, voltammetrijas, konduktometrijas, potenciometrijas, amperometrijas, kulometrijas būtība, to pielietojums vides aizsardzībā. Ķīmiskās analītisko iekārtu un galveno tirdzniecības uzņēmumu raksturojums.
kursa darbs, pievienots 01.08.2010
Elektroķīmiskās metodes ir balstītas uz pētāmajā šķīdumā notiekošo elektroķīmisko parādību elektrisko parametru mērīšanu. Elektroķīmisko analīzes metožu klasifikācija. Potenciometriskā, konduktometriskā, kulometriskā titrēšana.
abstrakts, pievienots 01.07.2011
Elektroķīmisko analīzes metožu klasifikācija. Vielas koncentrācijas potenciometriskā noteikšana šķīdumā. Konduktometrijas princips. Reakciju veidi konduktometriskās titrēšanas laikā. Kvantitatīvā polarogrāfiskā analīze. Tiešā kulometrija.
kursa darbs, pievienots 04.04.2013
Elektroanalītisko metožu būtība, spēja iegūt eksperimentālu informāciju par ķīmisko sistēmu kinētiku un termodinamiku. Voltametrijas, konduktometrijas, potenciometrijas, amperometrijas un kulometrijas priekšrocības, trūkumi un piemērotība.
abstrakts, pievienots 20.11.2009
Potenciometriskās analīzes vispārīgie raksturlielumi. Indikatora elektrodi (elektronu apmaiņas un jonu selektīvi). Potenciometriskās analīzes metodes veidi. Tiešā potenciometrija un potenciometriskā titrēšana. Elektroķīmisko ķēžu EML mērīšana.
kursa darbs, pievienots 08.06.2012
Elektroķīmisko analīzes metožu vispārīgie jēdzieni, nosacījumi un klasifikācija. Potenciometriskā analīze (potenciometrija). Amperometriskā titrēšana (potenciometriskā polarizācijas titrēšana). Kvantitatīvā polarogrāfiskā analīze.
abstrakts, pievienots 10.01.2012
Elektroķīmiskās izpētes metodes, to klasifikācija un būtība, sastopamības vēsture. Skābes koncentrācijas noteikšana ar konduktometrisko titrēšanu; elektrodu potenciāli, galvaniskā elementa EML, vara elektroķīmiskais ekvivalents.
kursa darbs, pievienots 15.12.2014
Potenciometriskās analīzes metodes izpēte. Pētījuma objektu analīze un izvērtēšana. Potenciometriskās analīzes tehnikas izpēte, kas piemērota šim objektam. Gaļas produktu potenciometriskās analīzes metožu izmantošanas iespēju noteikšana.
kursa darbs, pievienots 16.09.2017
Elektroķīmiskās analīzes pamatmetodes. Potenciometriskās analīzes vispārīgie raksturlielumi. Potenciometriskās analīzes metodes veidi. Galvaniskā elementa izmantošana, kas sastāv no diviem elektrodiem. Indikatora elektroda potenciāla mērīšanas procedūra.
kursa darbs, pievienots 11.08.2014
Instrumentālo analīzes metožu klasifikācija pēc nosakāmā parametra un mērīšanas metodes. Potenciometriskās, amperometriskās, hromatogrāfiskās un fotometriskās titrēšanas būtība. Cinka hlorīda kvalitatīvā un kvantitatīvā noteikšana.
Elektroķīmiskās analīzes metodes ir kvalitatīvas un kvantitatīvās analīzes metožu kopums, kas balstās uz elektroķīmiskām parādībām, kas notiek pētāmajā vidē vai saskarnē un ir saistītas ar izmaiņām analizējamās vielas struktūrā, ķīmiskajā sastāvā vai koncentrācijā.
Elektroķīmiskās analīzes metodes (ECMA) ir balstītas uz procesiem, kas notiek uz elektrodiem vai starpelektrodu telpā. To priekšrocība ir gan iekārtu, gan analīzes metožu augstā precizitāte un salīdzinošā vienkāršība. Augstu precizitāti nosaka ļoti precīzi ECMA izmantotie modeļi. Liela ērtība ir tā, ka šajā metodē tiek izmantotas elektriskās ietekmes, un tas, ka šīs ietekmes rezultāts (atbilde) tiek iegūts arī elektriskā signāla veidā. Tas nodrošina lielu lasīšanas ātrumu un precizitāti, kā arī paver plašas automatizācijas iespējas. ECMA izceļas ar labu jutību un selektivitāti; dažos gadījumos tos var klasificēt kā mikroanalīzi, jo dažreiz analīzei pietiek ar mazāk nekā 1 ml šķīduma.
Atkarībā no analītisko signālu veidiem tos iedala:
1) konduktometrija - testa šķīduma elektriskās vadītspējas mērīšana;
2) potenciometrija - indikatorelektroda, kuram potenciodeterminē testējamā viela, bezstrāvas līdzsvara potenciāla mērīšana;
3) kulonometrija - pētāmās vielas pilnīgai transformācijai (oksidācijai vai reducēšanai) nepieciešamā elektroenerģijas daudzuma mērīšana;
4) voltammetrija - elektrodu stacionāro vai nestacionāro polarizācijas raksturlielumu mērīšana reakcijās, kurās iesaistīta pārbaudāmā viela;
5) elektrogravimetrija - no šķīduma elektrolīzes laikā izdalītās vielas masas mērīšana.
27. Potenciometriskā metode.
potenciometrija - indikatora elektroda bezstrāvas līdzsvara potenciāla mērījums, kuram potenciāciju nosaka testējamā viela.
A) standarts (atsauces elektrods) - ir nemainīgs potenciāls, neatkarīgi no ārējām ietekmēm. Noteikumi
B) individuālais elektrods - tā potenciāls ir atkarīgs no vielas koncentrācijas.
Potenciāls ir atkarīgs no koncentrācijas: E = f(c)
Nerista vienādojums E= E° + lna kat
E° - standarta. Elektrons. Potenciāls (konst)
R- Univer. Gāzes konstantekonst)
T – absolūtā temperatūra (t)- +273 °
.п – iesaistīto elektronu skaits. Oksidācijā/reducēšanā Reakcijas
. a – aktīva koncentrācija
Potenciometrijas metode
Jonometrijas potenciometrija (pētāmajam šķīdumam pievieno nelielu šķīdumu. Pa daļām pievieno standartšķīdumu (titrānu), pēc katras pievienošanas mēra potenciālu. - E)
Ekvivalences punkts
EСх Vх = l t *Vt
28. Konduktometriskā metode.
konduktometrija - testa šķīduma elektriskās vadītspējas mērīšana.
Konduktometriskā titrēšana
Konduktometrs (ierīce)
Konduktometriskā analīze (konduktometrija) balstās uz sakarības izmantošanu starp elektrolītu šķīdumu elektrovadītspēju (elektrisko vadītspēju) un to koncentrāciju.
Elektrolītu šķīdumu - otrā tipa vadītāju - elektrovadītspēja tiek vērtēta, pamatojoties uz to elektriskās pretestības mērījumiem elektroķīmiskajā šūnā, kas ir stikla trauks (stikls), kurā ir ielodēti divi elektrodi, starp kuriem tiek ievietots testa elektrolīta šķīdums. atrodas. Caur šūnu tiek izvadīta maiņstrāva. Elektrodus visbiežāk izgatavo no metāla platīna, kas, lai palielinātu elektrodu virsmu, tiek pārklāts ar porainā platīna slāni, elektroķīmiski nogulsnējot platīna savienojumus no šķīdumiem (platinizēti platīna elektrodi).
29.Polarogrāfija.
Polarogrāfija ir kvalitatīvas un kvantitatīvās ķīmiskās analīzes metode, kuras pamatā ir strāvas un sprieguma līkņu iegūšana ķēdē, kas sastāv no pētāmā šķīduma un tajā iegremdētiem elektrodiem, no kuriem viens ir ļoti polarizējams un otrs praktiski nepolarizējams. Šādas līknes – polarogrammas – iegūst, izmantojot polarogrāfus.
Polarogrāfisko metodi raksturo augsta jutība. Lai veiktu analīzi, parasti pietiek ar 3-5 ml testa šķīduma. Analīze, izmantojot automātiskās ierakstīšanas polarogrāfu, ilgst tikai aptuveni 10 minūtes. Polarogrāfiju izmanto toksisko vielu satura noteikšanai bioloģiskas izcelsmes objektos (piemēram, dzīvsudraba, svina, tallija u.c. savienojumi), asins skābekļa piesātinājuma pakāpes noteikšanai, izelpotā gaisa sastāva izpētei, un kaitīgās vielas rūpniecības uzņēmumu gaisā.Polarogrāfiskā analīzes metode ir ļoti jutīga un ļauj noteikt vielas ar ļoti zemu (līdz 0,0001%) koncentrāciju šķīdumā.
30. Spektrālās analīzes metožu klasifikācija. Spektra jēdziens.
Spektrālā analīze ir metožu kopums kvalitātes un kvantitātes noteikšanai. Vielas sastāvs, kā arī struktūra (pamatojoties uz pētāmā objekta mijiedarbību ar dažāda veida starojumu.)
Visas spektroskopiskās metodes ir balstītas uz atomu, molekulu vai jonu, kas veido analizējamo vielu, mijiedarbību ar elektromagnētisko starojumu. Šī mijiedarbība izpaužas fotonu (kvantu) absorbcijā vai emisijā. Atkarībā no parauga mijiedarbības rakstura ar elektromagnētisko starojumu izšķir divas metožu grupas:
Emisija un absorbcija. Atkarībā no tā, kuras daļiņas veido analītisko signālu, izšķir atomu spektroskopijas metodes un molekulārās spektroskopijas metodes.
Emisija
Emisijas metodēs analizētais paraugs ierosmes rezultātā izstaro fotonus.
absorbcija
Absorbcijas metodēs starojums no ārēja avota tiek izvadīts caur paraugu, un daļu kvantu selektīvi absorbē atomi vai molekulas
Diapazons- fiziskā lieluma vērtību sadalījums (parasti enerģija, frekvence vai masa). Šāda sadalījuma grafisku attēlojumu sauc par spektrālo diagrammu. Parasti spektrs attiecas uz elektromagnētisko spektru - elektromagnētiskā starojuma frekvenču spektru (vai to pašu, kas kvantu enerģijas).
1.gaismas atspulgs
2.gaismas stara rotācija (defrakcija)
3.gaismas izkliede: nefelometrija, duļķainība
4.gaismas absorbcija
5atkārtota emisija
A) fosforescence (turas ilgu laiku)
B) fluorescence (ļoti īsa)
Atkarībā no fizikālo lielumu vērtību sadalījuma rakstura spektri var būt diskrēti (līnija), nepārtraukti (cieti), kā arī attēlot diskrētu un nepārtrauktu spektru kombināciju (superpozīcija).
Līniju spektru piemēri ir masas spektri un atomu elektronisko pāreju spektri, kas saistīti ar saiti; nepārtrauktu spektru piemēri ir sakarsētas cietas vielas elektromagnētiskā starojuma spektrs un atoma brīvo elektronisko pāreju spektrs; kombinēto spektru piemēri ir zvaigžņu emisijas spektri, kur hromosfēras absorbcijas līnijas vai lielākā daļa skaņas spektru ir uzlikti uz nepārtrauktā fotosfēras spektra.
31. Fotometrija: metodes princips, pielietojums tiesu ekspertīzē.
Fotometrija - spektrālā metode, kuras pamatā ir elektromagnētiskā starojuma absorbcija redzamajā un tuvu ultravioletajā diapazonā (metodes pamatā ir gaismas absorbcija)
Molekulārais atoms
Spektroskopijas spektroskopija (elektronu analīzē)
Kivete - caur to tiek izlaista gaisma
l
I (izejas gaismas intensitāte)
I° ir krītošās gaismas intensitāte.
Fotometrija ir fizikālās optikas un mērīšanas tehnoloģiju sadaļa, kas veltīta metodēm optiskā starojuma enerģētisko raksturlielumu izpētei tā emisijas, izplatīšanās dažādos medijos un mijiedarbības ar ķermeņiem procesā. Fotometrija tiek veikta infrasarkanā (viļņu garums - 10 -3 ... 7 10 -7 m), redzamā (7 10 -7 ... 4 10 -7 m) un ultravioletā (4 10 -7 ... 10 -8 m) optiskais starojums. Optiskā diapazona elektromagnētiskajam starojumam izplatoties bioloģiskajā vidē, tiek novērota virkne galveno efektu: starojuma absorbcija un izkliede pa vides atomiem un molekulām, vides neviendabīgumu izkliede ar daļiņām, starojuma depolarizācija. Reģistrējot datus par optiskā starojuma mijiedarbību ar vidi, ir iespējams noteikt kvantitatīvos parametrus, kas saistīti ar pētāmā objekta medicīniskajām un bioloģiskajām īpašībām. Fotometrisko lielumu mērīšanai izmanto instrumentus, ko sauc par fotometriem. Fotometriskā izteiksmē gaisma ir starojums, kas cilvēka acij pakļauts spēj radīt spilgtuma sajūtu. Fotometrijas kā zinātnes pamatā ir A. Geršuna izstrādātā gaismas lauka teorija.
Ir divas vispārīgas fotometrijas metodes: 1) vizuālā fotometrija, kas izmanto cilvēka acs spēju uztvert spilgtuma atšķirības, izlīdzinot divu salīdzināšanas lauku spilgtumu ar mehāniskiem vai optiskiem līdzekļiem; 2) fizikālā fotometrija, kurā tiek izmantoti dažādi dažāda veida gaismas uztvērēji, lai salīdzinātu divus gaismas avotus - vakuuma fotoelementus, pusvadītāju fotodiodes u.c.
32. Bouguer-Lambert-Beer likums, to izmantošana kvantitatīvā analīzē.
Fizikāls likums, kas nosaka paralēla monohromatiska gaismas stara vājināšanos, kad tas izplatās absorbējošā vidē.
Likumu izsaka ar šādu formulu:
![]() ,
,

kur ir ienākošā stara intensitāte, ir vielas slāņa biezums, caur kuru gaisma iziet, ir absorbcijas indekss (nejaukt ar bezdimensijas absorbcijas indeksu, kas ir saistīts ar formulu, kur ir viļņa garums) .
Absorbcijas indekss raksturo vielas īpašības un ir atkarīgs no absorbētās gaismas viļņa garuma λ. Šo atkarību sauc par vielas absorbcijas spektru.
Absorbējošu vielu šķīdumiem gaismu neuzsūcošos šķīdinātājos absorbcijas indeksu var uzrakstīt kā
kur ir koeficients, kas raksturo absorbējošas izšķīdušās vielas molekulas mijiedarbību ar gaismu ar viļņa garumu λ, ir izšķīdušās vielas koncentrācija, mol/l.
Apgalvojumu, kas nav atkarīgs, sauc par Bēra likumu (nejaukt ar Bēra likumu). Šis likums pieņem, ka molekulas spēju absorbēt gaismu neietekmē citas apkārtējās tās pašas vielas molekulas šķīdumā. Tomēr tiek novērotas daudzas novirzes no šī likuma, īpaši kopumā.
Ja gaismas plūsma ar intensitāti I iet caur noteiktu I biezuma šķīduma vai gāzes slāni, tad saskaņā ar Lamberta-Bēra likumu absorbētās gaismas daudzums būs proporcionāls absorbējošās vielas intensitātei /, koncentrācijai c. gaisma un slāņa biezums) BMB likums, kas saista gaismas intensitāti, kas krīt uz vielu un vielu, kas tai izgājusi cauri, ar vielas koncentrāciju un absorbējošā slāņa biezumu. Nu, tas ir tas pats, kas refrakcija, tikai vājināšanās vielā. Kas absorbē gaismu noteiktā procentā. Tas ir, atlikušā gaismas izvades daļa ir
33.IR spektroskopija.
Šīs analīzes metodes pamatā ir vielas infrasarkanās absorbcijas spektra reģistrēšana. Vielas absorbcija infrasarkanajā reģionā notiek molekulās esošo atomu vibrāciju dēļ. Vibrācijas iedala stiepšanās (kad vibrācijas laikā mainās attālumi starp atomiem) un vibrācijas (kad vibrācijas laikā mainās leņķi starp saitēm). Pārejas starp dažādiem vibrācijas stāvokļiem molekulās tiek kvantētas, kā dēļ absorbcijai IR reģionā ir spektra forma, kur katrai vibrācijai ir savs viļņa garums. Ir skaidrs, ka katras vibrācijas viļņa garums ir atkarīgs no tā, kuri atomi tajā piedalās, un turklāt tas maz ir atkarīgs no to vides.
IR spektroskopijas metode nav atdalīšanas metode, proti, pētot jebkuru vielu, var izrādīties, ka patiesībā pētītais ir bijis vairāku vielu maisījums, kas, protams, stipri izkropļos spektra atšifrēšanas rezultātus. Nav gluži pareizi runāt par vielas nepārprotamu identificēšanu, izmantojot IR spektroskopijas metodi, jo šī metode drīzāk ļauj identificēt noteiktas funkcionālās grupas, nevis to daudzumu savienojumā un to savstarpējās saziņas metodi.
IR spektroskopijas metode tiek izmantota polimērmateriālu, šķiedru, krāsu pārklājumu un narkotisko vielu izpētei (nosakot pildvielu, bieži tiek izmantoti ogļhidrāti, tostarp polisaharīdi). Metode ir īpaši neaizstājama smērvielu izpētē, jo ļauj vienlaikus noteikt gan smērvielas bāzes, gan iespējamās piedevas (piedevas) šai bāzei.
34. Rentgena fluorescences analīze.
(XRF) ir viena no mūsdienu spektroskopiskajām metodēm vielas pētīšanai, lai iegūtu tās elementāro sastāvu, tas ir, elementu analīzi. To var izmantot, lai analizētu dažādus elementus no berilija (Be) līdz urānam (U). XRF metode ir balstīta uz spektra savākšanu un sekojošu analīzi, kas iegūta, pakļaujot pētāmo materiālu rentgena starojumam. Apstarojot, atoms nonāk ierosinātā stāvoklī, kas sastāv no elektronu pārejas uz augstākiem enerģijas līmeņiem. Atoms atrodas ierosinātā stāvoklī ārkārtīgi īsu laiku, apmēram vienu mikrosekundi, pēc tam atgriežas klusā stāvoklī (pamata stāvoklī). Šajā gadījumā elektroni no ārējiem apvalkiem vai nu aizpilda radušās vakances, un liekā enerģija tiek emitēta fotona veidā, vai arī enerģija tiek pārnesta uz citu elektronu no ārējiem apvalkiem (Auger elektrons)
Ekoloģija un vides aizsardzība: smago metālu noteikšana augsnēs, nogulumos, ūdenī, aerosolos u.c.
Ģeoloģija un mineraloģija: augsnes, minerālu, iežu uc kvalitatīvā un kvantitatīvā analīze.
Metalurģija un ķīmiskā rūpniecība: izejvielu, ražošanas procesa un gatavās produkcijas kvalitātes kontrole
Krāsu un laku rūpniecība: svina krāsu analīze
35. Atomu emisijas spektroskopija.
Atomu emisijas spektrālā analīze ir elementu analīzes metožu kopums, kas balstīts uz brīvo atomu un jonu emisijas spektru izpēti gāzes fāzē. Parasti emisijas spektri tiek reģistrēti ērtākajā optiskā viļņa garuma diapazonā no 200 līdz 1000 nm.
AES (atomu emisijas spektrometrija) ir metode vielas elementārā sastāva noteikšanai no analizējamā parauga atomu un jonu optiskās emisijas spektriem, kas ierosināti gaismas avotos. Kā gaismas avoti atomu emisijas analīzei tiek izmantota degļa liesma vai dažāda veida plazma, ieskaitot elektriskās dzirksteles vai loka plazmu, lāzera dzirksteļu plazmu, induktīvi savienotu plazmu, kvēlspuldzes izlādi utt. AES ir visizplatītākā ātrā, ļoti jutīgā metode elementu piemaisījumu identificēšana un kvantitatīva noteikšana gāzveida, šķidrās un cietās vielās, ieskaitot augstas tīrības pakāpes vielās.
Lietošanas jomas:
Metalurģija: metālu un sakausējumu sastāva analīze,
Kalnrūpniecība: ģeoloģisko paraugu un minerālu izejvielu izpēte,
Ekoloģija: ūdens un augsnes analīze,
Aprīkojums: motoreļļu un citu tehnisko šķidrumu analīze metālu piemaisījumu noteikšanai,
Bioloģiskie un medicīniskie pētījumi.
Darbības princips.
Atomu emisijas spektrometra darbības princips ir diezgan vienkāršs. Tas ir balstīts uz to, ka katra elementa atomi var izstarot noteikta viļņa garuma gaismu - spektrālās līnijas, un šie viļņu garumi dažādiem elementiem ir atšķirīgi. Lai atomi sāktu izstarot gaismu, tie ir jāierosina - ar siltumu, elektrisko izlādi, lāzeru vai kādu citu līdzekli. Jo vairāk konkrētā elementa atomu ir analizētajā paraugā, jo spilgtāks būs atbilstošā viļņa garuma starojums.
Analizētā elementa spektrālās līnijas intensitāte papildus analizējamā elementa koncentrācijai ir atkarīga no daudziem dažādiem faktoriem. Šī iemesla dēļ nav iespējams teorētiski aprēķināt saistību starp līnijas intensitāti un atbilstošā elementa koncentrāciju. Tāpēc analīzei ir nepieciešami standarta paraugi, kas pēc sastāva ir līdzīgi analizējamajam paraugam. Šie standarta paraugi vispirms tiek eksponēti (sadedzināti) uz ierīces. Pamatojoties uz šo apdegumu rezultātiem, katram analizējamam elementam tiek izveidots kalibrēšanas grafiks, t.i. elementa spektrālās līnijas intensitātes atkarība no tā koncentrācijas. Pēc tam, analizējot paraugus, šos kalibrēšanas grafikus izmanto, lai pārrēķinātu izmērītās intensitātes koncentrācijās.
Paraugu sagatavošana analīzei.
Jāpatur prātā, ka patiesībā tiek analizēti vairāki miligrami parauga no tā virsmas. Tāpēc, lai iegūtu pareizus rezultātus, paraugam ir jābūt viendabīgam pēc sastāva un struktūras, un parauga sastāvam jābūt identiskam analizējamā metāla sastāvam. Analizējot metālu lietuvēs vai kausēšanas cehā, paraugu liešanai ieteicams izmantot īpašas veidnes. Šajā gadījumā parauga forma var būt patvaļīga. Ir nepieciešams tikai, lai analizējamā parauga virsmas laukums būtu pietiekams un to varētu iespīlēt statīvā. Lai analizētu mazus paraugus, piemēram, stieņus vai stieples, var izmantot īpašus adapterus.
Metodes priekšrocības:
Bezkontakta,
Iespēja vienlaicīgi kvantitatīvi noteikt lielu skaitu elementu,
Augsta precizitāte,
Zemas noteikšanas robežas,
Vienkārša parauga sagatavošana,
Lēts.
36.Atomu absorbcijas spektroskopija.
metode pētāmās vielas elementārā sastāva kvantitatīvai noteikšanai, izmantojot atomu absorbcijas spektrus, pamatojoties uz atomu spēju selektīvi absorbēt elektromagnētisko starojumu sadalīšanās procesā. spektra daļas. A.-a.a. veikta uz speciālām ierīces - absorbcija spektrofotometri. Analizētā materiāla paraugu izšķīdina (parasti veidojot sāļus); šķīdumu aerosola veidā ievada degļa liesmā. Liesmas (3000°C) ietekmē sāls molekulas sadalās atomos, kas spēj absorbēt gaismu. Tad caur degļa liesmu tiek izlaists gaismas stars, kura spektrā ir vienam vai otram elementam atbilstošas spektra līnijas. Pētāmās spektrālās līnijas tiek izolētas no kopējā starojuma, izmantojot monohromatoru, un to intensitāti reģistrē ierakstīšanas ierīce. Matemātika. apstrāde tiek veikta pēc formulas: J = J0 * e-kvI,
kur J un J0 ir caurlaidīgās un krītošās gaismas intensitāte; kv – koeficients uzsūkšanās atkarībā no tā biežuma; I - absorbējošā slāņa biezums
jutīgākas nekā atomelektrostacijas
37. Nefelometrija un duļķainība.
S = log (I°/I) intensitātes kritums. Šķīdumā (I°) dala ar intensitāti, atstājot šķīdumu (I) =
k-const duļķainība
b – gaismas stara ceļa garums
N ir daļiņu skaits vienā vienībā. risinājums
Nefelometriskā un turbidimetriskā analīzē izmanto gaismas izkliedes fenomenu, ko izraisa šķīdumā suspendētas cietās daļiņas.
Nefelometrija ir metode koloidālo sistēmu izkliedes un koncentrācijas noteikšanai pēc to izkliedētās gaismas intensitātes. Nefelometrija, mērījumi tiek veikti speciālā aparātā, nefelometrā, kura darbība balstās uz pētāmās vides izkliedētās gaismas intensitātes salīdzināšanu ar citas vides izkliedētās gaismas intensitāti, kas kalpo kā standarts. Gaismas izkliedes teoriju ar koloidālām sistēmām, kurās daļiņu izmēri nepārsniedz krītošās gaismas pusviļņa garumu, 1871. gadā izstrādāja angļu fiziķis Dž. Reilis. Saskaņā ar Reilija likumu gaismas intensitāte I izkliedējas perpendikulārā virzienā. krītošo staru izsaka ar formulu I = QNvlk - kur q ir krītošās gaismas intensitāte, N ir kopējais daļiņu skaits tilpuma vienībā vai daļēja koncentrācija, v ir vienas daļiņas tilpums, \ ir viļņa garums krītošā gaisma, k ir konstante atkarībā no koloidālo daļiņu un tās apkārtējās dispersijas vides refrakcijas rādītājiem, attāluma no gaismas avota, kā arī no pieņemtajām mērvienībām
Duļķainība ir duļķainu vides analīzes metode, kuras pamatā ir to absorbētās gaismas intensitātes mērīšana. Turbidimetriskos mērījumus veic caurlaidīgā gaismā, izmantojot vizuālos duļķainos vai fotoelektriskos kolorimetrus. Mērīšanas metode ir līdzīga kolorimetriskajai, un tā ir balstīta uz Bouguer-Lambert likuma piemērojamību duļķainiem materiāliem, kas suspensiju gadījumā ir spēkā tikai ļoti plāniem slāņiem vai ievērojamā atšķaidījumā. Turbidimetrijā rūpīgi jāievēro izkliedētās fāzes veidošanās apstākļi, līdzīgi kā nefelometrijā. Būtisks duļķainības uzlabojums ir turbidimetriskā maksimālā duļķainuma titrēšanas izmantošana, izmantojot fotoelektriskos kolorimetrus. Turbidimetriju veiksmīgi izmanto sulfātu, fosfātu, hlorīdu, cianīdu, svina, cinka uc analītiskai noteikšanai.
Galvenā nefelometrisko un turbidimetrisko metožu priekšrocība ir to augstā jutība, kas ir īpaši vērtīga attiecībā uz elementiem vai joniem, kuriem nenotiek krāsu reakcijas. Praksē plaši tiek izmantota, piemēram, nefelometriskā hlorīda un sulfāta noteikšana dabas ūdeņos un līdzīgos objektos. Precizitātes ziņā duļķainība un nefelometrija ir zemākas par fotometriskām metodēm, kas galvenokārt ir saistīts ar grūtībām iegūt suspensijas ar vienādiem daļiņu izmēriem, stabilitāti laikā utt. Papildus parastajām salīdzinoši mazajām kļūdām fotometriskā noteikšanā, ar to saistītās kļūdas ar nepietiekamu ķīmisko analītisko metožu reproducējamību tiek pievienotas suspensiju īpašības.
Nefelometriju un duļķainību izmanto, piemēram, lai noteiktu SO4 BaSO4 suspensijas veidā, Cl- AgCl suspensijas veidā, S2- CuS suspensijas veidā no apakšas. nosakāmā satura robežas ir ~ 0,1 μg/ml. Lai standartizētu analīzes apstākļus eksperimentos, ir stingri jākontrolē temperatūra, suspensijas tilpums, reaģentu koncentrācija, maisīšanas ātrums un mērījumu laiks. Nokrišņiem jānotiek ātri, un izgulsnētajām daļiņām jābūt mazām un ar zemu pH līmeni. Lai novērstu lielu daļiņu koagulāciju, šķīdumam, piemēram, bieži pievieno stabilizatoru. želatīns, glicerīns.
38. Hromatogrāfija: izcelsmes vēsture, metodes princips, pieteikums tiesā. Pētījumi.
Hromatogrāfija ir dinamiska sorbcijas metode vielu maisījumu atdalīšanai un analīzei, kā arī vielu fizikāli ķīmisko īpašību izpētei. Tas ir balstīts uz vielu sadalījumu starp divām fāzēm - stacionāro (cietā fāze vai šķidrums, kas saistīts ar inertu nesēju) un mobilo (gāzes vai šķidrā fāze, eluents). Metodes nosaukums saistās ar pirmajiem eksperimentiem hromatogrāfijā, kuru laikā metodes izstrādātājs Mihails Cvets atdalīja spilgtas krāsas augu pigmentus.
Hromatogrāfijas metodi pirmo reizi izmantoja krievu botāniķis Mihails Semenovičs Cvets 1900. gadā. Viņš izmantoja kolonnu, kas piepildīta ar kalcija karbonātu, lai atdalītu augu pigmentus. Pirmo ziņojumu par hromatogrāfijas metodes attīstību Tsvet sniedza 1901. gada 30. decembrī plkst. XI dabas pētnieku un ārstu kongress Sanktpēterburgā. Pirmais iespiestais darbs par hromatogrāfiju tika publicēts 1903. gadā žurnālā Varšavas dabaszinātnieku biedrības darbi. Pirmo reizi termiņš hromatogrāfija parādījās divos Color iespieddarbos 1906. gadā, kas publicēti kādā vācu žurnālā Berichte der Deutschen Botanischen Gesellschaft. 1907. gadā Cvets demonstrē savu metodi Vācijas Botāniķu biedrība.
1910.-1930.gadā metode tika nepelnīti aizmirsta un praktiski neattīstījās.
1931. gadā R. Kūns, A. Vinteršteins un E. Lederers, izmantojot hromatogrāfiju, no neapstrādāta karotīna izdalīja α un β frakcijas kristāliskā formā, tādējādi demonstrējot metodes preparatīvo vērtību.
1941. gadā A. J. P. Martin un R. L. M. Singh izstrādāja jauna veida hromatogrāfiju, kuras pamatā bija atdalīto vielu sadalījuma koeficientu atšķirība starp diviem nesajaucamiem šķidrumiem. Metode saucās " sadalīšanas hromatogrāfija».
1947. gadā T. B. Gapons, E. N. Gapons un F. M. Šemjakins izstrādāja “jonu apmaiņas hromatogrāfijas” metodi.
1952. gadā Dž.Martinam un R.Singam tika piešķirta Nobela prēmija ķīmijā par sadalīšanas hromatogrāfijas metodes izveidi.
No 20. gadsimta vidus līdz mūsdienām hromatogrāfija ir intensīvi attīstījusies un kļuvusi par vienu no visplašāk izmantotajām analītiskajām metodēm.
Klasifikācija: gāze, šķidrums
Hromatogrāfijas pamati process. Lai veiktu hromatogrāfijas vielu atdalīšana vai to fizikāli ķīmiskā noteikšana. raksturlielumi parasti tiek izmantoti īpaši. ierīces - hromatogrāfi. Pamata hromatogrāfa vienības - hromatogrāfijas. kolonna, detektors un parauga injicēšanas ierīce. Kolonna, kurā atrodas sorbents, veic analizētā maisījuma sadalīšanas funkciju tā sastāvdaļās, un detektors veic to daudzumu sadalīšanas funkciju. definīcijas. Detektors, kas atrodas pie kolonnas izejas, automātiski nepārtraukti nosaka atdalīto savienojumu koncentrāciju. kustīgās fāzes plūsmā Pēc analizētā maisījuma ievadīšanas ar kustīgās fāzes plūsmu kolonnā visu vielu zonas atrodas hromatogrāfijas sākumā. kolonnas (1. att.). Kustīgās fāzes plūsmas ietekmē maisījuma sastāvdaļas sāk pārvietoties pa kolonnu ar sadalīšanos. ātrumi, kuru vērtības ir apgriezti proporcionālas hromatogrāfisko komponentu sadalījuma koeficientiem K. Labi sorbētas vielas, kuru sadalījuma konstantes vērtības ir lielas, pārvietojas pa sorbenta slāni pa kolonnu lēnāk nekā slikti sorbētas vielas. Tāpēc komponents A iziet no kolonnas visātrāk, pēc tam komponents B, un pēdējais, kas atstāj kolonnu, ir komponents C (KA<К Б <К В). Сигнал детектора, величина к-рого пропорциональна концентрации определяемого в-ва в потоке элюента, автоматически непрерывно записывается и регистрируется (напр., на диаграммной ленте). Полученная хроматограмма отражает расположение хроматографич. зон на слое сорбента или в потоке подвижной фазы во времени.

Rīsi. 1. Trīs komponentu (A, B un C) maisījuma atdalīšana uz hromatogrāfijas kolonnas K ar detektoru D: a - atdalīto komponentu hromatogrāfisko zonu novietojums kolonnā noteiktos laika intervālos; b — hromatogramma (C — signāls, t — laiks) .
Ar plakanslāņa hromatogrāfiju Atdalot, hromatogrāfijā ievieto papīra loksni vai plāksni ar sorbenta slāni ar uzklātiem pētāmās vielas paraugiem. kameru. Pēc atdalīšanas sastāvdaļas nosaka ar jebkuru piemērotu metodi.
39. Hromatogrāfijas metožu klasifikācija.
Hromatogrāfija ir vielu atdalīšanas un analīzes metode, kuras pamatā ir analizējamās vielas sadalījums. Atšķirība starp 2 fāzēm: mobilo un stacionāro
Atdalāmo vielu maisījuma šķīdumu izlaiž cauri stikla caurulei (Adsorbcijas kolonna), kas piepildīta ar adsorbentu. Rezultātā maisījuma sastāvdaļas tiek saglabātas dažādos adsorbenta kolonnas augstumos atsevišķu zonu (slāņu) veidā. Materiāls ir labāks par adsorbīru. Tie atrodas kolonnas augšpusē un sliktāk adsorbēti kolonnas apakšā. Vielas, kuras nevar adsorbēt, bez apstājas iziet cauri kolonnai un tiek savāktas filtrā.
Klasifikācijas:
1. Atbilstoši fāžu summēšanas stāvoklim.
1) Kustams
A) gāze (inertās gāzes: hēlijs, argons, azons)
B) šķidrums
2. atbilstoši īstenošanas metodei
1) plaknē (plaknē); plānslāņa papīrs
2) kolonnveida
A) iepakots (iepakota kolonna, kas piepildīta ar sorbentu)
B) kapilārs (plāns stikla/kvarca kapilārs, uz kura iekšējās virsmas tiek uzklāta stacionāra fāze)
Jūs varat def. Preces nelielos daudzumos.
Gaistošās vielas tiek atdalītas.
40. Hromatogramma. Hromatogrāfa pīķa pamatparametri.
Hromatogramma ir rezultāts, reģistrējot komponentu koncentrācijas atkarību no kolonnas izejas laikā.
H S
Katru hromatogrammas maksimumu raksturo divi galvenie parametri
1. Uzglabāšanas laiks ( t R) ir laiks no analizētā parauga ievadīšanas brīža līdz hromatogrāfiskās pīķa maksimuma ierakstīšanai. Tas ir atkarīgs no vielas veida un ir kvalitatīvs raksturlielums.
2. Augstums ( h) vai apgabals ( S) virsotne
S = ½ ω × h. (4)
Pīķa augstums un laukums ir atkarīgs no vielas daudzuma un ir kvantitatīvi raksturlielumi.
Aiztures laiks sastāv no divām sastāvdaļām - vielu uzturēšanās laika kustīgajā fāzē ( t m) un uzturēšanās laiks stacionārā fāzē ( t s):
Analizētā maisījuma nezināmo komponentu pīķu identificēšana tiek veikta ar salīdzināšanu (salīdzināšanu). vērtības, kas noteiktas tieši no hromatogrammas ar atbilstošiem tabulu datiem par zināmajiem savienojumiem. Identificējot hromatogrāfijā, ticams ir tikai negatīvs. atbilde; piemēram, maksimums i nav vienums A, ja pīķa i un vienības A aiztures laiki nesakrīt. Pīķa i un vielas A aiztures laiku sakritība ir nepieciešams, bet nepietiekams nosacījums, lai secinātu, ka pīķis i ir viela A.
Praktiskajā darbā viena vai otra parametra izvēli hromatogrammu kvantitatīvai interpretācijai nosaka vairāku faktoru kopējā ietekme: aprēķina ātrums un vieglums, hromatogrāfiskās pīķa forma (plata, šaura) un asimetrijas pakāpe, izmantotās kolonnas efektivitāte, maisījuma komponentu atdalīšanas pilnīgums, nepieciešamo automatizēto ierīču (integratoru, datorsistēmu hromatogrāfisko datu apstrādei) klātbūtne.
Noteikto hromatogrāfiskās pīķa parametru analizētā maisījuma komponentu atdalīšanas cikla beigās operators mēra manuāli hromatogrammā.
Noteikto hromatogrāfiskā pīķa parametru mēra automātiski, izmantojot digitālos voltmetrus, integratorus vai specializētus datorus, vienlaikus ar analizējamā maisījuma komponentu atdalīšanu kolonnā un hromatogrammas ierakstīšanu.
Tā kā hromatogrammu dekodēšanas tehnika ir saistīta ar interesējošā savienojuma un standarta savienojuma hromatogrāfisko pīķu parametru mērīšanu, hromatogrāfijas apstākļiem jānodrošina to pilnīga atdalīšana, cik vien iespējams; visas pārējās sākotnējā parauga sastāvdaļas pieņemtajos analīzes apstākļos var nav atdalīti viens no otra vai pat neparādās hromatogrammā (šī ir iekšējā standarta metodes priekšrocība salīdzinājumā ar iekšējās normalizācijas metodi)
41.Kvalitatīva hromatogrāfiskā analīze.
Ar pietiekamu kolonnas garumu var panākt pilnīgu jebkura maisījuma sastāvdaļu atdalīšanu. Un pēc atdalīto komponentu eluēšanas atsevišķās frakcijās (eluātos) nosaka maisījuma sastāvdaļu skaitu (tas atbilst eluātu skaitam), nosaka to kvalitatīvo sastāvu, nosaka katra no tiem daudzumu, izmantojot atbilstošas kvantitatīvās analīzes metodes. .
Kvalitatīva hromatogrāfiskā analīze, t.i. vielas identificēšanu pēc tās hromatogrammas var veikt, salīdzinot hromatogrāfiskos raksturlielumus, visbiežāk saglabāto tilpumu (t.i., mobilās fāzes tilpumu, kas iziet cauri kolonnai no maisījuma ievadīšanas sākuma līdz šīs sastāvdaļas parādīšanās izplūdes atverē kolonnas), kas noteiktos apstākļos atrodami analizējamo vielu maisījumu sastāvdaļām un standartam.
42.Kvantitatīvā hromatogrāfa analīze.
Kvantitatīvo hromatogrāfisko analīzi parasti veic ar hromatogrāfu. Metodes pamatā ir dažādu hromatogrāfiskās pīķa parametru mērīšana atkarībā no hromatogrāfisko vielu koncentrācijas – augstuma, platuma, laukuma un saglabātā tilpuma vai saglabātā tilpuma un pīķa augstuma reizinājuma.
Kvantitatīvajā gāzu hromatogrāfijā izmanto absolūtās kalibrēšanas un iekšējās normalizācijas jeb normalizācijas metodes. Tiek izmantota arī iekšējā standarta metode. Ar absolūto kalibrēšanu eksperimentāli nosaka pīķa augstuma vai laukuma atkarību no vielas koncentrācijas un konstruē kalibrēšanas grafikus vai aprēķina atbilstošos koeficientus. Pēc tam nosaka tās pašas pīķu īpašības analizētajā maisījumā un no kalibrēšanas grafika nosaka analizējamās vielas koncentrāciju. Šī vienkāršā un precīzā metode ir galvenā piemaisījumu pēdu noteikšanai.
Izmantojot iekšējās normalizācijas metodi, jebkuru pīķu parametru summa, piemēram, visu pīķu augstumu summa vai to laukumu summa, tiek ņemta par 100%. Tad atsevišķa pīķa augstuma attiecība pret augstumu summu vai viena pīķa laukuma attiecība pret laukumu summu, reizinot ar 100, raksturos komponenta masas daļu (%) maisījums. Izmantojot šo pieeju, ir nepieciešams, lai izmērītā parametra vērtības atkarība no koncentrācijas būtu vienāda visām maisījuma sastāvdaļām.
43.Planārā hromatogrāfija. Plānslāņa hromatogrāfijas izmantošana tintes analīzei.
Pirmais celulozes izmantošanas veids plānslāņa hromatogrāfijā bija papīra hromatogrāfija. Pieejamās TLC un augstas caurlaidības TLC plāksnes ļauj atdalīt polāro vielu maisījumus, izmantojot vismaz trīskāršus ūdens maisījumus, nesajaucamu organisko šķīdinātāju un ūdenī šķīstošu šķīdinātāju, kas veicina vienas fāzes veidošanos kā eluentus)