Би било полезно да започнем с определение на понятието алкани. Това са наситени или наситени.Можем също така да кажем, че това са въглероди, в които връзката на С атоми се осъществява чрез прости връзки. Общата формула е: CnH₂n+ 2.
Известно е, че съотношението на броя на атомите Н и С в техните молекули е максимално в сравнение с други класове. Поради факта, че всички валенции са заети от C или H, химичните свойства на алканите не са ясно изразени, така че второто им име е фразата наситени или наситени въглеводороди.
Има и по-старо име, което най-добре отразява тяхната относителна химическа инертност - парафини, което означава "лишени от афинитет".
И така, темата на нашия разговор днес е: "Алкани: хомоложни серии, номенклатура, структура, изомерия." Ще бъдат представени и данни за техните физични свойства.
Алкани: структура, номенклатура
В тях С атомите са в състояние, наречено sp3 хибридизация. В това отношение молекулата на алкана може да бъде демонстрирана като набор от тетраедрични С структури, които са свързани не само една с друга, но и с Н.
Между С и Н атомите има силни, много нискополярни s-връзки. Атомите винаги се въртят около прости връзки, поради което молекулите на алканите приемат различни форми, а дължината на връзката и ъгълът между тях са постоянни стойности. Формите, които се трансформират една в друга поради въртенето на молекулата около σ връзки, обикновено се наричат конформации.

В процеса на отделяне на Н атом от въпросната молекула се образуват 1-валентни видове, наречени въглеводородни радикали. Те се появяват в резултат не само на неорганични съединения. Ако извадите 2 водородни атома от наситена въглеводородна молекула, получавате 2-валентни радикали.
Така номенклатурата на алканите може да бъде:
- радиална (стара версия);
- заместване (международно, системно). Предложено е от IUPAC.
Характеристики на радиалната номенклатура
В първия случай номенклатурата на алканите се характеризира, както следва:
- Разглеждане на въглеводородите като производни на метана, в които 1 или няколко Н атома са заменени с радикали.
- Висока степен на удобство при не много сложни връзки.
Характеристики на заместващата номенклатура
Заместителната номенклатура на алканите има следните характеристики:
- Основата за името е 1 въглеродна верига, докато останалите молекулни фрагменти се считат за заместители.
- Ако има няколко еднакви радикала, номерът се посочва пред името им (строго с думи), а числата на радикалите се разделят със запетаи.
Химия: номенклатура на алкани
За удобство информацията е представена в табличен вид.
Име на веществото | Основата на името (корен) | Молекулярна формула | Име на въглеродния заместител | Формула за въглероден заместител |
Горната номенклатура на алканите включва имена, които са се развили исторически (първите 4 члена от серията наситени въглеводороди).
Имената на неразширени алкани с 5 или повече С атома произлизат от гръцки цифри, които отразяват дадения брой атоми С. Така наставката -an показва, че веществото е от серия от наситени съединения.

При съставянето на имената на разгънатите алкани основната верига е тази, която съдържа максимален брой атоми С. Тя се номерира така, че заместителите да имат най-малък брой. При две или повече вериги с еднаква дължина главна става тази, която съдържа най-голям брой заместители.
Изомерия на алкани
Основният въглеводород на тяхната серия е метан CH₄. При всеки следващ представител на метановата серия се наблюдава разлика от предходния в метиленовата група - CH₂. Този модел може да бъде проследен в цялата серия от алкани.
Германският учен Шиел предложи тази серия да се нарече хомологична. В превод от гръцки означава „подобен, подобен“.
По този начин хомоложната серия е набор от свързани органични съединения, които имат еднаква структура и подобни химични свойства. Хомолозите са членове на дадена серия. Хомоложна разлика е метиленова група, в която 2 съседни хомолози се различават.
Както бе споменато по-рано, съставът на всеки наситен въглеводород може да бъде изразен с общата формула CnH₂n + 2. По този начин следващият член на хомоложната серия след метана е етанът - C₂H₆. За да се преобразува структурата му от метан, е необходимо да се замени 1 Н атом с CH3 (фигурата по-долу).

Структурата на всеки следващ хомолог може да бъде изведена от предишния по същия начин. В резултат на това от етан се образува пропан - C₃H₈.
Какво представляват изомерите?
Това са вещества, които имат идентичен качествен и количествен молекулен състав (идентична молекулна формула), но различна химична структура, както и различни химични свойства.
Обсъдените по-горе въглеводороди се различават по параметър като точка на кипене: -0,5 ° - бутан, -10 ° - изобутан. Този тип изомерия се нарича изомерия на въглеродния скелет и принадлежи към структурния тип.
Броят на структурните изомери нараства бързо с увеличаването на броя на въглеродните атоми. Така C₁₀H₂₂ ще съответства на 75 изомера (без пространствените), а за C₁₅H3₃₂ вече са известни 4347 изомера, за C₂₀H₄₂ - 366 319.
И така, вече стана ясно какви са алканите, хомоложни серии, изомерия, номенклатура. Сега си струва да преминем към правилата за компилиране на имена според IUPAC.

IUPAC номенклатура: правила за образуване на имена
Първо, във въглеводородната структура е необходимо да се намери въглеродната верига, която е най-дълга и съдържа максимален брой заместители. След това трябва да номерирате С атомите на веригата, като започнете от края, до който заместителят е най-близо.
Второ, основата е името на неразклонен наситен въглеводород, който по отношение на броя на С атомите съответства на основната верига.
Трето, преди основата е необходимо да се посочат номерата на локантите, близо до които се намират заместителите. Имената на заместителите се изписват след тях с тире.
Четвърто, в случай на наличие на идентични заместители при различни С атоми, локантите се комбинират и пред името се появява умножаващ префикс: ди - за два еднакви заместителя, три - за три, тетра - четири, пента - за пет , и т.н. Числата трябва да се отделят едно от друго със запетая, а от думите - с тире.
Ако един и същ С атом съдържа два заместителя наведнъж, локантът също се записва два пъти.
Според тези правила се формира международната номенклатура на алканите.

Проекции на Нюман
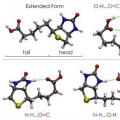
Този американски учен предложи специални проекционни формули за графично представяне на конформациите - проекции на Нюман. Те съответстват на форми A и B и са представени на фигурата по-долу.

В първия случай това е А-затворена конформация, а във втория е В-инхибирана конформация. В позиция А Н атомите са разположени на минимално разстояние един от друг. Тази форма отговаря на най-висока енергийна стойност, поради факта, че отблъскването между тях е най-голямо. Това е енергийно неблагоприятно състояние, в резултат на което молекулата се стреми да го напусне и да се премести в по-стабилна позиция В. Тук Н атомите са възможно най-отдалечени един от друг. Така разликата в енергията между тези позиции е 12 kJ/mol, поради което свободното въртене около оста в молекулата на етана, която свързва метиловите групи, е неравномерно. След като влезе в енергийно благоприятна позиция, молекулата се задържа там, с други думи „забавя“. Ето защо се нарича инхибиран. Резултатът е, че 10 хиляди молекули етан са в инхибирана форма на конформация при стайна температура. Само един е с различна форма - затъмнен.
Получаване на наситени въглеводороди
От статията вече стана известно, че това са алкани (тяхната структура и номенклатура бяха описани подробно по-рано). Би било полезно да се обмислят начини за получаването им. Те се отделят от естествени източници като нефт, природни и въглища. Използват се и синтетични методи. Например H₂ 2H₂:
- Процес на хидрогениране CnH₂n (алкени)→ CnH₂n+2 (алкани) ← CnH₂n-2 (алкини).
- От смес от С и Н монооксид - синтезен газ: nCO+(2n+1)H₂→ CnH₂n+2+nH₂O.
- От карбоксилни киселини (техните соли): електролиза на анода, на катода:
- Електролиза на Колбе: 2RCOONa+2H2O→R-R+2CO2+H2+2NaOH;
- Реакция на Дюма (сплав с алкали): CH3COONa+NaOH (t)→CH4+Na2CO3.
- Крекинг на нефт: CnH₂n+2 (450-700°) → CmH₂m+2+ Cn-mH2(n-m).
- Газификация на гориво (твърдо): C+2H₂→CH4.
- Синтез на сложни алкани (халогенни производни), които имат по-малко С атоми: 2CH₃Cl (хлорометан) +2Na →CH3- CH3 (етан) +2NaCl.
- Разлагане на метаниди (метални карбиди) с вода: Al₄C3+12H₂O→4Al(OH3)↓+3CH₄.
Физични свойства на наситените въглеводороди
За удобство данните са групирани в таблица.
Формула | Алкан | Точка на топене в °C | Точка на кипене в °C | Плътност, g/ml |
0,415 при t = -165°С |
||||
0,561 при t= -100°C |
||||
0,583 при t = -45°C |
||||
0,579 при t =0°C |
||||
2-Метилпропан | 0,557 при t = -25°C |
|||
2,2-диметилпропан | ||||
2-Метилбутан | ||||
2-Метилпентан | ||||
2,2,3,3-тетра-метилбутан | ||||
2,2,4-триметилпентан | ||||
n-C1₀H2₂ | ||||
n-C₁1H24 | n-ундекан | |||
n-C12H26 | n-додекан | |||
n-C13H28 | n-тридекан | |||
n-C1₄H30 | n-тетрадекан | |||
n-C15H32 | n-пентадекан | |||
n-C16H34 | n-хексадекан | |||
n-C₂0H42 | n-ейкозан | |||
n-C3₀H6₆₂ | n-триаконтан | 1 mmHg ул | ||
n-C₄₀H₈₂ | n-тетраконтан | 3 mmHg Изкуство. | ||
n-C₅₀H₁0₀₂ | n-пентаконтан | 15 mmHg Изкуство. | ||
n-C₆₀H₁₂₂ | n-хексаконтан | |||
n-C₇₀H₁₄₂ | n-хептаконтан | |||
n-C₁0₀H20₀₂ |
Заключение
Статията разглежда такова понятие като алкани (структура, номенклатура, изомерия, хомоложни серии и др.). Малко се говори за характеристиките на радиалната и заместващата номенклатура. Описани са методи за получаване на алкани.
Освен това в статията е описана подробно цялата номенклатура на алканите (тестът може да ви помогне да усвоите получената информация).
Таблицата показва някои представители на редица алкани и техните радикали.
|
Формула |
Име |
Радикално име |
|||||||||||
|
СН3 метил |
|||||||||||||
|
C3H7 разрез |
|||||||||||||
|
C4H9 бутил |
|||||||||||||
|
изобутан |
изобутил |
||||||||||||
|
изопентан |
изопентил |
||||||||||||
|
неопентан |
неопентил |
||||||||||||
|
Таблицата показва, че тези въглеводороди се различават един от друг по броя на групите - CH2 -.Такава поредица от подобни структури, които имат подобни химични свойства и се различават една от друга по броя на тези групи, се нарича хомоложна серия. А веществата, които го изграждат, се наричат хомолози. Хомолози - вещества, сходни по структура и свойства, но различаващи се по състав с една или повече хомоложни разлики (- CH2 -)
Въглеродна верига - зигзаг (ако n ≥ 3) σ - облигации (свободно въртене около облигации) дължина (-C-C-) 0.154 nm енергия на свързване (-C-C-) 348 kJ/mol Всички въглеродни атоми в молекулите на алкани са в състояние на sp3 хибридизация
ъгълът между С-С връзките е 109°28", следователно молекулите на нормалните алкани с голям брой въглеродни атоми имат зигзагообразна структура (зигзаг). Дължината на С-С връзката в наситените въглеводороди е 0,154 nm (1 nm = 1 * 10-9 м). а) електронни и структурни формули; б) пространствена структура
4. Изомерия- Характерна е СТРУКТУРНАТА изомерия на веригата с С4 Един от тези изомери ( н-бутан) съдържа неразклонена въглеродна верига, а другият, изобутан, съдържа разклонена (изоструктура). Въглеродните атоми в разклонена верига се различават по вида на връзката с други въглеродни атоми. Така се нарича въглероден атом, свързан само с един друг въглероден атом първичен, с два други въглеродни атома - втори, с три - третичен, с четири - кватернерен. С увеличаване на броя на въглеродните атоми в молекулите се увеличават възможностите за разклоняване на веригата, т.е. броят на изомерите нараства с броя на въглеродните атоми. Сравнителни характеристики на хомолози и изомери
1. Те имат собствена номенклатура радикали(въглеводородни радикали)
| |||||||||||||
От химическа гледна точка алканите са въглеводороди, т.е. общата формула на алканите включва изключително въглеродни и водородни атоми. В допълнение към факта, че тези съединения не съдържат никакви функционални групи, те се образуват само чрез единични връзки. Такива въглеводороди се наричат наситени.
Видове алкани
Всички алкани могат да бъдат разделени на две големи групи:
- Алифатни съединения. Тяхната структура има формата на линейна верига, общата формула на алифатните алкани е C n H 2n+2, където n е броят на въглеродните атоми във веригата.
- Циклоалкани. Тези съединения имат циклична структура, поради което химичните им свойства се различават значително от линейните съединения. По-специално, структурната формула на алканите от този тип прави техните свойства подобни на алкините, тоест въглеводороди с тройна връзка между въглеродните атоми.
Електронна структура на алифатни съединения
Тази група алкани може да има линейна или разклонена въглеводородна верига. Тяхната химическа активност е ниска в сравнение с други органични съединения, тъй като всички връзки в молекулата са наситени.
Молекулната формула на алифатните алкани показва, че тяхната химична връзка има sp 3 хибридизация. Това означава, че и четирите ковалентни връзки около въглеродния атом са абсолютно равни по своите характеристики (геометрични и енергетични). При този тип хибридизация, електронните обвивки на s и p нивата на въглеродните атоми имат същата удължена форма на дъмбел.
Между въглеродните атоми връзката във веригата е ковалентна, а между въглеродните и водородните атоми тя е частично поляризирана, докато електронната плътност е привлечена към въглерода, като към по-електроотрицателния елемент.
От това следва, че в техните молекули има само С-С и С-Н връзки. Първите се образуват от припокриването на две електронно хибридизирани sp 3 орбитали на два въглеродни атома, а вторите се образуват от припокриването на s орбитала на водород и sp 3 орбитала на въглерод. Дължината на C-C връзката е 1,54 ангстрьома, а дължината на C-H връзката е 1,09 ангстрьома.
Геометрия на молекулата на метана
Метанът е най-простият алкан, състоящ се само от един въглероден атом и четири водородни атома.
Поради енергийното равенство на неговите три 2p и една 2s орбитали, получени в резултат на sp 3 хибридизация, всички орбитали в пространството са разположени под еднакъв ъгъл една спрямо друга. Равно е на 109,47°. В резултат на такава молекулярна структура в пространството се образува нещо като триъгълна равностранна пирамида.

Прости алкани
Най-простият алкан е метанът, който се състои от един въглероден атом и четири водородни атома. След метана в поредицата от алкани, пропанът, етанът и бутанът се образуват съответно от три, два и четири въглеродни атома. Започвайки с пет въглеродни атома във веригата, съединенията са именувани според номенклатурата на IUPAC.
По-долу е дадена таблица с формулите на алканите и техните имена:
Когато един водороден атом се загуби от молекула на алкан, се образува активен радикал, чийто край се променя от „ан“ на „ил“, например етан С 2 Н 6 - етил С 2 Н 5. Структурната формула на алкан етан е показана на снимката.

Номенклатура на органичните съединения
Правилата за определяне на имената на алкани и съединения на тяхна основа са установени от международната номенклатура на IUPAC. За органичните съединения се прилагат следните правила:
- Името на химичното съединение се основава на името на неговата най-дълга верига от въглеродни атоми.
- Номерирането на въглеродните атоми трябва да започне от края, по-близо до който веригата започва да се разклонява.
- Ако едно съединение съдържа две или повече въглеродни вериги с еднаква дължина, тогава тази, която има най-малко радикали и има по-проста структура, се избира като основна.
- Ако в една молекула има две или повече еднакви групи радикали, тогава в името на съединението се използват съответните префикси, които удвояват, утрояват и т.н. имената на тези радикали. Например, вместо израза "3-метил-5-метил", се използва "3,5-диметил".
- Всички радикали се изписват по азбучен ред в общото име на съединението, а префиксите не се вземат предвид. Последният радикал се изписва заедно с името на самата верига.
- Числата, отразяващи номерата на радикалите във веригата, се отделят от имената с тире, а самите числа се пишат разделени със запетаи.
Следването на правилата на номенклатурата на IUPAC улеснява определянето на молекулната формула на алкан, например 2,3-диметилбутанът има следната форма.

Физични свойства
Физичните свойства на алканите до голяма степен зависят от дължината на въглеродната верига, образуваща конкретното съединение. Основните свойства са следните:
- Първите четири представителя, според общата формула на алканите, са в газообразно състояние при нормални условия, т.е. бутан, метан, пропан и етан. Що се отнася до пентана и хексана, те вече съществуват под формата на течности и започвайки със седем въглеродни атома, алканите са твърди вещества.
- С увеличаване на дължината на въглеродната верига се увеличава плътността на съединението, както и неговата температура на фазовите преходи от първи ред, т.е. температурите на топене и кипене.
- Тъй като полярността на химичната връзка във формулата на веществото на алканите е незначителна, те не се разтварят в полярни течности, например във вода.
- Съответно, те могат да се използват като добри разтворители за съединения като неполярни мазнини, масла и восъци.
- Домашната газова печка използва смес от алкани, богата на третия член на химическия ред - пропан.
- Когато алканите горят в кислород, голямо количество енергия се освобождава под формата на топлина, така че тези съединения се използват като горимо гориво.
Химични свойства
Поради наличието на стабилни връзки в молекулите на алканите, тяхната реактивност е ниска в сравнение с други органични съединения.
Алканите практически не реагират с йонни и полярни химични съединения. Те се държат инертно в разтвори на киселини и основи. Алканите реагират само с кислород и халогени: в първия случай говорим за процеси на окисление, във втория - за процеси на заместване. Те също проявяват известна химическа активност при реакции с преходни метали.
Във всички тези химични реакции важна роля играе разклонението на въглеродната верига на алканите, тоест наличието на радикални групи в тях. Колкото повече са, толкова повече се променя идеалният ъгъл между връзките от 109,47 ° в пространствената структура на молекулата, което води до създаване на напрежение вътре в нея и в резултат на това повишава химическата активност на такова съединение.
Реакцията на прости алкани с кислород протича по следната схема: C нз 2n+2 + (1,5n+0,5)O 2 → (п+1)Н 2 O+ nCO 2 .
Пример за реакция с хлор е показан на снимката по-долу.

Опасността от алкани за природата и хората

Хептанът, пентанът и хексанът са силно запалими течности и са опасни както за околната среда, така и за човешкото здраве, тъй като са токсични.
Таблицата показва някои представители на редица алкани и техните радикали.
|
Формула |
Име |
Радикално име |
|||||||||||
|
СН3 метил |
|||||||||||||
|
C3H7 разрез |
|||||||||||||
|
C4H9 бутил |
|||||||||||||
|
изобутан |
изобутил |
||||||||||||
|
изопентан |
изопентил |
||||||||||||
|
неопентан |
неопентил |
||||||||||||
|
Таблицата показва, че тези въглеводороди се различават един от друг по броя на групите - CH2 -.Такава поредица от подобни структури, които имат подобни химични свойства и се различават една от друга по броя на тези групи, се нарича хомоложна серия. А веществата, които го изграждат, се наричат хомолози. Хомолози - вещества, сходни по структура и свойства, но различаващи се по състав с една или повече хомоложни разлики (- CH2 -)
Въглеродна верига - зигзаг (ако n ≥ 3) σ - облигации (свободно въртене около облигации) дължина (-C-C-) 0.154 nm енергия на свързване (-C-C-) 348 kJ/mol Всички въглеродни атоми в молекулите на алкани са в състояние на sp3 хибридизация
ъгълът между С-С връзките е 109°28", следователно молекулите на нормалните алкани с голям брой въглеродни атоми имат зигзагообразна структура (зигзаг). Дължината на С-С връзката в наситените въглеводороди е 0,154 nm (1 nm = 1 * 10-9 м). а) електронни и структурни формули; б) пространствена структура
4. Изомерия- Характерна е СТРУКТУРНАТА изомерия на веригата с С4 Един от тези изомери ( н-бутан) съдържа неразклонена въглеродна верига, а другият, изобутан, съдържа разклонена (изоструктура). Въглеродните атоми в разклонена верига се различават по вида на връзката с други въглеродни атоми. Така се нарича въглероден атом, свързан само с един друг въглероден атом първичен, с два други въглеродни атома - втори, с три - третичен, с четири - кватернерен. С увеличаване на броя на въглеродните атоми в молекулите се увеличават възможностите за разклоняване на веригата, т.е. броят на изомерите нараства с броя на въглеродните атоми. Сравнителни характеристики на хомолози и изомери
1. Те имат собствена номенклатура радикали(въглеводородни радикали)
| |||||||||||||
ОПРЕДЕЛЕНИЕ
Алкани– наситени (алифатни) въглеводороди, чийто състав се изразява с формулата C n H 2 n +2.
Алканите образуват хомоложна серия, всяко химично съединение от което се различава по състав от следващите и предишните с еднакъв брой въглеродни и водородни атоми - CH 2, а веществата, включени в хомоложната серия, се наричат хомолози. Хомоложната серия от алкани е представена в таблица 1.
Таблица 1. Хомоложна серия от алкани.
В молекулите на алкани се разграничават първични (т.е. свързани с една връзка), вторични (т.е. свързани с две връзки), третични (т.е. свързани с три връзки) и кватернерни (т.е. свързани с четири връзки) въглеродни атоми.
C 1 H3 – C 2 H 2 – C 1 H 3 (1 – първичен, 2 – вторичен въглероден атом)
CH 3 –C 3 H(CH 3) – CH 3 (3-третичен въглероден атом)
CH 3 – C 4 (CH 3) 3 – CH 3 (4-кватернерен въглероден атом)
Алканите се характеризират със структурна изомерия (изомерия на въглеродния скелет). Така пентанът има следните изомери:
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 (пентан)
CH 3 –CH(CH 3)-CH 2 -CH 3 (2-метилбутан)
CH 3 -C(CH 3) 2 -CH 3 (2,2 – диметилпропан)
Алканите, започвайки с хептан, се характеризират с оптичен изомеризъм.
Въглеродните атоми в наситените въглеводороди са в sp3 хибридизация. Ъглите между връзките в молекулите на алканите са 109,5.
Химични свойства на алканите
При нормални условия алканите са химически инертни - не реагират нито с киселини, нито с основи. Това се обяснява с високата якост на C-C и C-H връзките. Неполярните C-C и C-H връзки могат да се разцепят само хомолитично под въздействието на активни свободни радикали. Следователно алканите влизат в реакции, които протичат по механизма на радикално заместване. При радикални реакции водородните атоми първо се заместват при третични въглеродни атоми, след това при вторични и първични въглеродни атоми.
Реакциите на радикално заместване имат верижен характер. Основните етапи: нуклеация (иницииране) на веригата (1) - възниква под въздействието на UV радиация и води до образуването на свободни радикали, растеж на веригата (2) - възниква поради абстракцията на водороден атом от молекулата на алкана ; прекъсване на веригата (3) – възниква при сблъсък на два еднакви или различни радикала.
X:X → 2X . (1)
R:H+X . → HX + R . (2)
Р . + X: X → R: X + X . (2)
Р . + Р . → R:R (3)
Р . +X . → R:X (3)
х . +X . → X:X (3)
Халогениране.Когато алканите реагират с хлор и бром под действието на UV радиация или висока температура, се образува смес от продукти от моно- до полихалоген-заместени алкани:
CH 3 Cl + Cl 2 = CH 2 Cl 2 + HCl (дихлорометан)
CH 2 Cl 2 + Cl 2 = CHCl 3 + HCl (трихлорометан)
CHCl 3 +Cl 2 = CCl 4 + HCl (въглероден тетрахлорид)
Нитриране (реакция на Коновалов). Когато разредената азотна киселина действа върху алкани при 140°C и ниско налягане, възниква радикална реакция:
CH 3 -CH 3 +HNO 3 = CH 3 -CH 2 -NO 2 (нитроетан) + H 2 O
Сулфохлориране и сулфоксидиране.Директното сулфониране на алкани е трудно и най-често е придружено от окисляване, което води до образуването на алкансулфонил хлориди:
R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl
Реакцията на сулфоново окисление протича по подобен начин, само в този случай се образуват алкансулфонови киселини:
R-H + SO 2 + ½ O 2 → R-SO 3 H
Напукване– радикално разцепване на С-С връзки. Възниква при нагряване и в присъствието на катализатори. При крекиране на висши алкани се образуват алкени; при крекиране на метан и етан се образува ацетилен:
C 8 H 18 = C 4 H 10 (бутан) + C 3 H 8 (пропан)
2CH4 = C2H2 (ацетилен) + 3H2
Окисляване. Лекото окисление на метан с атмосферен кислород може да доведе до получаване на метанол, мравчен алдехид или мравчена киселина. Във въздуха алканите изгарят до въглероден диоксид и вода:
C n H 2 n +2 + (3n+1)/2 O 2 = nCO 2 + (n+1)H 2 O
Физични свойства на алканите
При нормални условия C 1 -C 4 са газове, C 5 -C 17 са течности и започвайки от C 18 са твърди вещества. Алканите са практически неразтворими във вода, но са силно разтворими в неполярни разтворители, като бензен. По този начин метанът CH 4 (блато, минен газ) е газ без цвят и мирис, силно разтворим в етанол, етер, въглеводороди, но слабо разтворим във вода. Метанът се използва като висококалорично гориво в природния газ, като суровина за производството на водород, ацетилен, хлороформ и други органични вещества в индустриален мащаб.
Пропан C 3 H 8 и бутан C 4 H 10 са газове, използвани в ежедневието като бутилирани газове поради лесното им втечняване. Пропанът се използва като автомобилно гориво, защото е по-екологичен от бензина. Бутанът е суровина за производството на 1,3-бутадиен, който се използва в производството на синтетичен каучук.
Получаване на алкани
Алканите се получават от природни източници - природен газ (80-90% - метан, 2-3% - етан и други наситени въглеводороди), въглища, торф, дърва, нефт и скален восък.
Има лабораторни и промишлени методи за получаване на алкани. В промишлеността алканите се получават от битуминозни въглища (1) или чрез реакцията на Фишер-Тропш (2):
nC + (n+1)H 2 = C n H 2 n +2 (1)
nCO + (2n+1)H 2 = C n H 2 n +2 + H 2 O (2)
Лабораторните методи за получаване на алкани включват: хидрогениране на ненаситени въглеводороди чрез нагряване и в присъствието на катализатори (Ni, Pt, Pd) (1), взаимодействие на вода с органометални съединения (2), електролиза на карбоксилни киселини (3), чрез реакции на декарбоксилиране (4) и Wurtz (5) и по други начини.
R 1 -C≡C-R 2 (алкин) → R 1 -CH = CH-R 2 (алкен) → R 1 -CH 2 – CH 2 -R 2 (алкан) (1)
R-Cl + Mg → R-Mg-Cl + H 2 O → R-H (алкан) + Mg(OH)Cl (2)
CH 3 COONa↔ CH 3 COO — + Na +
2CH 3 COO - → 2CO 2 + C 2 H 6 (етан) (3)
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3 (4)
R 1 -Cl +2Na +Cl-R 2 →2NaCl + R 1 -R 2 (5)
Примери за решаване на проблеми
ПРИМЕР 1
| Упражнение | Определете масата на хлора, необходима за първия етап на хлориране на 11,2 литра метан. |
| Решение | Нека напишем уравнението на реакцията за първия етап на хлорирането на метан (т.е. в реакцията на халогениране се замества само един водороден атом, което води до образуването на монохлорно производно): CH 4 + Cl 2 = CH 3 Cl + HCl (метан хлорид) Нека намерим количеството вещество метан: v(CH4) = V(CH4)/Vm v(CH4) = 11,2/22,4 = 0,5 mol Съгласно уравнението на реакцията броят молове хлор и броят молове метан са равни на 1 mol, следователно практическият брой молове хлор и метан също ще бъдат еднакви и ще бъдат равни на: v(Cl2) = v(CH4) = 0.5 mol Познавайки количеството хлорно вещество, можете да намерите неговата маса (което е зададено в проблемния въпрос). Масата на хлора се изчислява като произведение на количеството хлорно вещество и неговата моларна маса (молекулна маса на 1 мол хлор; молекулната маса се изчислява с помощта на таблицата на химичните елементи на D.I. Менделеев). Масата на хлора ще бъде равна на: m(Cl 2) = v(Cl 2)×M(Cl 2) m(Cl 2) = 0,5 × 71 = 35,5 g |
| Отговор | Масата на хлора е 35,5 g |