Θα ήταν χρήσιμο να ξεκινήσουμε με έναν ορισμό της έννοιας των αλκανίων. Αυτά είναι κορεσμένα ή κορεσμένα Μπορούμε επίσης να πούμε ότι πρόκειται για άνθρακες στους οποίους η σύνδεση ατόμων C πραγματοποιείται μέσω απλών δεσμών. Ο γενικός τύπος είναι: CnH2n+ 2.
Είναι γνωστό ότι η αναλογία του αριθμού των ατόμων Η και C στα μόριά τους είναι μέγιστη σε σύγκριση με άλλες κατηγορίες. Λόγω του γεγονότος ότι όλα τα σθένη καταλαμβάνονται είτε από C είτε από H, οι χημικές ιδιότητες των αλκανίων δεν εκφράζονται με σαφήνεια, επομένως το δεύτερο όνομά τους είναι η φράση κορεσμένοι ή κορεσμένοι υδρογονάνθρακες.
Υπάρχει επίσης ένα παλαιότερο όνομα που αντικατοπτρίζει καλύτερα τη σχετική χημική τους αδράνεια - παραφίνες, που σημαίνει «χωρίς συγγένεια».
Λοιπόν, το θέμα της συζήτησης μας σήμερα είναι: «Αλκάνια: ομολογική σειρά, ονοματολογία, δομή, ισομέρεια». Θα παρουσιαστούν επίσης δεδομένα σχετικά με τις φυσικές τους ιδιότητες.
Αλκάνια: δομή, ονοματολογία
Σε αυτά, τα άτομα C βρίσκονται σε μια κατάσταση που ονομάζεται υβριδισμός sp3. Από αυτή την άποψη, το μόριο αλκανίου μπορεί να αποδειχθεί ως ένα σύνολο τετραεδρικών δομών C που συνδέονται όχι μόνο μεταξύ τους, αλλά και με το H.
Μεταξύ των ατόμων C και H υπάρχουν ισχυροί, πολύ χαμηλοί πολικοί δεσμοί s. Τα άτομα περιστρέφονται πάντα γύρω από απλούς δεσμούς, γι' αυτό τα μόρια των αλκανίων παίρνουν διάφορα σχήματα και το μήκος του δεσμού και η γωνία μεταξύ τους είναι σταθερές τιμές. Τα σχήματα που μετασχηματίζονται μεταξύ τους λόγω της περιστροφής του μορίου γύρω από τους δεσμούς σ ονομάζονται συνήθως διαμορφώσεις.

Κατά τη διαδικασία αφαίρεσης ενός ατόμου Η από το εν λόγω μόριο, σχηματίζονται 1-σθενή είδη που ονομάζονται ρίζες υδρογονάνθρακα. Εμφανίζονται ως αποτέλεσμα όχι μόνο αλλά και ανόργανων ενώσεων. Εάν αφαιρέσετε 2 άτομα υδρογόνου από ένα κορεσμένο μόριο υδρογονάνθρακα, θα λάβετε 2-σθενείς ρίζες.
Έτσι, η ονοματολογία των αλκανίων μπορεί να είναι:
- radial (παλιά έκδοση).
- υποκατάσταση (διεθνής, συστηματική). Προτάθηκε από την IUPAC.
Χαρακτηριστικά της ακτινικής ονοματολογίας
Στην πρώτη περίπτωση, η ονοματολογία των αλκανίων χαρακτηρίζεται ως εξής:
- Θεώρηση των υδρογονανθράκων ως παραγώγων του μεθανίου, στα οποία 1 ή περισσότερα άτομα Η αντικαθίστανται από ρίζες.
- Υψηλός βαθμός ευκολίας στην περίπτωση όχι πολύ περίπλοκων συνδέσεων.
Χαρακτηριστικά της ονοματολογίας υποκατάστασης
Η υποκατάστατη ονοματολογία των αλκανίων έχει τα ακόλουθα χαρακτηριστικά:
- Η βάση για το όνομα είναι 1 αλυσίδα άνθρακα, ενώ τα υπόλοιπα μοριακά θραύσματα θεωρούνται ως υποκαταστάτες.
- Εάν υπάρχουν πολλές πανομοιότυπες ρίζες, ο αριθμός υποδεικνύεται πριν από το όνομά τους (αυστηρά με λέξεις) και οι ριζικοί αριθμοί διαχωρίζονται με κόμματα.
Χημεία: ονοματολογία αλκανίων
Για ευκολία, οι πληροφορίες παρουσιάζονται σε μορφή πίνακα.
Όνομα ουσίας | Η βάση του ονόματος (ρίζα) | Μοριακός τύπος | Ονομασία υποκαταστάτη άνθρακα | Τύπος υποκατάστατου άνθρακα |
Η παραπάνω ονοματολογία των αλκανίων περιλαμβάνει ονόματα που έχουν αναπτυχθεί ιστορικά (τα 4 πρώτα μέλη της σειράς κορεσμένων υδρογονανθράκων).
Τα ονόματα των μη διογκωμένων αλκανίων με 5 ή περισσότερα άτομα C προέρχονται από ελληνικούς αριθμούς που αντικατοπτρίζουν τον δεδομένο αριθμό ατόμων C. Έτσι, το επίθημα -an υποδηλώνει ότι η ουσία προέρχεται από μια σειρά κορεσμένων ενώσεων.

Κατά τη σύνθεση των ονομάτων των ξεδιπλωμένων αλκανίων, η κύρια αλυσίδα είναι αυτή που περιέχει τον μέγιστο αριθμό ατόμων C. Είναι αριθμημένη έτσι ώστε οι υποκαταστάτες να έχουν τον μικρότερο αριθμό. Στην περίπτωση δύο ή περισσότερων αλυσίδων του ίδιου μήκους, η κύρια γίνεται αυτή που περιέχει τον μεγαλύτερο αριθμό υποκαταστατών.
Ισομέρεια αλκανίων
Ο μητρικός υδρογονάνθρακας της σειράς τους είναι το μεθάνιο CH4. Με κάθε επόμενο αντιπρόσωπο της σειράς μεθανίου, παρατηρείται διαφορά από την προηγούμενη στην ομάδα μεθυλενίου - CH2. Αυτό το μοτίβο μπορεί να εντοπιστεί σε ολόκληρη τη σειρά των αλκανίων.
Ο Γερμανός επιστήμονας Schiel υπέβαλε μια πρόταση να ονομαστεί αυτή η σειρά ομολογική. Μετάφραση από τα ελληνικά σημαίνει «παρόμοιο, παρόμοιο».
Έτσι, μια ομόλογη σειρά είναι ένα σύνολο σχετικών οργανικών ενώσεων που έχουν την ίδια δομή και παρόμοιες χημικές ιδιότητες. Οι ομόλογοι είναι μέλη μιας δεδομένης σειράς. Η ομόλογη διαφορά είναι μια ομάδα μεθυλενίου στην οποία διαφέρουν 2 γειτονικά ομόλογα.
Όπως αναφέρθηκε προηγουμένως, η σύνθεση οποιουδήποτε κορεσμένου υδρογονάνθρακα μπορεί να εκφραστεί χρησιμοποιώντας τον γενικό τύπο CnH2n + 2. Έτσι, το επόμενο μέλος της ομόλογης σειράς μετά το μεθάνιο είναι αιθάνιο - C2H6. Για τη μετατροπή της δομής του από μεθάνιο, είναι απαραίτητο να αντικατασταθεί 1 άτομο Η με CH3 (σχήμα παρακάτω).

Η δομή κάθε επόμενου ομόλογου μπορεί να συναχθεί από το προηγούμενο με τον ίδιο τρόπο. Ως αποτέλεσμα, το προπάνιο σχηματίζεται από αιθάνιο - C3H8.
Τι είναι τα ισομερή;
Πρόκειται για ουσίες που έχουν ταυτόσημη ποιοτική και ποσοτική μοριακή σύσταση (πανομοιότυπος μοριακός τύπος), αλλά διαφορετική χημική δομή και έχουν επίσης διαφορετικές χημικές ιδιότητες.
Οι υδρογονάνθρακες που συζητήθηκαν παραπάνω διαφέρουν σε μια τέτοια παράμετρο όπως το σημείο βρασμού: -0,5° - βουτάνιο, -10° - ισοβουτάνιο. Αυτός ο τύπος ισομέρειας ονομάζεται ισομέρεια ανθρακικού σκελετού· ανήκει στον δομικό τύπο.
Ο αριθμός των δομικών ισομερών αυξάνεται γρήγορα καθώς αυξάνεται ο αριθμός των ατόμων άνθρακα. Έτσι, το C10H22 θα αντιστοιχεί σε 75 ισομερή (χωρίς τα χωρικά), και για το C15H32 είναι ήδη γνωστά 4347 ισομερή, για το C20H42 - 366.319.
Άρα, έχει ήδη γίνει σαφές τι είναι τα αλκάνια, ομόλογες σειρές, ισομέρεια, ονοματολογία. Τώρα αξίζει να προχωρήσουμε στους κανόνες για τη συλλογή ονομάτων σύμφωνα με την IUPAC.

Ονοματολογία IUPAC: κανόνες για το σχηματισμό ονομάτων
Πρώτον, είναι απαραίτητο να βρεθεί στη δομή των υδρογονανθράκων η ανθρακική αλυσίδα που είναι η μεγαλύτερη και περιέχει τον μέγιστο αριθμό υποκαταστατών. Στη συνέχεια, πρέπει να αριθμήσετε τα άτομα C της αλυσίδας, ξεκινώντας από το άκρο στο οποίο είναι πιο κοντά ο υποκαταστάτης.
Δεύτερον, η βάση είναι το όνομα ενός μη διακλαδισμένου κορεσμένου υδρογονάνθρακα, ο οποίος, ως προς τον αριθμό των ατόμων C, αντιστοιχεί στην κύρια αλυσίδα.
Τρίτον, πριν από τη βάση είναι απαραίτητο να υποδεικνύονται οι αριθμοί των τοποθεσιών κοντά στους οποίους βρίσκονται οι υποκαταστάτες. Τα ονόματα των υποκαταστατών γράφονται μετά από αυτά με παύλα.
Τέταρτον, στην περίπτωση της παρουσίας πανομοιότυπων υποκαταστατών σε διαφορετικά άτομα C, οι τοποθεσίες συνδυάζονται και εμφανίζεται ένα πολλαπλασιαστικό πρόθεμα πριν από το όνομα: di - για δύο ίδιους υποκαταστάτες, τρία - για τρεις, τετρα - τέσσερα, πεντα - για πέντε , κ.λπ. Οι αριθμοί πρέπει να διαχωρίζονται μεταξύ τους με κόμμα και από τις λέξεις με παύλα.
Εάν το ίδιο άτομο C περιέχει δύο υποκαταστάτες ταυτόχρονα, ο εντοπιστής γράφεται επίσης δύο φορές.
Σύμφωνα με αυτούς τους κανόνες, σχηματίζεται η διεθνής ονοματολογία των αλκανίων.

Προβολές Newman
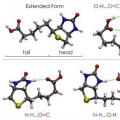
Αυτός ο Αμερικανός επιστήμονας πρότεινε ειδικούς τύπους προβολής για γραφική επίδειξη διαμορφώσεων - προβολές Newman. Αντιστοιχούν στις μορφές Α και Β και παρουσιάζονται στο παρακάτω σχήμα.

Στην πρώτη περίπτωση, αυτή είναι μια διαμόρφωση Α-αποκλεισμένη και στη δεύτερη, είναι μια διαμόρφωση με αναστολή Β. Στη θέση Α, τα άτομα Η βρίσκονται σε ελάχιστη απόσταση μεταξύ τους. Αυτή η μορφή αντιστοιχεί στην υψηλότερη ενεργειακή αξία, λόγω του ότι η απώθηση μεταξύ τους είναι μεγαλύτερη. Πρόκειται για μια ενεργειακά δυσμενή κατάσταση, με αποτέλεσμα το μόριο να τείνει να το εγκαταλείψει και να μετακινηθεί σε μια πιο σταθερή θέση Β. Εδώ τα άτομα Η βρίσκονται όσο το δυνατόν πιο μακριά το ένα από το άλλο. Έτσι, η διαφορά ενέργειας μεταξύ αυτών των θέσεων είναι 12 kJ/mol, λόγω της οποίας η ελεύθερη περιστροφή γύρω από τον άξονα στο μόριο αιθανίου, που συνδέει τις μεθυλομάδες, είναι άνιση. Αφού εισέλθει σε μια ενεργειακά ευνοϊκή θέση, το μόριο παραμένει εκεί, με άλλα λόγια, «επιβραδύνει». Γι' αυτό λέγεται ανασταλμένο. Το αποτέλεσμα είναι ότι 10 χιλιάδες μόρια αιθανίου βρίσκονται σε ανασταλμένη μορφή διαμόρφωσης σε θερμοκρασία δωματίου. Μόνο ένα έχει διαφορετικό σχήμα - σκοτεινό.
Λήψη κορεσμένων υδρογονανθράκων
Από το άρθρο έχει ήδη γίνει γνωστό ότι πρόκειται για αλκάνια (η δομή και η ονοματολογία τους περιγράφηκαν λεπτομερώς νωρίτερα). Θα ήταν χρήσιμο να εξετάσουμε τρόπους απόκτησής τους. Απελευθερώνονται από φυσικές πηγές όπως το πετρέλαιο, το φυσικό και ο άνθρακας. Χρησιμοποιούνται επίσης συνθετικές μέθοδοι. Για παράδειγμα, H2 2H2:
- Διαδικασία υδρογόνωσης CnH2n (αλκένια)→ CnH2n+2 (αλκάνια)← CnH2n-2 (αλκίνια).
- Από μίγμα C και Η μονοξειδίου - αέριο σύνθεσης: nCO+(2n+1)H2→ CnH2n+2+nH2O.
- Από καρβοξυλικά οξέα (τα άλατά τους): ηλεκτρόλυση στην άνοδο, στην κάθοδο:
- Ηλεκτρόλυση Kolbe: 2RCOONa+2H2O→R-R+2CO2+H2+2NaOH;
- Αντίδραση Dumas (κράμα με αλκάλι): CH3COONa+NaOH (t)→CH4+Na2CO3.
- Σπάσιμο λαδιού: CnH2n+2 (450-700°)→ CmH2m+2+ Cn-mH2(n-m).
- Αεριοποίηση καυσίμου (στερεό): C+2H2→CH4.
- Σύνθεση σύμπλοκων αλκανίων (παράγωγα αλογόνου) που έχουν λιγότερα άτομα C: 2CH3Cl (χλωρομεθάνιο) +2Na →CH3- CH3 (αιθάνιο) +2NaCl.
- Αποσύνθεση μεθανιδίων (καρβίδια μετάλλων) με νερό: Al4C3+12H2O→4Al(OH3)↓+3CH4.
Φυσικές ιδιότητες κορεσμένων υδρογονανθράκων
Για ευκολία, τα δεδομένα ομαδοποιούνται σε έναν πίνακα.
Τύπος | Αλκάνιο | Σημείο τήξης σε °C | Σημείο βρασμού σε °C | Πυκνότητα, g/ml |
0,415 σε t = -165°С |
||||
0,561 σε t= -100°C |
||||
0,583 σε t = -45°C |
||||
0,579 σε t =0°C |
||||
2-Μεθυλοπροπάνιο | 0,557 σε t = -25°C |
|||
2,2-Διμεθυλπροπάνιο | ||||
2-Μεθυλοβουτάνιο | ||||
2-Μεθυλοπεντάνιο | ||||
2,2,3,3-Τετρα-μεθυλοβουτάνιο | ||||
2,2,4-Τριμεθυλοπεντάνιο | ||||
n-C10H22 | ||||
n-C11H24 | n-Undecane | |||
n-C12H26 | ν-Δωδεκάνησα | |||
n-C13H28 | n-Tridecan | |||
n-C14H30 | n-τετραδεκάνιο | |||
n-C15H32 | ν-Πενταδεκάνη | |||
n-C16H34 | n-Εξαδεκάνιο | |||
n-C20H42 | η-Εικοζάνη | |||
n-C30H62 | ν-Τριακοντάν | 1 mmHg αγ | ||
n-C40H82 | n-τετρακοντάνη | 3 mmHg Τέχνη. | ||
n-C50H102 | ν-Πεντακόνταν | 15 mmHg Τέχνη. | ||
n-C60H122 | n-Εξακοντάνιο | |||
n-C70H142 | n-επτακοντάνη | |||
n-C100H202 |
συμπέρασμα
Το άρθρο εξέτασε μια τέτοια έννοια όπως τα αλκάνια (δομή, ονοματολογία, ισομέρεια, ομόλογες σειρές κ.λπ.). Λίγα λέγονται για τα χαρακτηριστικά των ακτινικών και υποκατάστατων ονοματολογιών. Περιγράφονται μέθοδοι για τη λήψη αλκανίων.
Επιπλέον, το άρθρο παραθέτει λεπτομερώς ολόκληρη την ονοματολογία των αλκανίων (η δοκιμή μπορεί να σας βοηθήσει να αφομοιώσετε τις πληροφορίες που λάβατε).
Ο πίνακας δείχνει ορισμένους εκπροσώπους ορισμένων αλκανίων και τις ρίζες τους.
|
Τύπος |
Ονομα |
Ριζοσπαστικό όνομα |
|||||||||||
|
CH3 μεθύλιο |
|||||||||||||
|
C3H7 κομμένο |
|||||||||||||
|
C4H9 βουτύλιο |
|||||||||||||
|
ισοβουτάνιο |
ισοβουτύλιο |
||||||||||||
|
ισοπεντάνιο |
ισοπεντυλ |
||||||||||||
|
νεοπεντάνιο |
νεοπεντυλ |
||||||||||||
|
Ο πίνακας δείχνει ότι αυτοί οι υδρογονάνθρακες διαφέρουν μεταξύ τους ως προς τον αριθμό των ομάδων - CH2 - Μια τέτοια σειρά παρόμοιων δομών, που έχουν παρόμοιες χημικές ιδιότητες και διαφέρουν μεταξύ τους στον αριθμό αυτών των ομάδων ονομάζεται ομόλογη σειρά. Και οι ουσίες που το αποτελούν λέγονται ομόλογες. Ομόλογα - ουσίες παρόμοιες ως προς τη δομή και τις ιδιότητες, αλλά που διαφέρουν στη σύσταση κατά μία ή περισσότερες ομόλογες διαφορές (- CH2 -)
Αλυσίδα άνθρακα - ζιγκ-ζαγκ (αν n ≥ 3) σ - δεσμοί (ελεύθερη περιστροφή γύρω από δεσμούς) μήκος (-C-C-) 0,154 nm ενέργεια δέσμευσης (-C-C-) 348 kJ/mol Όλα τα άτομα άνθρακα στα μόρια αλκανίου βρίσκονται σε κατάσταση υβριδισμού sp3
η γωνία μεταξύ των δεσμών C-C είναι 109°28", επομένως τα μόρια των κανονικών αλκανίων με μεγάλο αριθμό ατόμων άνθρακα έχουν τεθλασμένη δομή (ζιγκ-ζαγκ). Το μήκος του δεσμού C-C στους κορεσμένους υδρογονάνθρακες είναι 0,154 nm (1 nm = 1 * 10-9 μ.). α) ηλεκτρονικοί και δομικοί τύποι· β) χωρική δομή
4. Ισομέρεια- Χαρακτηριστική είναι η ΔΟΜΙΚΗ ισομέρεια της αλυσίδας με C4 Ένα από αυτά τα ισομερή ( n-βουτάνιο) περιέχει μια μη διακλαδισμένη ανθρακική αλυσίδα και η άλλη, ισοβουτάνιο, περιέχει μια διακλαδισμένη (ισοδομή). Τα άτομα άνθρακα σε μια διακλαδισμένη αλυσίδα διαφέρουν ως προς τον τύπο σύνδεσης με άλλα άτομα άνθρακα. Έτσι, ένα άτομο άνθρακα που συνδέεται μόνο με ένα άλλο άτομο άνθρακα ονομάζεται πρωταρχικός, με δύο άλλα άτομα άνθρακα - δευτερεύων, με τρεις - τριτογενής, με τέσσερα - τετραδικός. Με την αύξηση του αριθμού των ατόμων άνθρακα στα μόρια, αυξάνονται οι δυνατότητες διακλάδωσης της αλυσίδας, δηλ. ο αριθμός των ισομερών αυξάνεται με τον αριθμό των ατόμων άνθρακα. Συγκριτικά χαρακτηριστικά ομολόγων και ισομερών
1. Έχουν τη δική τους ονοματολογία ριζοσπάστες(ρίζες υδρογονάνθρακα)
| |||||||||||||
Από χημική άποψη, τα αλκάνια είναι υδρογονάνθρακες, δηλαδή ο γενικός τύπος των αλκανίων περιλαμβάνει αποκλειστικά άτομα άνθρακα και υδρογόνου. Εκτός από το γεγονός ότι αυτές οι ενώσεις δεν περιέχουν καμία λειτουργική ομάδα, σχηματίζονται μόνο μέσω απλών δεσμών. Τέτοιοι υδρογονάνθρακες ονομάζονται κορεσμένοι.
Τύποι Αλκανίων
Όλα τα αλκάνια μπορούν να χωριστούν σε δύο μεγάλες ομάδες:
- Αλειφατικές ενώσεις. Η δομή τους έχει τη μορφή γραμμικής αλυσίδας, ο γενικός τύπος των αλειφατικών αλκανίων είναι C n H 2n+2, όπου n είναι ο αριθμός των ατόμων άνθρακα στην αλυσίδα.
- Κυκλοαλκάνια. Αυτές οι ενώσεις έχουν μια κυκλική δομή, η οποία προκαλεί τις χημικές τους ιδιότητες να διαφέρουν σημαντικά από τις γραμμικές ενώσεις. Συγκεκριμένα, ο δομικός τύπος των αλκανίων αυτού του τύπου καθιστά τις ιδιότητές τους παρόμοιες με τα αλκίνια, δηλαδή τους υδρογονάνθρακες με τριπλό δεσμό μεταξύ των ατόμων άνθρακα.
Ηλεκτρονική δομή αλειφατικών ενώσεων
Αυτή η ομάδα αλκανίων μπορεί να έχει είτε γραμμική είτε διακλαδισμένη υδρογονανθρακική αλυσίδα. Η χημική τους δράση είναι χαμηλή σε σύγκριση με άλλες οργανικές ενώσεις, αφού όλοι οι δεσμοί μέσα στο μόριο είναι κορεσμένοι.
Ο μοριακός τύπος των αλειφατικών αλκανίων δείχνει ότι ο χημικός δεσμός τους έχει υβριδισμό sp 3. Αυτό σημαίνει ότι και οι τέσσερις ομοιοπολικοί δεσμοί γύρω από το άτομο άνθρακα είναι απολύτως ίσοι ως προς τα χαρακτηριστικά τους (γεωμετρικοί και ενεργητικοί). Με αυτόν τον τύπο υβριδισμού, τα κελύφη ηλεκτρονίων των επιπέδων s και p των ατόμων άνθρακα έχουν το ίδιο επιμήκη σχήμα αλτήρα.
Μεταξύ των ατόμων άνθρακα ο δεσμός στην αλυσίδα είναι ομοιοπολικός και μεταξύ των ατόμων άνθρακα και υδρογόνου είναι μερικώς πολωμένος, ενώ η πυκνότητα ηλεκτρονίων έλκεται στον άνθρακα, ως προς το πιο ηλεκτραρνητικό στοιχείο.
Από αυτό προκύπτει ότι στα μόριά τους υπάρχουν μόνο δεσμοί C-C και C-H. Τα πρώτα σχηματίζονται από την επικάλυψη δύο τροχιακών sp 3 υβριδοποιημένων ηλεκτρονίων δύο ατόμων άνθρακα, και τα δεύτερα σχηματίζονται από την επικάλυψη του τροχιακού s του υδρογόνου και του sp 3 τροχιακού άνθρακα. Το μήκος του δεσμού C-C είναι 1,54 angstroms και το μήκος του δεσμού C-H είναι 1,09 angstroms.
Γεωμετρία του μορίου του μεθανίου
Το μεθάνιο είναι το απλούστερο αλκάνιο, που αποτελείται από ένα μόνο άτομο άνθρακα και τέσσερα άτομα υδρογόνου.
Λόγω της ενεργειακής ισότητας των τριών τροχιακών του 2p και ενός 2s, που προκύπτει ως αποτέλεσμα του υβριδισμού sp 3, όλα τα τροχιακά στο διάστημα βρίσκονται στην ίδια γωνία μεταξύ τους. Είναι ίσο με 109,47°. Ως αποτέλεσμα μιας τέτοιας μοριακής δομής, σχηματίζεται στο διάστημα κάτι σαν μια τριγωνική ισόπλευρη πυραμίδα.

Απλά αλκάνια
Το απλούστερο αλκάνιο είναι το μεθάνιο, το οποίο αποτελείται από ένα άτομο άνθρακα και τέσσερα άτομα υδρογόνου. Μετά το μεθάνιο στη σειρά των αλκανίων, το προπάνιο, το αιθάνιο και το βουτάνιο σχηματίζονται από τρία, δύο και τέσσερα άτομα άνθρακα, αντίστοιχα. Ξεκινώντας με πέντε άτομα άνθρακα στην αλυσίδα, οι ενώσεις ονομάζονται σύμφωνα με την ονοματολογία IUPAC.
Ένας πίνακας με τους τύπους των αλκανίων και τα ονόματά τους δίνεται παρακάτω:
Όταν χάνεται ένα άτομο υδρογόνου από ένα μόριο αλκανίου, σχηματίζεται μια ενεργή ρίζα, η κατάληξη της οποίας αλλάζει από "an" σε "yl", για παράδειγμα, αιθάνιο C 2 H 6 - αιθύλιο C 2 H 5. Ο δομικός τύπος του αλκανικού αιθανίου φαίνεται στη φωτογραφία.

Ονοματολογία οργανικών ενώσεων
Οι κανόνες για τον προσδιορισμό των ονομάτων των αλκανίων και των ενώσεων που βασίζονται σε αυτά καθορίζονται από τη διεθνή ονοματολογία IUPAC. Για τις οργανικές ενώσεις ισχύουν οι ακόλουθοι κανόνες:
- Το όνομα μιας χημικής ένωσης βασίζεται στο όνομα της μακρύτερης αλυσίδας των ατόμων άνθρακα της.
- Η αρίθμηση των ατόμων άνθρακα πρέπει να ξεκινά από το τέλος, πιο κοντά στο οποίο αρχίζει να διακλαδίζεται η αλυσίδα.
- Εάν μια ένωση περιέχει δύο ή περισσότερες αλυσίδες άνθρακα του ίδιου μήκους, τότε ως κύρια επιλέγεται αυτή που έχει τις λιγότερες ρίζες και έχει απλούστερη δομή.
- Εάν υπάρχουν δύο ή περισσότερες πανομοιότυπες ομάδες ριζών σε ένα μόριο, τότε χρησιμοποιούνται τα αντίστοιχα προθέματα στο όνομα της ένωσης, τα οποία διπλασιάζονται, τριπλασιάζονται και ούτω καθεξής στα ονόματα αυτών των ριζών. Για παράδειγμα, αντί της έκφρασης «3-μεθυλ-5-μεθύλιο», χρησιμοποιείται «3,5-διμεθύλιο».
- Όλες οι ρίζες γράφονται με αλφαβητική σειρά στη γενική ονομασία της ένωσης και τα προθέματα δεν λαμβάνονται υπόψη. Το τελευταίο ριζικό γράφεται μαζί με το όνομα της ίδιας της αλυσίδας.
- Οι αριθμοί που αντικατοπτρίζουν τους αριθμούς των ριζών στην αλυσίδα διαχωρίζονται από τα ονόματα με παύλα και οι ίδιοι οι αριθμοί γράφονται διαχωρισμένοι με κόμματα.
Η τήρηση των κανόνων της ονοματολογίας IUPAC καθιστά εύκολο τον προσδιορισμό του μοριακού τύπου ενός αλκανίου, για παράδειγμα, το 2,3-διμεθυλοβουτάνιο έχει την ακόλουθη μορφή.

Φυσικές ιδιότητες
Οι φυσικές ιδιότητες των αλκανίων εξαρτώνται σε μεγάλο βαθμό από το μήκος της ανθρακικής αλυσίδας που σχηματίζει τη συγκεκριμένη ένωση. Οι κύριες ιδιότητες είναι οι εξής:
- Οι τέσσερις πρώτοι εκπρόσωποι, σύμφωνα με τον γενικό τύπο των αλκανίων, βρίσκονται σε αέρια κατάσταση υπό κανονικές συνθήκες, δηλαδή βουτάνιο, μεθάνιο, προπάνιο και αιθάνιο. Όσο για το πεντάνιο και το εξάνιο, υπάρχουν ήδη με τη μορφή υγρών και ξεκινώντας με επτά άτομα άνθρακα, τα αλκάνια είναι στερεά.
- Καθώς αυξάνεται το μήκος της ανθρακικής αλυσίδας, αυξάνεται η πυκνότητα της ένωσης, καθώς και η θερμοκρασία των μεταπτώσεων φάσης πρώτης τάξης, δηλαδή οι θερμοκρασίες τήξης και βρασμού.
- Δεδομένου ότι η πολικότητα του χημικού δεσμού στον τύπο της ουσίας των αλκανίων είναι ασήμαντη, δεν διαλύονται σε πολικά υγρά, για παράδειγμα, στο νερό.
- Κατά συνέπεια, μπορούν να χρησιμοποιηθούν ως καλοί διαλύτες για ενώσεις όπως μη πολικά λίπη, έλαια και κεριά.
- Μια οικιακή σόμπα αερίου χρησιμοποιεί ένα μείγμα αλκανίων, πλούσιο στο τρίτο μέλος της χημικής σειράς - προπάνιο.
- Όταν τα αλκάνια καίγονται σε οξυγόνο, απελευθερώνεται μεγάλη ποσότητα ενέργειας με τη μορφή θερμότητας, επομένως αυτές οι ενώσεις χρησιμοποιούνται ως εύφλεκτα καύσιμα.
Χημικές ιδιότητες
Λόγω της παρουσίας σταθερών δεσμών στα μόρια των αλκανίων, η αντιδραστικότητα τους είναι χαμηλή σε σύγκριση με άλλες οργανικές ενώσεις.
Τα αλκάνια πρακτικά δεν αντιδρούν με ιοντικές και πολικές χημικές ενώσεις. Συμπεριφέρονται αδρανώς σε διαλύματα οξέων και βάσεων. Τα αλκάνια αντιδρούν μόνο με οξυγόνο και αλογόνα: στην πρώτη περίπτωση μιλάμε για διαδικασίες οξείδωσης, στη δεύτερη - για διαδικασίες υποκατάστασης. Επιδεικνύουν επίσης κάποια χημική δραστηριότητα σε αντιδράσεις με μέταλλα μετάπτωσης.
Σε όλες αυτές τις χημικές αντιδράσεις σημαντικό ρόλο παίζει η διακλάδωση της ανθρακικής αλυσίδας των αλκανίων, δηλαδή η παρουσία ριζικών ομάδων σε αυτές. Όσο περισσότερα υπάρχουν, τόσο περισσότερο αλλάζει η ιδανική γωνία μεταξύ δεσμών 109,47° στη χωρική δομή του μορίου, γεγονός που οδηγεί στη δημιουργία τάσεων στο εσωτερικό του και, ως εκ τούτου, αυξάνει τη χημική δραστηριότητα μιας τέτοιας ένωσης.
Η αντίδραση απλών αλκανίων με οξυγόνο γίνεται σύμφωνα με το ακόλουθο σχήμα: Γ n H 2n+2 + (1,5n+0,5)Ο 2 → (n+1)H 2 O+ nCO 2 .
Ένα παράδειγμα αντίδρασης με χλώριο φαίνεται στην παρακάτω φωτογραφία.

Ο κίνδυνος των αλκανίων για τη φύση και τον άνθρωπο

Το επτάνιο, το πεντάνιο και το εξάνιο είναι πολύ εύφλεκτα υγρά και είναι επικίνδυνα τόσο για το περιβάλλον όσο και για την ανθρώπινη υγεία επειδή είναι τοξικά.
Ο πίνακας δείχνει ορισμένους εκπροσώπους ορισμένων αλκανίων και τις ρίζες τους.
|
Τύπος |
Ονομα |
Ριζοσπαστικό όνομα |
|||||||||||
|
CH3 μεθύλιο |
|||||||||||||
|
C3H7 κομμένο |
|||||||||||||
|
C4H9 βουτύλιο |
|||||||||||||
|
ισοβουτάνιο |
ισοβουτύλιο |
||||||||||||
|
ισοπεντάνιο |
ισοπεντυλ |
||||||||||||
|
νεοπεντάνιο |
νεοπεντυλ |
||||||||||||
|
Ο πίνακας δείχνει ότι αυτοί οι υδρογονάνθρακες διαφέρουν μεταξύ τους ως προς τον αριθμό των ομάδων - CH2 - Μια τέτοια σειρά παρόμοιων δομών, που έχουν παρόμοιες χημικές ιδιότητες και διαφέρουν μεταξύ τους στον αριθμό αυτών των ομάδων ονομάζεται ομόλογη σειρά. Και οι ουσίες που το αποτελούν λέγονται ομόλογες. Ομόλογα - ουσίες παρόμοιες ως προς τη δομή και τις ιδιότητες, αλλά που διαφέρουν στη σύσταση κατά μία ή περισσότερες ομόλογες διαφορές (- CH2 -)
Αλυσίδα άνθρακα - ζιγκ-ζαγκ (αν n ≥ 3) σ - δεσμοί (ελεύθερη περιστροφή γύρω από δεσμούς) μήκος (-C-C-) 0,154 nm ενέργεια δέσμευσης (-C-C-) 348 kJ/mol Όλα τα άτομα άνθρακα στα μόρια αλκανίου βρίσκονται σε κατάσταση υβριδισμού sp3
η γωνία μεταξύ των δεσμών C-C είναι 109°28", επομένως τα μόρια των κανονικών αλκανίων με μεγάλο αριθμό ατόμων άνθρακα έχουν τεθλασμένη δομή (ζιγκ-ζαγκ). Το μήκος του δεσμού C-C στους κορεσμένους υδρογονάνθρακες είναι 0,154 nm (1 nm = 1 * 10-9 μ.). α) ηλεκτρονικοί και δομικοί τύποι· β) χωρική δομή
4. Ισομέρεια- Χαρακτηριστική είναι η ΔΟΜΙΚΗ ισομέρεια της αλυσίδας με C4 Ένα από αυτά τα ισομερή ( n-βουτάνιο) περιέχει μια μη διακλαδισμένη ανθρακική αλυσίδα και η άλλη, ισοβουτάνιο, περιέχει μια διακλαδισμένη (ισοδομή). Τα άτομα άνθρακα σε μια διακλαδισμένη αλυσίδα διαφέρουν ως προς τον τύπο σύνδεσης με άλλα άτομα άνθρακα. Έτσι, ένα άτομο άνθρακα που συνδέεται μόνο με ένα άλλο άτομο άνθρακα ονομάζεται πρωταρχικός, με δύο άλλα άτομα άνθρακα - δευτερεύων, με τρεις - τριτογενής, με τέσσερα - τετραδικός. Με την αύξηση του αριθμού των ατόμων άνθρακα στα μόρια, αυξάνονται οι δυνατότητες διακλάδωσης της αλυσίδας, δηλ. ο αριθμός των ισομερών αυξάνεται με τον αριθμό των ατόμων άνθρακα. Συγκριτικά χαρακτηριστικά ομολόγων και ισομερών
1. Έχουν τη δική τους ονοματολογία ριζοσπάστες(ρίζες υδρογονάνθρακα)
| |||||||||||||
ΟΡΙΣΜΟΣ
Αλκάνια– κορεσμένοι (αλειφατικοί) υδρογονάνθρακες, η σύσταση των οποίων εκφράζεται με τον τύπο C n H 2 n +2.
Τα αλκάνια σχηματίζουν μια ομόλογη σειρά, κάθε χημική ένωση της οποίας διαφέρει στη σύνθεση από την επόμενη και την προηγούμενη κατά τον ίδιο αριθμό ατόμων άνθρακα και υδρογόνου - CH 2, και οι ουσίες που περιλαμβάνονται στην ομόλογη σειρά ονομάζονται ομόλογα. Η ομόλογη σειρά αλκανίων παρουσιάζεται στον Πίνακα 1.
Πίνακας 1. Ομόλογες σειρές αλκανίων.
Στα μόρια αλκανίου διακρίνονται πρωτογενή (δηλαδή συνδεδεμένα με έναν δεσμό), δευτερεύοντα (δηλαδή συνδεδεμένα με δύο δεσμούς), τριτοταγή (δηλαδή συνδεδεμένα με τρεις δεσμούς) και τεταρτοταγή (δηλαδή συνδεδεμένα με τέσσερις δεσμούς) άτομα άνθρακα.
C 1 H3 – C 2 H 2 – C 1 H 3 (1 – πρωτεύοντα, 2 – δευτερεύοντα άτομα άνθρακα)
CH 3 – C 3 H(CH 3) – CH 3 (3-τριτογενές άτομο άνθρακα)
CH 3 – C 4 (CH 3) 3 – CH 3 (4-τεταρτοταγές άτομο άνθρακα)
Τα αλκάνια χαρακτηρίζονται από δομική ισομέρεια (ισομερισμός σκελετού άνθρακα). Έτσι, το πεντάνιο έχει τα ακόλουθα ισομερή:
CH 3 - CH 2 - CH 2 - CH 2 - CH 3 (πεντάνιο)
CH3 –CH(CH3)-CH2-CH3 (2-μεθυλβουτάνιο)
CH 3 -C(CH 3) 2 -CH 3 (2,2 - διμεθυλπροπάνιο)
Τα αλκάνια, ξεκινώντας από το επτάνιο, χαρακτηρίζονται από οπτικό ισομερισμό.
Τα άτομα άνθρακα σε κορεσμένους υδρογονάνθρακες βρίσκονται σε υβριδισμό sp 3. Οι γωνίες μεταξύ των δεσμών στα μόρια των αλκανίων είναι 109,5.
Χημικές ιδιότητες των αλκανίων
Υπό κανονικές συνθήκες, τα αλκάνια είναι χημικά αδρανή - δεν αντιδρούν ούτε με οξέα ούτε με αλκάλια. Αυτό εξηγείται από την υψηλή αντοχή των δεσμών C-C και C-H. Οι μη πολικοί δεσμοί C-C και C-H μπορούν να διασπαστούν ομολυτικά μόνο υπό την επίδραση ενεργών ελεύθερων ριζών. Επομένως, τα αλκάνια εισέρχονται σε αντιδράσεις που προχωρούν με τον μηχανισμό ριζικής υποκατάστασης. Στις ριζικές αντιδράσεις, τα άτομα υδρογόνου αντικαθίστανται πρώτα σε τριτοταγή άτομα άνθρακα, στη συνέχεια σε δευτερεύοντα και πρωτογενή άτομα άνθρακα.
Οι αντιδράσεις ριζικής υποκατάστασης έχουν αλυσιδωτή φύση. Τα κύρια στάδια: πυρήνωση (έναρξη) της αλυσίδας (1) - συμβαίνει υπό την επίδραση της ακτινοβολίας UV και οδηγεί στο σχηματισμό ελεύθερων ριζών, ανάπτυξη αλυσίδας (2) - συμβαίνει λόγω της αφαίρεσης ατόμου υδρογόνου από το μόριο αλκανίου ; τερματισμός αλυσίδας (3) – συμβαίνει όταν δύο ίδιες ή διαφορετικές ρίζες συγκρούονται.
X:X → 2X . (1)
R:H+X . → HX + R . (2)
R . + X:X → R:X + X . (2)
R . + R . → R:R (3)
R . +Χ . → R:X (3)
Χ . +Χ . → X:X (3)
Αλογόνωση.Όταν τα αλκάνια αντιδρούν με το χλώριο και το βρώμιο υπό τη δράση της υπεριώδους ακτινοβολίας ή της υψηλής θερμοκρασίας, σχηματίζεται ένα μείγμα προϊόντων από μονο- έως πολυαλογόνο-υποκατεστημένα αλκάνια:
CH 3 Cl + Cl 2 = CH 2 Cl 2 + HCl (διχλωρομεθάνιο)
CH 2 Cl 2 + Cl 2 = CHCl 3 + HCl (τριχλωρομεθάνιο)
CHCl 3 +Cl 2 = CCl 4 + HCl (τετραχλωριούχος άνθρακας)
Νίτρωση (αντίδραση Konovalov). Όταν το αραιό νιτρικό οξύ δρα στα αλκάνια στους 140 C και σε χαμηλή πίεση, εμφανίζεται μια ριζική αντίδραση:
CH 3 - CH 3 + HNO 3 = CH 3 - CH 2 - NO 2 (νιτροαιθάνιο) + H 2 O
Σουλφοχλωρίωση και σουλφοξείδωση.Η άμεση σουλφόνωση των αλκανίων είναι δύσκολη και τις περισσότερες φορές συνοδεύεται από οξείδωση, με αποτέλεσμα το σχηματισμό αλκανοσουλφονυλοχλωριδίων:
R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl
Η αντίδραση σουλφονικής οξείδωσης προχωρά παρόμοια, μόνο στην περίπτωση αυτή σχηματίζονται αλκανοσουλφονικά οξέα:
R-H + SO 2 + ½ O 2 → R-SO 3 H
Ράγισμα– ριζική διάσπαση δεσμών C-C. Εμφανίζεται όταν θερμαίνεται και παρουσία καταλυτών. Όταν πυρολύονται ανώτερα αλκάνια, σχηματίζονται αλκένια· όταν το μεθάνιο και το αιθάνιο πυρολύονται, σχηματίζεται ακετυλένιο:
C 8 H 18 = C 4 H 10 (βουτάνιο) + C 3 H 8 (προπάνιο)
2CH4 = C2H2 (ακετυλένιο) + 3Η2
Οξείδωση. Η ήπια οξείδωση του μεθανίου με ατμοσφαιρικό οξυγόνο μπορεί να παράγει μεθανόλη, μυρμηκική αλδεΰδη ή μυρμηκικό οξύ. Στον αέρα, τα αλκάνια καίγονται σε διοξείδιο του άνθρακα και νερό:
C n H 2 n +2 + (3n+1)/2 O 2 = nCO 2 + (n+1) H 2 O
Φυσικές ιδιότητες των αλκανίων
Υπό κανονικές συνθήκες, τα C 1 - C 4 είναι αέρια, τα C 5 - C 17 είναι υγρά και ξεκινώντας από το C 18 είναι στερεά. Τα αλκάνια είναι πρακτικά αδιάλυτα στο νερό, αλλά είναι εξαιρετικά διαλυτά σε μη πολικούς διαλύτες, όπως το βενζόλιο. Έτσι, το μεθάνιο CH 4 (βάλτο, αέριο ορυχείου) είναι ένα άχρωμο και άοσμο αέριο, εξαιρετικά διαλυτό σε αιθανόλη, αιθέρα, υδρογονάνθρακες, αλλά ελάχιστα διαλυτό στο νερό. Το μεθάνιο χρησιμοποιείται ως καύσιμο με πολλές θερμίδες στο φυσικό αέριο, ως πρώτη ύλη για την παραγωγή υδρογόνου, ακετυλενίου, χλωροφορμίου και άλλων οργανικών ουσιών σε βιομηχανική κλίμακα.
Το προπάνιο C 3 H 8 και το βουτάνιο C 4 H 10 είναι αέρια που χρησιμοποιούνται στην καθημερινή ζωή ως εμφιαλωμένα αέρια λόγω της εύκολης ρευστοποίησής τους. Το προπάνιο χρησιμοποιείται ως καύσιμο αυτοκινήτου επειδή είναι πιο φιλικό προς το περιβάλλον από τη βενζίνη. Το βουτάνιο είναι η πρώτη ύλη για την παραγωγή του 1,3-βουταδιενίου, το οποίο χρησιμοποιείται στην παραγωγή συνθετικού καουτσούκ.
Παρασκευή αλκανίων
Τα αλκάνια λαμβάνονται από φυσικές πηγές - φυσικό αέριο (80-90% - μεθάνιο, 2-3% - αιθάνιο και άλλοι κορεσμένοι υδρογονάνθρακες), άνθρακας, τύρφη, ξύλο, λάδι και κερί βράχου.
Υπάρχουν εργαστηριακές και βιομηχανικές μέθοδοι για την παραγωγή αλκανίων. Στη βιομηχανία, τα αλκάνια λαμβάνονται από ασφαλτούχο άνθρακα (1) ή από την αντίδραση Fischer-Tropsch (2):
nC + (n+1)H 2 = C n H 2 n +2 (1)
nCO + (2n+1)H 2 = C n H 2 n +2 + H 2 O (2)
Οι εργαστηριακές μέθοδοι για την παραγωγή αλκανίων περιλαμβάνουν: υδρογόνωση ακόρεστων υδρογονανθράκων με θέρμανση και παρουσία καταλυτών (Ni, Pt, Pd) (1), την αλληλεπίδραση νερού με οργανομεταλλικές ενώσεις (2), ηλεκτρόλυση καρβοξυλικών οξέων (3), με αντιδράσεις αποκαρβοξυλίωσης (4) και Wurtz (5) και με άλλους τρόπους.
R 1 -C≡C-R 2 (αλκίνιο) → R 1 -CH = CH-R 2 (αλκένιο) → R 1 -CH 2 – CH 2 -R 2 (αλκάνιο) (1)
R-Cl + Mg → R-Mg-Cl + H 2 O → R-H (αλκάνιο) + Mg(OH)Cl (2)
CH 3 COONa↔ CH 3 COO — + Na +
2CH 3 COO - → 2CO 2 + C 2 H 6 (αιθάνιο) (3)
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3 (4)
R 1 -Cl +2Na +Cl-R 2 →2NaCl + R 1 -R 2 (5)
Παραδείγματα επίλυσης προβλημάτων
ΠΑΡΑΔΕΙΓΜΑ 1
| Ασκηση | Προσδιορίστε τη μάζα χλωρίου που απαιτείται για το πρώτο στάδιο χλωρίωσης 11,2 λίτρων μεθανίου. |
| Λύση | Ας γράψουμε την εξίσωση αντίδρασης για το πρώτο στάδιο της χλωρίωσης μεθανίου (δηλαδή, στην αντίδραση αλογόνωσης, αντικαθίσταται μόνο ένα άτομο υδρογόνου, με αποτέλεσμα το σχηματισμό ενός παραγώγου μονοχλωρίου): CH 4 + Cl 2 = CH 3 Cl + HCl (χλωριούχο μεθάνιο) Ας βρούμε την ποσότητα της ουσίας μεθανίου: v(CH4) = V(CH4)/V m v(CH4) = 11,2/22,4 = 0,5 mol Σύμφωνα με την εξίσωση της αντίδρασης, ο αριθμός των mol χλωρίου και ο αριθμός των γραμμομορίων μεθανίου είναι ίσοι με 1 mol, επομένως, ο πρακτικός αριθμός γραμμομορίων χλωρίου και μεθανίου θα είναι επίσης ο ίδιος και θα είναι ίσος με: v(Cl2) = v(CH4) = 0,5 mol Γνωρίζοντας την ποσότητα της ουσίας χλωρίου, μπορείτε να βρείτε τη μάζα της (που είναι αυτό που τίθεται στην προβληματική ερώτηση). Η μάζα του χλωρίου υπολογίζεται ως το γινόμενο της ποσότητας της ουσίας χλωρίου και της μοριακής της μάζας (μοριακή μάζα 1 mole χλωρίου· η μοριακή μάζα υπολογίζεται χρησιμοποιώντας τον πίνακα χημικών στοιχείων του D.I. Mendeleev). Η μάζα του χλωρίου θα είναι ίση με: m(Cl2) = v(Cl2)×M(Cl2) m(Cl2) = 0,5 × 71 = 35,5 g |
| Απάντηση | Η μάζα του χλωρίου είναι 35,5 g |