Būtu lietderīgi sākt ar alkānu jēdziena definīciju. Tie ir piesātināti vai piesātināti.Var arī teikt, ka tie ir oglekli, kuros C atomu savienojums tiek veikts ar vienkāršām saitēm. Vispārējā formula ir: CnH₂n+ 2.
Ir zināms, ka H un C atomu skaita attiecība to molekulās ir maksimāla, salīdzinot ar citām klasēm. Sakarā ar to, ka visas valences aizņem vai nu C, vai H, alkānu ķīmiskās īpašības nav skaidri izteiktas, tāpēc to otrais nosaukums ir frāze piesātinātie vai piesātinātie ogļūdeņraži.
Ir arī vecāks nosaukums, kas vislabāk atspoguļo to relatīvo ķīmisko inerci - parafīni, kas nozīmē "bez afinitātes".
Tātad, mūsu šodienas sarunas tēma ir: "Alkāni: homoloģiskās sērijas, nomenklatūra, struktūra, izomerisms." Tiks sniegti arī dati par to fizikālajām īpašībām.
Alkāni: struktūra, nomenklatūra
Tajos C atomi atrodas stāvoklī, ko sauc par sp3 hibridizāciju. Šajā sakarā alkāna molekulu var demonstrēt kā tetraedrisku C struktūru kopumu, kas ir savienotas ne tikai viena ar otru, bet arī ar H.
Starp C un H atomiem ir spēcīgas, ļoti zemas polāras s-saites. Atomi vienmēr rotē ap vienkāršām saitēm, tāpēc alkāna molekulas iegūst dažādas formas, un saites garums un leņķis starp tām ir nemainīgas vērtības. Formas, kas pārvēršas viena par otru, pateicoties molekulai rotācijai ap σ saitēm, parasti sauc par konformācijām.

H atoma abstrakcijas procesā no attiecīgās molekulas veidojas 1-valentas sugas, ko sauc par ogļūdeņraža radikāļiem. Tie parādās ne tikai, bet arī neorganisku savienojumu rezultātā. Ja no piesātinātās ogļūdeņraža molekulas atņemat 2 ūdeņraža atomus, jūs iegūstat 2-valentus radikāļus.
Tādējādi alkānu nomenklatūra var būt:
- radiāls (vecā versija);
- aizstāšana (starptautiska, sistemātiska). To ierosināja IUPAC.
Radiālās nomenklatūras iezīmes
Pirmajā gadījumā alkānu nomenklatūru raksturo šādi:
- Ogļūdeņražu uzskatīšana par metāna atvasinājumiem, kuros 1 vai vairāki H atomi ir aizstāti ar radikāļiem.
- Augsta ērtību pakāpe ne pārāk sarežģītu savienojumu gadījumā.
Aizvietošanas nomenklatūras iezīmes
Alkānu aizstājējnomenklatūrai ir šādas pazīmes:
- Nosaukuma pamatā ir 1 oglekļa ķēde, bet atlikušie molekulārie fragmenti tiek uzskatīti par aizvietotājiem.
- Ja ir vairāki identiski radikāļi, pirms to nosaukuma norāda skaitli (stingri ar vārdiem), un radikāļus atdala ar komatiem.
Ķīmija: alkānu nomenklatūra
Ērtības labad informācija tiek sniegta tabulas veidā.
Vielas nosaukums | Nosaukuma pamats (sakne) | Molekulārā formula | Oglekļa aizvietotāja nosaukums | Oglekļa aizvietotāju formula |
Iepriekš minētajā alkānu nomenklatūrā ir iekļauti nosaukumi, kas attīstījušies vēsturiski (pirmie 4 piesātināto ogļūdeņražu sērijas pārstāvji).
Nepaplašinātu alkānu nosaukumi ar 5 vai vairāk C atomiem ir atvasināti no grieķu cipariem, kas atspoguļo doto C atomu skaitu.Tādējādi sufikss -an norāda, ka viela ir no virknes piesātinātu savienojumu.

Sastādot nesalocītu alkānu nosaukumus, galvenā ķēde ir tā, kas satur maksimālo C atomu skaitu.Tā ir numurēta tā, lai aizvietotājiem būtu vismazākais skaits. Ja ir divas vai vairākas vienāda garuma ķēdes, galvenā kļūst par to, kurā ir vislielākais aizvietotāju skaits.
Alkānu izomērija
To sērijas ogļūdeņradis ir metāns CH₄. Ar katru nākamo metāna sērijas pārstāvi atšķirība no iepriekšējās tiek novērota metilēngrupā - CH₂. Šo modeli var izsekot visā alkānu sērijā.
Vācu zinātnieks Šīls izvirzīja priekšlikumu saukt šo sēriju par homoloģisku. Tulkojumā no grieķu valodas tas nozīmē “līdzīgs, līdzīgs”.
Tādējādi homologā sērija ir saistītu organisko savienojumu kopums, kam ir tāda pati struktūra un līdzīgas ķīmiskās īpašības. Homologi ir noteiktas sērijas dalībnieki. Homoloģiskā atšķirība ir metilēngrupa, kurā atšķiras 2 blakus esošie homologi.
Kā minēts iepriekš, jebkura piesātināta ogļūdeņraža sastāvu var izteikt, izmantojot vispārīgo formulu CnH₂n + 2. Tādējādi nākamais homologās sērijas loceklis aiz metāna ir etāns - C2H₆. Lai pārveidotu tā struktūru no metāna, 1 H atoms ir jāaizstāj ar CH₃ (attēls zemāk).

Katra nākamā homologa struktūru var secināt no iepriekšējā tādā pašā veidā. Rezultātā propāns veidojas no etāna - C3H₈.
Kas ir izomēri?
Tās ir vielas, kurām ir identisks kvalitatīvais un kvantitatīvais molekulārais sastāvs (identiska molekulārā formula), bet atšķirīga ķīmiskā struktūra, kā arī dažādas ķīmiskās īpašības.
Iepriekš apskatītie ogļūdeņraži atšķiras ar tādu parametru kā viršanas temperatūra: -0,5° - butāns, -10° - izobutāns. Šo izomērijas veidu sauc par oglekļa skeleta izomerismu; tas pieder strukturālajam tipam.
Strukturālo izomēru skaits strauji palielinās, palielinoties oglekļa atomu skaitam. Tādējādi C10H22 atbildīs 75 izomēriem (neskaitot telpiskos), un C₅H₂2 jau ir zināmi 4347 izomēri, C₂₀H42 - 366 319.
Tātad, jau ir kļuvis skaidrs, kas ir alkāni, homologās sērijas, izomērija, nomenklatūra. Tagad ir vērts pāriet pie noteikumiem par nosaukumu apkopošanu saskaņā ar IUPAC.

IUPAC nomenklatūra: nosaukumu veidošanas noteikumi
Pirmkārt, ogļūdeņraža struktūrā ir jāatrod garākā oglekļa ķēde, kas satur maksimālo aizvietotāju skaitu. Tad jums ir jānumurē ķēdes C atomi, sākot no gala, kuram aizvietotājs ir vistuvāk.
Otrkārt, bāze ir nesazarota piesātināta ogļūdeņraža nosaukums, kas C atomu skaita ziņā atbilst galvenajai ķēdei.
Treškārt, pirms bāzes ir jānorāda to lokantu numuri, pie kuriem atrodas aizvietotāji. Aizstājēju nosaukumus raksta aiz tiem ar defisi.
Ceturtkārt, ja pie dažādiem C atomiem ir identiski aizvietotāji, lokanti tiek apvienoti, un pirms nosaukuma parādās reizināšanas prefikss: di - diviem identiskiem aizvietotājiem, trīs - trim, tetra - četri, penta - pieciem. uc Cipari ir jāatdala viens no otra ar komatu, bet no vārdiem - ar defisi.
Ja viens un tas pats C atoms satur divus aizvietotājus vienlaikus, arī lokantu raksta divreiz.
Saskaņā ar šiem noteikumiem tiek veidota starptautiskā alkānu nomenklatūra.

Ņūmena prognozes
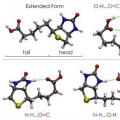
Šis amerikāņu zinātnieks piedāvāja īpašas projekcijas formulas konformāciju grafiskai demonstrēšanai – Ņūmena projekcijas. Tie atbilst A un B veidlapām un ir parādīti attēlā zemāk.

Pirmajā gadījumā tā ir A bloķēta konformācija, bet otrajā tā ir B inhibēta konformācija. Pozīcijā A H atomi atrodas minimālā attālumā viens no otra. Šī forma atbilst augstākajai enerģētiskajai vērtībai, jo atgrūšanās starp tām ir vislielākā. Tas ir enerģētiski nelabvēlīgs stāvoklis, kā rezultātā molekula mēdz to atstāt un pāriet uz stabilāku pozīciju B. Šeit H atomi atrodas pēc iespējas tālāk viens no otra. Tādējādi enerģijas starpība starp šīm pozīcijām ir 12 kJ/mol, kā dēļ brīvā rotācija ap asi etāna molekulā, kas savieno metilgrupas, ir nevienmērīga. Nonākusi enerģētiski labvēlīgā stāvoklī, molekula tur uzkavējas, citiem vārdiem sakot, “palēninās”. Tāpēc to sauc par inhibētu. Rezultāts ir tāds, ka 10 tūkstoši etāna molekulu atrodas inhibētā konformācijas formā istabas temperatūrā. Tikai vienam ir cita forma – aizklāta.
Piesātināto ogļūdeņražu iegūšana
No raksta jau ir kļuvis zināms, ka tie ir alkāni (to struktūra un nomenklatūra tika detalizēti aprakstīta iepriekš). Būtu lietderīgi apsvērt veidus, kā tos iegūt. Tie tiek atbrīvoti no dabīgiem avotiem, piemēram, naftas, dabiskām un oglēm. Tiek izmantotas arī sintētiskās metodes. Piemēram, H₂ 2H₂:
- Hidrogenēšanas process CnH₂n (alkāni) → CnH₂n+2 (alkāni)← CnH₂n-2 (alkīni).
- No C un H monoksīda maisījuma - sintēzes gāze: nCO+(2n+1)H₂→ CnH₂n+2+nH2O.
- No karbonskābēm (to sāļiem): elektrolīze pie anoda, pie katoda:
- Kolbes elektrolīze: 2RCOONa+2H₂O→R-R+2CO₂+H₂+2NaOH;
- Dumas reakcija (sakausējums ar sārmu): CH3COONa+NaOH (t)→CH₄+Na₂CO3.
- Eļļas krekings: CnH₂n+2 (450-700°) → CmH₂m+2+ Cn-mH₂(n-m).
- Degvielas gazifikācija (cieta): C+2H₂→CH4.
- Sarežģītu alkānu (halogēnu atvasinājumu), kuros ir mazāk C atomu, sintēze: 2CH3Cl (hlormetāns) +2Na →CH3- CH3 (etāns) +2NaCl.
- Metanīdu (metālu karbīdu) sadalīšanās ar ūdeni: Al₄C3+12H2O→4Al(OH3)↓+3CH4.
Piesātināto ogļūdeņražu fizikālās īpašības
Ērtības labad dati tiek sagrupēti tabulā.
Formula | Alkāns | Kušanas temperatūra °C | Vārīšanās temperatūra °C | Blīvums, g/ml |
0,415 pie t = -165°С |
||||
0,561 pie t= -100°C |
||||
0,583 pie t = -45°C |
||||
0,579 pie t = 0°C |
||||
2-metilpropāns | 0,557 pie t = -25°C |
|||
2,2-dimetilpropāns | ||||
2-metilbutāns | ||||
2-metilpentāns | ||||
2,2,3,3-tetrametilbutāns | ||||
2,2,4-trimetilpentāns | ||||
n-C10H22 | ||||
n-C11H24 | n-Undekāns | |||
n-C12H₂6 | n-dodekāns | |||
n-C13H₂8 | n-Tridekāns | |||
n-C14H30 | n-tetradekāns | |||
n-C15H3₂ | n-pentadekāns | |||
n-C16H34 | n-heksadekāns | |||
n-C₀H₄2 | n-eikozāns | |||
n-C3₀H₆2 | n-Triakontāns | 1 mmHg st | ||
n-C₄0H82 | n-tetrakontāns | 3 mmHg Art. | ||
n-C5₀H₁₀2 | n-pentakontāns | 15 mmHg Art. | ||
n-C₆₀H₁22 | n-heksakontāns | |||
n-C₇₀H₁42 | n-heptakontāns | |||
n-C₀₀H₂₀2 |
Secinājums
Rakstā tika apskatīts tāds jēdziens kā alkāni (struktūra, nomenklatūra, izomerisms, homologās sērijas utt.). Nedaudz tiek runāts par radiālās un aizstājošās nomenklatūras iezīmēm. Aprakstītas metodes alkānu iegūšanai.
Turklāt rakstā ir sīki uzskaitīta visa alkānu nomenklatūra (tests var palīdzēt jums asimilēt saņemto informāciju).
Tabulā parādīti daži vairāku alkānu un to radikāļu pārstāvji.
|
Formula |
Vārds |
Radikāls nosaukums |
|||||||||||
|
CH3 metils |
|||||||||||||
|
C3H7 griezums |
|||||||||||||
|
C4H9 butils |
|||||||||||||
|
izobutāns |
izobutils |
||||||||||||
|
izopentāns |
izopentils |
||||||||||||
|
neopentāns |
neopentils |
||||||||||||
|
Tabulā redzams, ka šie ogļūdeņraži atšķiras viens no otra ar grupu skaitu - CH2 - Šāda līdzīgu struktūru virkne, kam ir līdzīgas ķīmiskās īpašības un atšķiras viena no otras ar šo grupu skaitu, sauc par homologu sēriju. Un vielas, kas to veido, sauc par homologiem. Homologi - vielas, kas pēc struktūras un īpašībām ir līdzīgas, bet pēc sastāva atšķiras ar vienu vai vairākām homologām atšķirībām (-CH2-)
Oglekļa ķēde — zigzags (ja n ≥ 3) σ - saites (brīva rotācija ap saitēm) garums (-C-C-) 0,154 nm saistīšanas enerģija (-C-C-) 348 kJ/mol Visi alkāna molekulu oglekļa atomi atrodas sp3 hibridizācijas stāvoklī
leņķis starp C-C saitēm ir 109°28", tādēļ normālo alkānu molekulām ar lielu oglekļa atomu skaitu ir zigzaga struktūra (zigzags). C-C saites garums piesātinātajos ogļūdeņražos ir 0,154 nm (1 nm = 1). * 10-9 m). a) elektroniskās un strukturālās formulas; b) telpiskā struktūra
4. Izomērisms- Raksturīga ķēdes ar C4 STRUKTURĀLĀ izomērija Viens no šiem izomēriem ( n-butāns) satur nesazarotu oglekļa ķēdi, bet otrs, izobutāns, satur sazarotu (izostruktūru). Oglekļa atomi sazarotā ķēdē atšķiras pēc savienojuma veida ar citiem oglekļa atomiem. Tādējādi tiek saukts oglekļa atoms, kas saistīts tikai ar vienu citu oglekļa atomu primārs, ar diviem citiem oglekļa atomiem - sekundārais, ar trim - terciārais, ar četriem - kvartārs. Palielinoties oglekļa atomu skaitam molekulās, palielinās iespējas ķēdes sazarošanai, t.i. izomēru skaits palielinās līdz ar oglekļa atomu skaitu. Homologu un izomēru salīdzinošās īpašības
1. Viņiem ir sava nomenklatūra radikāļi(ogļūdeņraža radikāļi)
| |||||||||||||
No ķīmiskā viedokļa alkāni ir ogļūdeņraži, tas ir, alkānu vispārējā formula ietver tikai oglekļa un ūdeņraža atomus. Papildus tam, ka šie savienojumi nesatur funkcionālās grupas, tie veidojas tikai ar atsevišķu saišu palīdzību. Šādus ogļūdeņražus sauc par piesātinātiem.
Alkānu veidi
Visus alkānus var iedalīt divās lielās grupās:
- Alifātiskie savienojumi. To struktūrai ir lineāras ķēdes forma, alifātisko alkānu vispārējā formula ir C n H 2n+2, kur n ir oglekļa atomu skaits ķēdē.
- Cikloalkāni. Šiem savienojumiem ir cikliska struktūra, kā rezultātā to ķīmiskās īpašības būtiski atšķiras no lineārajiem savienojumiem. Jo īpaši šāda veida alkānu strukturālā formula padara to īpašības līdzīgas alkīniem, tas ir, ogļūdeņražiem ar trīskāršu saiti starp oglekļa atomiem.
Alifātisko savienojumu elektroniskā struktūra
Šai alkānu grupai var būt lineāra vai sazarota ogļūdeņraža ķēde. To ķīmiskā aktivitāte ir zema salīdzinājumā ar citiem organiskajiem savienojumiem, jo visas saites molekulā ir piesātinātas.
Alifātisko alkānu molekulārā formula norāda, ka to ķīmiskajai saitei ir sp 3 hibridizācija. Tas nozīmē, ka visas četras kovalentās saites ap oglekļa atomu ir absolūti vienādas pēc to īpašībām (ģeometriskā un enerģētiskā). Ar šāda veida hibridizāciju oglekļa atomu s un p līmeņa elektronu apvalkiem ir tāda pati iegarena hanteles forma.
Starp oglekļa atomiem saite ķēdē ir kovalenta, un starp oglekļa un ūdeņraža atomiem tā ir daļēji polarizēta, savukārt elektronu blīvums ir piesaistīts ogleklim, kā elektronnegatīvākam elementam.
No tā izriet, ka to molekulās ir tikai C-C un C-H saites. Pirmie veidojas, pārklājoties divām elektronu hibridizētām divu oglekļa atomu sp 3 orbitālēm, bet otrās veidojas ūdeņraža s orbitāles un oglekļa sp 3 orbitāles pārklāšanās rezultātā. C-C saites garums ir 1,54 angstremi, un C-H saites garums ir 1,09 angstromi.
Metāna molekulas ģeometrija
Metāns ir vienkāršākais alkāns, kas sastāv tikai no viena oglekļa atoma un četriem ūdeņraža atomiem.
Pateicoties tās trīs 2p un vienas 2s orbitāļu enerģijas vienlīdzībai, kas iegūta sp 3 hibridizācijas rezultātā, visas orbitāles telpā atrodas vienā pret otru leņķī. Tas ir vienāds ar 109,47°. Šādas molekulārās struktūras rezultātā telpā veidojas kaut kas līdzīgs trīsstūrveida vienādmalu piramīdai.

Vienkāršie alkāni
Vienkāršākais alkāns ir metāns, kas sastāv no viena oglekļa atoma un četriem ūdeņraža atomiem. Pēc metāna alkānu sērijā propānu, etānu un butānu veido attiecīgi trīs, divi un četri oglekļa atomi. Sākot ar pieciem oglekļa atomiem ķēdē, savienojumi tiek nosaukti saskaņā ar IUPAC nomenklatūru.
Tālāk ir sniegta tabula ar alkānu formulām un to nosaukumiem:
Kad no alkāna molekulas tiek zaudēts viens ūdeņraža atoms, veidojas aktīvs radikālis, kura gals mainās no “an” uz “il”, piemēram, etāns C 2 H 6 - etil C 2 H 5. Alkāna etāna strukturālā formula ir parādīta fotoattēlā.

Organisko savienojumu nomenklatūra
Alkānu un uz tiem balstītu savienojumu nosaukumu noteikšanas noteikumus nosaka starptautiskā IUPAC nomenklatūra. Uz organiskajiem savienojumiem attiecas šādi noteikumi:
- Ķīmiskā savienojuma nosaukums ir balstīts uz tā garākās oglekļa atomu ķēdes nosaukumu.
- Oglekļa atomu numerācija jāsāk no gala, tuvāk kuram ķēde sāk sazaroties.
- Ja savienojums satur divas vai vairākas vienāda garuma oglekļa ķēdes, tad par galveno izvēlas to, kurā ir vismazāk radikāļu un kura struktūra ir vienkāršāka.
- Ja molekulā ir divas vai vairākas identiskas radikāļu grupas, tad savienojuma nosaukumā tiek lietoti atbilstošie prefiksi, kas šo radikāļu nosaukumos dubulto, trīskāršo utt. Piemēram, izteiciena “3-metil-5-metil” vietā tiek lietots “3,5-dimetils”.
- Visi radikāļi ir rakstīti alfabētiskā secībā savienojuma vispārīgajā nosaukumā, un prefiksi netiek ņemti vērā. Pēdējais radikālis tiek rakstīts kopā ar pašas ķēdes nosaukumu.
- Skaitļi, kas atspoguļo ķēdes radikāļu skaitļus, tiek atdalīti no nosaukumiem ar defisi, un paši skaitļi tiek rakstīti atdalot ar komatiem.
IUPAC nomenklatūras noteikumu ievērošana ļauj viegli noteikt alkāna molekulāro formulu, piemēram, 2,3-dimetilbutānam ir šāda forma.

Fizikālās īpašības
Alkānu fizikālās īpašības lielā mērā ir atkarīgas no oglekļa ķēdes garuma, kas veido konkrēto savienojumu. Galvenās īpašības ir šādas:
- Pirmie četri pārstāvji saskaņā ar alkānu vispārējo formulu normālos apstākļos ir gāzveida stāvoklī, tas ir, butāns, metāns, propāns un etāns. Kas attiecas uz pentānu un heksānu, tie jau pastāv šķidrumu veidā, un, sākot ar septiņiem oglekļa atomiem, alkāni ir cietas vielas.
- Palielinoties oglekļa ķēdes garumam, palielinās savienojuma blīvums, kā arī tā pirmās kārtas fāzes pāreju temperatūra, tas ir, kušanas un viršanas temperatūra.
- Tā kā ķīmiskās saites polaritāte alkānu vielas formulā ir nenozīmīga, tie nešķīst polāros šķidrumos, piemēram, ūdenī.
- Attiecīgi tos var izmantot kā labus šķīdinātājus tādiem savienojumiem kā nepolāri tauki, eļļas un vaski.
- Mājas gāzes plīts izmanto alkānu maisījumu, kas bagāts ar trešo ķīmiskās sērijas locekli - propānu.
- Alkāniem sadedzinot skābeklī, siltuma veidā izdalās liels enerģijas daudzums, tāpēc šos savienojumus izmanto kā degošu kurināmo.
Ķīmiskās īpašības
Tā kā alkānu molekulās ir stabilas saites, to reaktivitāte salīdzinājumā ar citiem organiskajiem savienojumiem ir zema.
Alkāni praktiski nereaģē ar jonu un polāriem ķīmiskiem savienojumiem. Skābju un bāzu šķīdumos tie uzvedas inerti. Alkāni reaģē tikai ar skābekli un halogēniem: pirmajā gadījumā mēs runājam par oksidācijas procesiem, otrajā - par aizvietošanas procesiem. Viņiem ir arī zināma ķīmiska aktivitāte reakcijās ar pārejas metāliem.
Visās šajās ķīmiskajās reakcijās liela nozīme ir alkānu oglekļa ķēdes sazarojumam, tas ir, radikāļu grupu klātbūtnei tajās. Jo vairāk to ir, jo vairāk mainās ideālais leņķis starp saitēm 109,47° molekulas telpiskajā struktūrā, kas izraisa spriegumu veidošanos tās iekšienē un rezultātā palielina šāda savienojuma ķīmisko aktivitāti.
Vienkāršu alkānu reakcija ar skābekli notiek saskaņā ar šādu shēmu: C n H 2n+2 + (1,5n+0,5)O 2 → (n+1)H 2 O+ nCO 2 .
Reakcijas ar hloru piemērs ir parādīts zemāk esošajā fotoattēlā.

Alkānu bīstamība dabai un cilvēkiem

Heptāns, pentāns un heksāns ir viegli uzliesmojoši šķidrumi un ir bīstami gan videi, gan cilvēku veselībai, jo ir toksiski.
Tabulā parādīti daži vairāku alkānu un to radikāļu pārstāvji.
|
Formula |
Vārds |
Radikāls nosaukums |
|||||||||||
|
CH3 metils |
|||||||||||||
|
C3H7 griezums |
|||||||||||||
|
C4H9 butils |
|||||||||||||
|
izobutāns |
izobutils |
||||||||||||
|
izopentāns |
izopentils |
||||||||||||
|
neopentāns |
neopentils |
||||||||||||
|
Tabulā redzams, ka šie ogļūdeņraži atšķiras viens no otra ar grupu skaitu - CH2 - Šāda līdzīgu struktūru virkne, kam ir līdzīgas ķīmiskās īpašības un atšķiras viena no otras ar šo grupu skaitu, sauc par homologu sēriju. Un vielas, kas to veido, sauc par homologiem. Homologi - vielas, kas pēc struktūras un īpašībām ir līdzīgas, bet pēc sastāva atšķiras ar vienu vai vairākām homologām atšķirībām (-CH2-)
Oglekļa ķēde — zigzags (ja n ≥ 3) σ - saites (brīva rotācija ap saitēm) garums (-C-C-) 0,154 nm saistīšanas enerģija (-C-C-) 348 kJ/mol Visi alkāna molekulu oglekļa atomi atrodas sp3 hibridizācijas stāvoklī
leņķis starp C-C saitēm ir 109°28", tādēļ normālo alkānu molekulām ar lielu oglekļa atomu skaitu ir zigzaga struktūra (zigzags). C-C saites garums piesātinātajos ogļūdeņražos ir 0,154 nm (1 nm = 1). * 10-9 m). a) elektroniskās un strukturālās formulas; b) telpiskā struktūra
4. Izomērisms- Raksturīga ķēdes ar C4 STRUKTURĀLĀ izomērija Viens no šiem izomēriem ( n-butāns) satur nesazarotu oglekļa ķēdi, bet otrs, izobutāns, satur sazarotu (izostruktūru). Oglekļa atomi sazarotā ķēdē atšķiras pēc savienojuma veida ar citiem oglekļa atomiem. Tādējādi tiek saukts oglekļa atoms, kas saistīts tikai ar vienu citu oglekļa atomu primārs, ar diviem citiem oglekļa atomiem - sekundārais, ar trim - terciārais, ar četriem - kvartārs. Palielinoties oglekļa atomu skaitam molekulās, palielinās iespējas ķēdes sazarošanai, t.i. izomēru skaits palielinās līdz ar oglekļa atomu skaitu. Homologu un izomēru salīdzinošās īpašības
1. Viņiem ir sava nomenklatūra radikāļi(ogļūdeņraža radikāļi)
| |||||||||||||
DEFINĪCIJA
Alkāni– piesātinātie (alifātiskie) ogļūdeņraži, kuru sastāvu izsaka ar formulu C n H 2 n +2.
Alkāni veido homologu virkni, kuras katrs ķīmiskais savienojums pēc sastāva atšķiras no nākamā un iepriekšējā ar vienādu oglekļa un ūdeņraža atomu skaitu - CH 2, un homologajās sērijās iekļautās vielas sauc par homologiem. Homoloģiskā alkānu sērija ir parādīta 1. tabulā.
1. tabula. Alkānu homologās sērijas.
Alkānu molekulās izšķir primāros (t.i., savienotus ar vienu saiti), sekundāros (t.i., savienotus ar divām saitēm), terciāros (t.i., savienotus ar trim saitēm) un ceturtējos (t.i., savienotus ar četrām saitēm) oglekļa atomus.
C1H3 – C2H2 – C1H3 (1 – primārie, 2 – sekundārie oglekļa atomi)
CH3-C3H(CH3)-CH3 (3-terciārais oglekļa atoms)
CH3 – C4 (CH3) 3 – CH3 (4-ceturkšņa oglekļa atoms)
Alkāniem ir raksturīga strukturāla izomērija (oglekļa skeleta izomērija). Tādējādi pentānam ir šādi izomēri:
CH3-CH2-CH2-CH2-CH3 (pentāns)
CH3-CH(CH3)-CH2-CH3 (2-metilbutāns)
CH3-C(CH3)2-CH3 (2,2-dimetilpropāns)
Alkāniem, sākot ar heptānu, ir raksturīga optiskā izomērija.
Oglekļa atomi piesātinātajos ogļūdeņražos ir sp 3 hibridizācijā. Leņķi starp saitēm alkāna molekulās ir 109,5.
Alkānu ķīmiskās īpašības
Normālos apstākļos alkāni ir ķīmiski inerti – tie nereaģē ne ar skābēm, ne sārmiem. Tas izskaidrojams ar C-C un CH saišu augsto izturību. Nepolāras C-C un C-H saites var tikai homolītiski sadalīties aktīvo brīvo radikāļu ietekmē. Tāpēc alkāni iesaistās reakcijās, kas notiek ar radikālas aizstāšanas mehānismu. Radikālās reakcijās ūdeņraža atomi vispirms tiek aizstāti ar terciārajiem oglekļa atomiem, pēc tam uz sekundārajiem un primārajiem oglekļa atomiem.
Radikālās aizstāšanas reakcijām ir ķēdes raksturs. Galvenie posmi: ķēdes nukleācija (iniciācija) (1) - notiek UV starojuma ietekmē un noved pie brīvo radikāļu veidošanās, ķēdes augšana (2) - notiek ūdeņraža atoma abstrakcijas dēļ no alkāna molekulas ; ķēdes pārtraukšana (3) – notiek divu vienādu vai dažādu radikāļu sadursmē.
X:X → 2X . (1)
R:H+X . → HX + R . (2)
R . + X:X → R:X + X . (2)
R . + R . → R:R (3)
R . +X . → R:X (3)
X . +X . → X:X (3)
Halogenēšana. Alkāniem reaģējot ar hloru un bromu UV starojuma vai augstas temperatūras ietekmē, veidojas produktu maisījums no mono- līdz polihalogēnaizvietotiem alkāniem:
CH 3 Cl + Cl 2 = CH 2 Cl 2 + HCl (dihlormetāns)
CH 2 Cl 2 + Cl 2 = CHCl 3 + HCl (trihlormetāns)
CHCl 3 + Cl 2 = CCl 4 + HCl (tetrahlorīds)
Nitrēšana (Konovalova reakcija). Kad atšķaidīta slāpekļskābe iedarbojas uz alkāniem 140C un zemā spiedienā, notiek radikāla reakcija:
CH3-CH3 +HNO3 = CH3-CH2-NO2 (nitroetāns) + H2O
Sulfohlorēšana un sulfoksidēšana. Tieša alkānu sulfonēšana ir sarežģīta, un to visbiežāk pavada oksidēšanās, kā rezultātā veidojas alkānsulfonilhlorīdi:
R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl
Sulfonskābes oksidācijas reakcija norit līdzīgi, tikai šajā gadījumā veidojas alkānsulfonskābes:
R-H + SO 2 + ½ O 2 → R-SO 3 H
Plakšķēšana– radikāla C-C saišu šķelšanās. Rodas karsējot un katalizatoru klātbūtnē. Kad tiek krekinga augstākie alkāni, veidojas alkēni; krekinga metāns un etāns veidojas acetilēns:
C8H18 = C4H10 (butāns) + C3H8 (propāns)
2CH4 = C2H2 (acetilēns) + 3H2
Oksidācija. Viegla metāna oksidēšana ar atmosfēras skābekli var radīt metanolu, skudrskābes aldehīdu vai skudrskābi. Gaisā alkāni sadeg par oglekļa dioksīdu un ūdeni:
C n H 2 n +2 + (3n+1)/2 O 2 = nCO 2 + (n+1) H 2 O
Alkānu fizikālās īpašības
Normālos apstākļos C1-C4 ir gāzes, C5-C17 ir šķidrumi un sākot no C18 ir cietas vielas. Alkāni praktiski nešķīst ūdenī, bet labi šķīst nepolāros šķīdinātājos, piemēram, benzolā. Tādējādi metāns CH 4 (purvs, raktuvju gāze) ir bezkrāsaina un bez smaržas gāze, labi šķīst etanolā, ēterī, ogļūdeņražos, bet slikti šķīst ūdenī. Metānu izmanto kā augstas kaloritātes degvielu dabasgāzē, kā izejvielu ūdeņraža, acetilēna, hloroforma un citu organisko vielu ražošanai rūpnieciskā mērogā.
Propāns C 3 H 8 un butāns C 4 H 10 ir gāzes, ko ikdienā izmanto kā pudelēs pildītas gāzes, jo tās ir viegli sašķidrināmas. Propānu izmanto kā degvielu automašīnām, jo tas ir videi draudzīgāks nekā benzīns. Butāns ir izejviela 1,3-butadiēna ražošanai, ko izmanto sintētiskā kaučuka ražošanā.
Alkānu sagatavošana
Alkānus iegūst no dabīgiem avotiem - dabasgāzes (80-90% - metāna, 2-3% - etāna un citiem piesātinātiem ogļūdeņražiem), akmeņoglēm, kūdras, koksnes, eļļas un akmeņu vaska.
Ir laboratorijas un rūpnieciskas metodes alkānu ražošanai. Rūpniecībā alkānus iegūst no bitumenoglēm (1) vai ar Fišera-Tropša reakciju (2):
nC+ (n+1)H2 = CnH2n+2 (1)
nCO+ (2n+1)H2 = CnH2n+2 + H2O (2)
Laboratoriskās metodes alkānu iegūšanai ietver: nepiesātināto ogļūdeņražu hidrogenēšanu karsējot un katalizatoru (Ni, Pt, Pd) klātbūtnē (1), ūdens mijiedarbību ar metālorganiskajiem savienojumiem (2), karbonskābju elektrolīzi (3), dekarboksilēšanas reakcijas (4) un Wurtz (5) un citos veidos.
R1-C≡C-R2 (alkīns) → R1-CH = CH-R2 (alkēns) → R1-CH2 – CH2-R2 (alkāns) (1)
R-Cl + Mg → R-Mg-Cl + H2O → R-H (alkāns) + Mg(OH)Cl (2)
CH 3 COONa↔ CH 3 COO — + Na +
2CH 3 COO - → 2CO 2 + C 2 H 6 (etāns) (3)
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3 (4)
R1-Cl +2Na +Cl-R2 →2NaCl + R1-R2 (5)
Problēmu risināšanas piemēri
1. PIEMĒRS
| Vingrinājums | Nosaka hlora masu, kas nepieciešama 11,2 litru metāna hlorēšanai pirmajā posmā. |
| Risinājums | Uzrakstīsim reakcijas vienādojumu metāna hlorēšanas pirmajai stadijai (t.i., halogenēšanas reakcijā tiek aizstāts tikai viens ūdeņraža atoms, kā rezultātā veidojas monohlora atvasinājums): CH 4 + Cl 2 = CH 3 Cl + HCl (metāna hlorīds) Noskaidrosim metāna vielas daudzumu: v(CH4) = V(CH4)/V m v(CH4) = 11,2/22,4 = 0,5 mol Saskaņā ar reakcijas vienādojumu hlora molu skaits un metāna molu skaits ir vienāds ar 1 molu, tāpēc praktiskais hlora un metāna molu skaits būs vienāds un būs vienāds ar: v(Cl2) = v(CH4) = 0,5 mol Zinot hlora vielas daudzumu, jūs varat uzzināt tā masu (tāda ir problēmas problēma). Hlora masu aprēķina kā hlora vielas daudzuma un tā molārās masas reizinājumu (1 mola hlora molekulmasa; molekulmasu aprēķina, izmantojot D. I. Mendeļejeva ķīmisko elementu tabulu). Hlora masa būs vienāda ar: m (Cl 2) = v (Cl 2) × M (Cl 2) m(Cl 2) = 0,5 × 71 = 35,5 g |
| Atbilde | Hlora masa ir 35,5 g |