Metode elektrokimia– yang paling berkembang secara dinamis dalam hal penerapannya dalam pemantauan lingkungan. Metode yang paling umum digunakan dalam sistem MOS adalah voltametri (termasuk polarografi), potensiometri (termasuk ionometri), koulometri, dan konduktometri.
Metode analisis elektrokimia menggunakan ketergantungan berbagai sifat listrik medium pada kandungan kuantitatif dan komposisi kualitatif zat yang dianalisis di dalamnya:
· mengubah potensi elektroda tergantung pada proses fisik dan kimia yang terjadi dalam zat ( potensiometri metode), termasuk. reaksi selektif elektroda selektif ion, yang secara individual sensitif terhadap sejumlah besar kation dan anion ( ionometri metode);
· mengubah konduktivitas listrik (arus) dan konstanta dielektrik suatu zat tergantung pada sifat medium dan konsentrasi komponennya ( konduktometri Dan amperometri metode);
· perubahan jumlah listrik ketika analit masuk ke dalam sel elektrokimia ( koulometri metode);
· perolehan kembali senyawa yang dianalisis pada elektroda yang menetes atau berputar merkuri, sebagai suatu peraturan, ketika menganalisis sejumlah kecil zat dalam keadaan agregasi yang berbeda ( polarografi atau voltametri metode).
Polarograf dari semua perangkat dalam kelompok ini memiliki sensitivitas tertinggi, setara dengan 0,005–1 μg/ml sampel.
Voltametri mencakup sekelompok metode analisis elektrokimia berdasarkan studi kurva polarisasi. Metode-metode ini adalah polarografi Dan titrasi amperometri – memiliki banyak variasi dan modifikasi. Paling umum arus konstan polarografi.
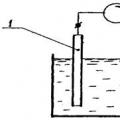
Instalasi polarografi terdiri dari sumber arus searah, pembagi tegangan, elektroda jatuh (biasanya merkuri) atau berputar dan elektroda bantu (biasanya juga merkuri atau lainnya). Untuk mengukur arus, mikroammeter dihubungkan ke sistem. Elektroda ditempatkan bersama dengan larutan uji dalam elektroliser (sel).
Tegangan yang diterapkan pada sel elektrolitik menyebabkan polarisasi anoda dan katoda E= f A- F k +akuR, Di mana Saya– kekuatan saat ini; KE - resistensi solusi; F A dan f k– potensial anoda dan katoda.
Jika hambatan larutan dikurangi dengan menambahkan elektrolit kuat (latar belakang), maka nilainya akuR(potensi penurunan larutan) dapat diabaikan.
Potensial anoda tetap konstan selama pengoperasian sel, karena rapat arus rendah dan permukaan anoda yang relatif besar tidak terpolarisasi. Maka potensial katoda polarisasi yang menetes dengan permukaan kecil akan sama dengan: E= -f k. Seringkali dalam pengukuran polarografi, alih-alih lapisan merkuri di dasar bejana, digunakan elektroda kalomel jenuh non-polarisasi, yang potensialnya dianggap nol.
Data polarografik diperoleh dengan mengukur arus yang melewati sel elektrolitik sebagai fungsi potensial yang diterapkan pada elektroda. Ketergantungan grafis arus pada potensial disebut gelombang polarografik ( beras. 2).
Pada awal elektrolisis, pada nilai EMF yang dikenakan rendah, kekuatan arus akan hampir konstan dan hanya meningkat sangat lambat. Inilah yang disebut arus sisa, yang tetap ada selama elektrolisis.
Beras. 2. Polarogram larutan seng klorida 10–3 M dan larutan kalium klorida 1 M (kurva 1) dan larutan kalium klorida 1 M (kurva 2)
Segera setelah potensial reduksi ion tercapai (misalnya, untuk ion seng tertentu sama dengan -1,0 V), pelepasannya dimulai pada setetes air raksa:
Zn 2+ + 2 +Hg ® Zn (Hg).
Amalgam seng encer Zn (Hg) terbentuk di katoda, yang terurai menjadi unsur-unsurnya segera setelah tetesan yang jatuh bersentuhan dengan anoda:
Zn (Hg) – 2 ® Zn 2+ +Hg.
Ketika potensi reduksi ion seng, kekuatan arus meningkat tajam ( beras. 2), tetapi setelah mencapai nilai tertentu, meskipun EMF yang diterapkan meningkat, nilai tersebut hampir konstan. Arus ini disebut arus pembatas atau difusi, nilainya biasanya sebanding dengan konsentrasi zat yang ditentukan.
Saat mengambil polagram, elektrolit acuh tak acuh dengan kation yang direduksi jauh lebih sulit daripada kation yang dianalisis, misalnya KCl, KNO 3, NH 4 Cl, ditambahkan ke elektrolit yang diteliti; pada konsentrasi 100–1000 kali lebih tinggi dari konsentrasi zat yang ditentukan. Elektrolit ini disebut “latar belakang”. Itu dibuat dalam larutan uji untuk meningkatkan konduktivitas listrik dan untuk melindungi medan listrik elektroda indikator (katoda). Oleh karena itu, kation analit tidak tertarik oleh medan listrik katoda, tetapi bergerak ke arahnya karena difusi.
Karakteristik terpenting dari polarogram adalah potensi setengah gelombang E 1/2 dan tinggi gelombang polarografi H(batasi arus difusi). Potensi setengah gelombang digunakan dalam kualitas analisis polarografi. Potensi setengah gelombang berbagai zat, disusun berdasarkan kenaikan nilai negatif, membentuk apa yang disebut “spektrum polarografi”. Karena potensi setengah gelombang sangat bergantung pada komposisi larutan (media yang dianalisis), latar belakang selalu ditunjukkan dalam tabel polarografi.
DI DALAM kuantitatif Dalam analisis polarografi, metode grafik kalibrasi, aditif, perbandingan dan metode perhitungan digunakan untuk mengukur konsentrasi.
Di antara berbagai pilihan polarografi, metodenya polarografi pulsa diferensial (DIP) ) paling efektif untuk memecahkan masalah pemantauan lingkungan, terutama karena sensitivitasnya yang tinggi. Metode DIP memungkinkan Anda memperkirakan kandungan semua zat yang ditentukan oleh polarografi klasik. Di antara metode polarografi lainnya, metode ini sangat cocok untuk analisis jejak gelombang persegi polarografi, yang memberikan batas deteksi mendekati DIP, tetapi hanya dalam kasus proses elektroda yang dapat dibalik, dan oleh karena itu metode ini sering digunakan untuk penentuan jejak logam berat. Metode DIP juga dapat digunakan untuk menentukan surfaktan yang mengubah kapasitansi lapisan listrik ganda pada elektroda.
Metode dapat digunakan untuk menentukan kandungan mikro ion logam berat analisis elektrokimia inversi (IEA) atau dengan cara lain, analisis voltametri pengupasan (IVA ), di mana logam yang akan ditentukan diendapkan terlebih dahulu pada elektroda dan kemudian dilarutkan selama kontrol polarografi. Opsi ini, jika dikombinasikan dengan DIP, merupakan salah satu metode analisis elektrokimia yang paling sensitif. Desain perangkat keras IEA (IVA) relatif sederhana, sehingga memungkinkan dilakukannya analisis di lapangan, dan stasiun kendali berkelanjutan (pemantauan) otomatis juga dapat bekerja berdasarkan prinsip ini.
Metode IEA (IVA) memberikan penentuan ion Cu, Pb, Bi, Sb, As, Sn In, Ga, Ag, Tl, Cd, Zn, Hg, Au, Ge, Te, Ni, Co dan banyak anion. Keuntungan penting dari metode IEA (IEA) adalah (berbeda dengan metode lain, misalnya spektrometri serapan atom) kemampuan untuk membedakan ion bebas dari bentuk kimia terikatnya, yang juga penting untuk menilai sifat fisikokimia zat yang dianalisis dari sudut pandang pengendalian analitis lingkungan (misalnya, ketika menilai kualitas air). Banyak zat organik juga dapat ditentukan dengan metode IEA (IEA) setelah akumulasi adsorpsinya pada permukaan elektroda.
Metode polarografi juga dapat digunakan untuk menentukan aerosol berbagai logam di atmosfer dan udara tempat industri setelah ditangkap pada filter yang sesuai, diikuti dengan pemindahan konsentrat ke dalam larutan. Senyawa organik yang terdapat dalam bentuk gas dan uap di atmosfer dapat ditentukan secara polarografis setelah diserap oleh larutan yang dipilih secara khusus. Logam dan berbagai senyawa dalam bahan biologis biasanya ditentukan secara polarografis setelah ekstraksi. Semua pengukuran polarografi, termasuk IEA (IVA), dapat diotomatisasi sepenuhnya, yang penting saat melakukan analisis serial.
Salah satu bidang penerapan polarografi yang paling penting adalah penentuan oksigen dalam air. Untuk tujuan ini, detektor amperometri digunakan, menghasilkan arus yang sebanding dengan konsentrasi oksigen dalam larutan.
Dengan menerapkan enzim ke permukaan membran detektor, dimungkinkan untuk memperoleh berbagai sensor amperometri enzim yang sesuai untuk analisis biokimia dan klinis. Sensor tersebut juga digunakan dalam sistem pemantauan lingkungan.
Elektroda yang beroperasi berdasarkan prinsip elektrokatalitik cocok untuk memantau berbagai gas (SO 2, H 2 S, CO, NO x) di udara kawasan industri. Reaksi elektrokimia gas-gas ini (berperan sebagai katalis) yang terjadi pada permukaan elektroda menghasilkan arus dalam sistem elektroda yang secara fungsional berhubungan dengan konsentrasi gas di udara.
Penggunaan polarografi tidak terbatas pada analisis sampel diskrit, dan metode ini secara bertahap beralih ke prinsip analisis gas dan cairan secara terus menerus.
Detektor polarografi voltametri telah berhasil digunakan dalam kromatografi cair kinerja tinggi (HPLC). Dalam hal ini, kombinasi metode pemisahan yang sangat selektif dengan metode deteksi sensitif mengarah pada perluasan nyata dari jangkauan zat yang ditentukan dengan metode kromatografi (jejak zat yang sangat beracun, herbisida, obat-obatan, stimulan pertumbuhan, dll.).
Rincian metode ini dapat diklarifikasi dalam literatur khusus.
Potensiometri– metode untuk menentukan konsentrasi zat, berdasarkan pengukuran ggl sel galvanik reversibel.
Dalam praktiknya, dua metode analisis digunakan: langsung potensiometri untuk menentukan aktivitas partikel, yang dapat dihitung menggunakan persamaan Nernst dari ggl sel galvanik, dan titrasi potensiometri , dimana perubahan aktivitas zat kimia selama proses titrasi menyebabkan perubahan ggl sel galvanik.
Peralatan untuk melakukan titrasi potensiometri dan potensiometri langsung adalah sama. Rangkaian pengukuran potensiometri meliputi elektroda indikator dan elektroda referensi dengan potensial konstan yang stabil, serta perangkat sekunder. Diagram prinsip metode ini ditunjukkan pada beras. 3.

1 – elektroda indikator; 2 - elektroda referensi
Beras. 3. Sel potensiometri
Potensial sepasang elektroda adalah konstan. Mengubah konsentrasi analit dalam larutan akan mengubah EMF rangkaian. Elektroda indikator biasanya tersedia dalam empat buah jenis, tergantung pada membran yang digunakan, yang memisahkan larutan elektroda dari larutan uji: 1) elektroda dengan membran homogen yang terbuat dari bahan bubuk atau kristal; 2) elektroda dengan membran heterogen, di mana zat aktif elektroda didistribusikan, misalnya pada karet silikon; 3) elektroda dengan membran cair, dimana membran tersebut merupakan larutan yang diaplikasikan pada zat netral, misalnya kaca berpori; 4) elektroda kaca dengan komposisi kimia kaca yang berbeda.
Elektroda indikator memperoleh potensial dari larutan dimana elektroda tersebut ditempatkan. Ada dua baik elektroda indikator:
1) elektroda acuh tak acuh (tidak dapat dirusak selama elektrolisis);
2) elektroda yang berubah (teroksidasi atau tereduksi) selama pengukuran.
Peran elektroda acuh tak acuh(kadang-kadang disebut elektroda ketiga jenis) adalah memberi atau memperoleh elektron, yaitu menjadi konduktor listrik. Elektroda tersebut dapat dibuat dari emas, platina yang dipoles, grafit dan bahan lainnya. Contoh elektroda variabel (kadang disebut elektroda) Pertama jenisnya) dapat berupa pelat tembaga, seng dan logam lainnya, serta elektroda indikator quinhydrone dan hidrogen. Selain itu, elektroda indikator juga bisa elektroda membran selektif ion untuk penentuan berbagai kation: Li+, Pb+, Cs+, Tl+, NH+, Na+, K+, Ag+, dll. Sebagai elektroda acuan ( standar elektroda), yang potensialnya tetap konstan selama pengukuran, yang paling umum digunakan adalah, misalnya, elektroda kalomel (kalomel) normal dan desinormal dengan potensial masing-masing +0,282 V dan +0,334 V, serta elektroda perak klorida jenuh dengan potensi +0,201 V.
Dalam kasus ideal, pengukuran potensiometri langsung EMF sel galvanik dapat dihubungkan melalui persamaan Nernst dengan aktivitas partikel yang ditentukan, atau dengan konsentrasi, jika koefisien aktivitas yang sesuai diketahui:
![]()
Di mana E 0 – potensial elektroda standar, V; R– konstanta gas; T– suhu absolut; F - nomor Faraday; N– jumlah elektron yang hilang atau diperoleh; , [dikurangi] – konsentrasi kesetimbangan bentuk teroksidasi dan tereduksi, mol/dm 3 .
Jika kita mengganti nilai referensi konstanta dan berpindah dari logaritma natural ke desimal, maka untuk suhu 25°C kita mendapatkan:

Indikator terpenting dalam mencirikan keadaan suatu lingkungan adalah nilai pH lingkungan tersebut, yang penentuannya ( pH-metri ) saat ini biasanya dilakukan dengan menggunakan elektroda kaca indikator (pengukur). Untuk pengukuran jangka panjang, desain khusus elektroda kaca dengan perangkat tambahan telah dikembangkan untuk memastikan pembersihan membran kaca. Elektroda kaca yang dilapisi membran semipermeabel dengan lapisan elektrolit juga berfungsi sebagai dasar untuk berbagai jenis probe ( sensor ), digunakan dalam analisis air dan udara dalam kondisi produksi untuk sejumlah polutan (NH 3, CO 2, NO x, SO 2, H 2 S, dll.).
Proses di bidang pembuatan elektroda selektif ion (ISE) memungkinkan pemantauan ion F – , I – , Br – , Cl – , CN – , SCN – , NO 3 – , NO 2 – , ClO 4 – , S 2 – , Na+ , K + Ca 2+ , Ag + , Cu 2+ , Cd 2+ , Pb 2+ dengan konsentrasi berkisar antara 10 –2 hingga 10 –7 mol/l (kira-kira 1–10 –5 mg/ml). Pemantauan menggunakan ISE ditandai dengan kecepatan, kesederhanaan, dan kemungkinan lebih besar untuk melakukan pengukuran berkelanjutan. ISE telah dikembangkan yang selektif terhadap kelas zat organik yang luas, serta isomer dalam massanya, surfaktan dan deterjen yang ditemukan di udara area produksi dan sistem pengelolaan air di perusahaan industri.
Potensiometri juga digunakan dalam mengukur potensi redoks berbagai sistem redoks (O/R) dalam air. Sebagai aturan, hasil pengukuran sesuai dengan potensi campuran, karena beberapa sistem O/W biasanya hidup berdampingan secara bersamaan di dalam air.
Perlu dicatat bahwa penggunaan sensor berdasarkan transistor efek medan selektif kimia dan selektif ion semikonduktor oksida logam (HSFT, ISFT) cukup menjanjikan. Selektivitas dalam sistem ini dicapai dengan memilih komposisi membran dan lapisan yang diendapkan pada gerbang transistor. Sistem direndam dalam larutan yang dianalisis, dan perbedaan potensial antara elektroda referensi dan gerbang transistor memodulasi arus yang mengalir antara sumber dan saluran pembuangan. Karena selektivitas membran atau lapisan yang diendapkan, arus termodulasi menjadi fungsi aktivitas komponen larutan yang sesuai. Sensor semikonduktor menjadi dasar monitor dan penganalisis berbagai gas dan uap. Ukuran kecil dari sensor tersebut memungkinkan untuk menggabungkannya dalam bentuk mosaik pada satu substrat, sehingga diperoleh alat analisa yang dapat memantau berbagai macam zat berbahaya. Sinyal dari masing-masing sensor yang termasuk dalam mosaik dapat direkam secara berurutan dan berkala oleh pusat pengukuran sistem analitik.
Perkembangan mikroelektronika memungkinkan perancangan alat analisa tipe probe kompak menggunakan ISE modern. Dalam hal ini, sirkuit yang memproses respons dari objek kontrol lingkungan, dan bahkan sebuah tampilan, dapat dipasang di pegangan probe.
Dalam literatur khusus Anda dapat mengetahui detail metodenya, , , .
Koulometri metode analisis adalah pengukuran arus reaksi elektroda dimana zat yang diteliti memasuki sel koulometri dengan aliran yang dianalisis. Diagram skema sel koulometri ditunjukkan pada beras. 4.

1 – ruang katoda; 2 – ruang anoda; 3 – mikroammeter
Beras. 4. Skema sel koulometri
Analisis koulometri didasarkan pada pengukuran jumlah listrik yang dihabiskan untuk melakukan proses elektrokimia tertentu secara kuantitatif dalam sampel tertentu, yaitu. asalkan efisiensi saat ini adalah 100%. Ini adalah jumlah listrik dengan bantuan integrator arus-waktu yang dihubungkan secara seri dengan sel pengukur, atau elektroliser koulometer, di mana proses elektrokimia dilakukan dengan efisiensi arus seratus persen, disertai dengan pelepasan a suatu zat, yang jumlahnya dapat dipulihkan dengan mudah dan akurat.
Menurut hukum Faraday:
M( X)/M(X) = M(k)/M(k),
Di mana M(X), m(k) – massa zat yang ditentukan X dan zat yang dilepaskan masing-masing dalam kolometer; M(X), M(k) – massa molar zat yang setara X dan zat yang dilepaskan dalam koulometer, g/mol.

Perhitungan juga dapat dilakukan dengan menggunakan persamaan yang menjelaskan hukum Faraday:
![]()
jika kekuatan arus diukur selama analisis Saya, A dan waktu T, s, dihabiskan untuk melakukan proses elektrokimia.
Dalam modifikasi lain dari metode ini, disebut
titrasi koulometri
, titran dihasilkan secara elektrolitik dalam larutan yang dianalisis pada arus tertentu. Konsumsi titran dalam reaksi analitik digantikan oleh muatan yang mengalir melalui larutan ketika titran dihasilkan hingga titik ekivalen tercapai.
Satu dari kelebihan metode koulometri adalah bahwa proses standardisasi titran seringkali tidak diperlukan, karena perhitungan didasarkan pada konstanta Faraday, yaitu metode ini mutlak dan memungkinkan Anda memperkirakan jumlah zat yang ditentukan, dan bukan konsentrasinya. Kerugian koulometri dengan potensial tertentu adalah lamanya prosedur analisis, terkait dengan kebutuhan penyelesaian elektrolisis secara lengkap. Teknologi komputer memungkinkan pengurangan waktu ini dengan memprediksi akhir elektrolisis dengan memproses secara matematis kurva waktu saat ini untuk tahap awal elektrolisis dan dengan menghitung jumlah listrik atau konsentrasi suatu zat dalam larutan. Saat menganalisis sampel multikomponen, ini dapat digunakan pemindaian koulometri , di mana potensial elektrolisis diubah secara terus menerus atau bertahap. Untuk sistem seperti ini, titrasi koulometri lebih disukai daripada koulometri langsung, karena efisiensi arus 100% dalam pembangkitan titran dapat dengan mudah dicapai dengan pemilihan reagen titran dan komposisi media kerja yang tepat. Titrasi koulometri dapat diterapkan untuk penentuan zat dari 0,01 hingga 100 mg (terkadang di bawah 1 g). Volume sampel kerja biasanya 10 hingga 50 ml. Metode ini dicirikan oleh akurasi yang tinggi, kesalahan relatif tidak melebihi beberapa persepuluh persen bahkan dengan titrasi koulometri kandungan mikrogram. Dalam kondisi optimal, titrasi dapat dilakukan dengan kesalahan keseluruhan yang sangat rendah yaitu 0,01% (rel.). Berbagai asam basa, redoks; Pilihan titrasi pengendapan dan kompleksometri dapat dilakukan secara koulometri.
Alat analisa gas koulometri dan alat analisa aqua (“koulometer”) telah dikembangkan dan diproduksi untuk penentuan sulfur dioksida dan hidrogen sulfida (sulfat dan sulfida), ozon (dan hidrogen peroksida), klorin di udara (dan klorin aktif dalam air), karbon monoksida dan nitrogen dioksida di udara (nitrat dan nitrit dalam air). Koulometri juga digunakan sebagai alat deteksi elektrokimia dalam kromatografi cair.
Rincian metode ini dapat ditemukan dalam literatur khusus.
Metode konduktometri analisis didasarkan pada pengukuran konduktivitas listrik larutan. Metode analisis konduktometri terdiri dari pengukuran perubahan resistansi larutan elektrolit ketika suatu komponen campuran diserap. Instalasi konduktometri digunakan misalnya untuk menentukan karbon monoksida dan dioksida, uap bensin, amonia dan lain-lain.
Konduktivitas listrik merupakan kebalikan dari hambatan R, dimensinya adalah cm (Siemens) yaitu. = 1/ R.
Konduktivitas listrik suatu larutan bergantung pada jumlah ion per satuan volume larutan, yaitu pada konsentrasi DENGAN, tentang mobilitas ion-ion ini – V. Berdasarkan hubungan yang diketahui
![]()
Di mana Z– jarak antar elektroda; S - area elektroda; k– koefisien proporsionalitas.
Untuk sepasang elektroda tertentu dengan jarak yang konstan di antara keduanya S/Z= konstanta. Kemudian
![]() ,
,
Di mana k 1 = k(S/Z).
Saat melakukan perhitungan dalam konduktometri, digunakan konsep “konduktivitas listrik” æ 0:
![]()
Dalam perhitungan akan lebih mudah untuk menggunakan konduktivitas listrik yang setara, yaitu sama dengan:
Di mana P - jumlah mol setara dalam 1 cm3 larutan. Konduktivitas listrik ekuivalen l ¥ pada pengenceran tak terhingga sama dengan jumlah mobilitas kation kamu dan anion V.
Rasio konduktivitas listrik setara larutan elektrolit lemah dengan konduktivitas listrik setara elektrolit ini pada pengenceran tak terbatas sama dengan derajat disosiasi a elektrolit ini:
Meskipun tidak spesifik, metode ini cukup sering digunakan dalam sistem pemantauan lingkungan dibandingkan metode elektrokimia lainnya. Hal ini dijelaskan oleh fakta bahwa ketika menilai pencemaran, misalnya air dan atmosfer, pengendalian proses industri tidak dilakukan secara bertahap, tetapi pada keluaran (final). Karena konduktivitas listrik air yang sangat rendah, seringkali cukup untuk memperkirakan kandungan total kontaminan, yang merupakan hasil dari konduktometri. Contoh umum penggunaan metode konduktometri dalam pemantauan lingkungan adalah penganalisis deterjen dalam air limbah, konsentrasi komponen sintetis dalam sistem irigasi, dan kualitas (salinitas) air minum. Alat analisa konduktometri digunakan untuk pemantauan berkelanjutan terhadap polutan udara dan curah hujan seperti SO 2 dan H 2 SO 4 . Sebagai tambahan konduktometri langsung dapat digunakan untuk menentukan jenis polusi tertentu tidak langsung metode yang memberikan perkiraan yang sangat efektif tentang kandungan zat yang tercantum di atas, yang berinteraksi sebelum pengukuran dengan reagen yang dipilih secara khusus dan perubahan konduktivitas listrik yang tercatat hanya disebabkan oleh adanya produk yang sesuai dalam reaksi. Dengan cara ini Anda dapat menentukan nitrogen oksida setelah reduksi katalitik pra-amonia, serta HCl, HBr dan CO 2 setelah reaksi awal dengan Ba(OH) 2 atau NaOH. Prinsip yang dijelaskan untuk menentukan CO 2 juga dapat digunakan untuk penentuan tidak langsung zat organik dalam air.
Selain konduktometri klasik, ada juga versi frekuensi tinggi ( osilometri ), dimana sistem elektroda indikator tidak bersentuhan dengan sampel. Prinsip ini sering diterapkan dalam penganalisis konduktivitas kontinu.
Metode analisis elektrokimia juga dijelaskan dalam sejumlah publikasi pendidikan dan khusus.
LITERATUR
1. Drugov Yu.S., Rodin A.A.Kimia analitik lingkungan.
Sankt Peterburg: 2002. – 464 hal.
2. Pashkevich M.A., Shuisky V.F. Pemantauan lingkungan. tutorial. Universitas Negeri St. – Sankt Peterburg, 2002. – 90 hal.
3. Cattrall Robert W. Sensor kimia. M.: Dunia Ilmiah, 2000. – 144 hal.
4. Turyan Ya.I., Ruvinsky O.E., Zaitsev P.M.Katalymetri polarografi. M.: Kimia, 1998. – 272 hal.
5. Budnikov G.K., Maistrenko V.N., Murinov Yu.I. Voltametri dengan modifikasi dan ultramikroelektroda. M.: Nauka, 1994. – 239 detik.
6. Brainina Kh.Z., Neiman E.Ya., Slepushkin V.V. Metode elektroanalisis inversi. M.: 1988. – 240 hal.
7. Salikhdzhanova R.F. dan sebagainya. Polarograf dan penggunaannya dalam analisis dan penelitian praktis. M.: Kimia, 1988. – 192 hal.
8. Kaplan B.Ya., Pats R.G., Salikhdzhanova R.F. voltametri AC. M.: Kimia, 1985. – 264.
9. Obligasi A.M. Metode polarografi dalam kimia analitik. M.: Kimia, 1983.
10. Efremenko O.A. Analisis potensiometri. M.: MMA saya. MEREKA. Sechenova, 1998.
11. Panduan Referensi Penerapan Elektroda Selektif Ion. M.: Mir, 1986.
12. Korita I. Ion, elektroda, membran. M.: Mir, 1983.
13. Nikolsky B.V., Materova E.A. Elektroda selektif ion. L.: Kimia, 1980.
14. Efremenko O.A.Titrasi koulometri. M.: MMA saya. MEREKA. Sechenova, 1990.
15. Khudyakova T.A., Koreshkov A.P. Metode analisis konduktometri. Buku teks untuk universitas. M.: Sekolah Tinggi, 1975. – 207 hal.
16. Budnikov G.K., Maistrenko V.N., Vyaselev M.R. Dasar-dasar analisis kelistrikan modern. M.: Kimia, 2000.
17. Prokhorova G.V. Pengantar metode analisis elektrokimia. M.: Rumah Penerbitan Universitas Negeri Moskow, 1991. – 97 hal.
18. Metode elektroanalitik dalam pemantauan lingkungan. /Ed. R. Kalvoda, R. Zyka, K. Shtulik dan lain-lain M.: Kimia, 1990. – 240 hal.
19. Plambeck J.Metode analisis elektrokimia. Dasar-dasar teori dan aplikasi./Trans. dari bahasa Inggris M.: Mir, 1986.
Uraian pekerjaan
Cabang-cabang produksi modern dan kehidupan sosial masyarakat menetapkan tugas khusus mereka sendiri pada metode analisis fisik dan kimia untuk pengendalian kualitas produk. Salah satu metode analisis fisikokimia yang utama adalah metode analisis elektrokimia.
Metode-metode ini dapat dengan cepat dan akurat menentukan banyak indikator kualitas produk.
Metode elektrokimia untuk menganalisis komposisi suatu zat banyak digunakan di berbagai industri. Mereka memungkinkan Anda mengotomatiskan penerimaan hasil kualitas produk dan memperbaiki pelanggaran tanpa menghentikan produksi. Dalam industri makanan, metode ini menentukan keseimbangan asam-basa produk, keberadaan zat berbahaya dan beracun, serta indikator lain yang tidak hanya memengaruhi kualitas, tetapi juga keamanan pangan.
Peralatan yang dirancang untuk analisis elektrokimia relatif murah, mudah diakses, dan mudah digunakan. Oleh karena itu, metode ini banyak digunakan tidak hanya di laboratorium khusus, tetapi juga di banyak industri.
Sehubungan dengan itu, tujuan dari ku
PENDAHULUAN 2
BAGIAN TEORITIS 3
1.1 Ciri-ciri umum metode analisis fisikokimia 3
1.2 Karakteristik metode elektrokimia 4
1.3 Klasifikasi metode analisis elektrokimia 5
2 EKSPERIMENTAL-PRAKTIS BAGIAN 15
KESIMPULAN 21
REFERENSI 22
Perkenalan
Bab 1. Konsep umum. Klasifikasi metode analisis elektrokimia
Bab 2. Metode Analisis Potensiometri (Potensiometri)
1 Prinsip metode
3 Titrasi potensiometri
Bab 3. Metode analisis konduktometri
1 Prinsip metode. Konsep dasar
2 Prinsip konduktometri
3 Titrasi konduktometri
Bab 4. Analisis konduktometri (konduktometri)
1 Inti dari metode ini
2 Analisis polarografi kuantitatif
3 Penerapan polarografi
Bab 5. Titrasi amperometri
Bab 6. Analisis koulometri (koulometri)
1 Prinsip metode
3 Titrasi koulometri
Kesimpulan
Bibliografi
PERKENALAN
Metode analisis elektrokimia adalah seperangkat metode analisis kualitatif dan kuantitatif berdasarkan fenomena elektrokimia yang terjadi pada media yang diteliti atau pada antarmuka dan berhubungan dengan perubahan struktur, komposisi kimia atau konsentrasi analit.
Metode analisis elektrokimia dibagi menjadi lima kelompok utama: potensiometri, voltametri, koulometri, konduktometri, dan amperometri.
Penggunaan metode ini dalam analisis kuantitatif didasarkan pada ketergantungan nilai parameter yang diukur selama proses elektrokimia pada zat yang dipisahkan dalam larutan yang dianalisis yang berpartisipasi dalam proses elektrokimia ini. Parameter tersebut meliputi perbedaan potensial listrik dan jumlah listrik. Proses elektrokimia adalah proses yang sekaligus disertai dengan reaksi kimia dan perubahan sifat kelistrikan sistem, yang dalam hal demikian dapat disebut sistem elektrokimia. Dalam praktik analitis, sistem elektrokimia biasanya berisi sel elektrokimia yang terdiri dari bejana berisi larutan uji konduktif listrik yang ke dalamnya elektroda direndam.
Ada metode elektrokimia langsung dan tidak langsung. Dalam metode langsung, ketergantungan kekuatan arus (potensial, dll.) pada konsentrasi komponen yang ditentukan digunakan. Dalam metode tidak langsung, kekuatan arus (potensial, dll.) diukur untuk menemukan titik akhir titrasi komponen yang ditentukan dengan titran yang sesuai, yaitu ketergantungan parameter yang diukur pada volume titran digunakan.
BAB 1. KONSEP UMUM. KLASIFIKASI METODE ANALISIS ELEKTROKIMIA
Kimia elektroanalitik mencakup metode analisis elektrokimia berdasarkan reaksi elektroda dan transfer listrik melalui larutan.
Penggunaan metode elektrokimia dalam analisis kuantitatif didasarkan pada penggunaan ketergantungan nilai parameter terukur proses elektrokimia (beda potensial listrik, arus, jumlah listrik) pada kandungan analit dalam larutan yang dianalisis berpartisipasi dalam proses elektrokimia ini. Proses elektrokimia adalah proses yang disertai dengan terjadinya reaksi kimia secara simultan dan perubahan sifat kelistrikan suatu sistem, yang dalam hal demikian dapat disebut sistem elektrokimia. Dalam praktik analitik, sistem elektrokimia biasanya berisi sel elektrokimia, termasuk bejana dengan larutan uji konduktif listrik yang di dalamnya elektroda direndam.
Klasifikasi metode analisis elektrokimia. Metode analisis elektrokimia diklasifikasikan dengan cara yang berbeda-beda.Klasifikasi didasarkan pada pertimbangan sifat sumber energi listrik dalam sistem. Ada dua kelompok metode:
a) Metode tanpa memaksakan potensi eksternal (asing).
Sumber energi listrik adalah sistem elektrokimia itu sendiri, yaitu unsur galvanik (rangkaian galvanik). Metode tersebut termasuk metode potensiometri. Gaya gerak listrik - EMF - dan potensial elektroda dalam sistem seperti itu bergantung pada kandungan analit dalam larutan.
b) Metode dengan pembebanan potensi eksternal (asing). Metode-metode ini meliputi:
analisis konduktometri - berdasarkan pengukuran konduktivitas listrik larutan sebagai fungsi konsentrasinya;
analisis voltametri - berdasarkan pengukuran arus sebagai fungsi dari perbedaan potensial yang diketahui dan konsentrasi larutan;
analisis koulometri - berdasarkan pengukuran jumlah listrik yang melewati larutan sebagai fungsi konsentrasinya;
analisis elektrogravimetri - berdasarkan pengukuran massa produk reaksi elektrokimia.
Klasifikasi menurut metode penerapan metode elektrokimia. Ada metode langsung dan tidak langsung.
a) Metode langsung. Parameter elektrokimia diukur sebagai fungsi yang diketahui dari konsentrasi larutan dan, menurut pembacaan alat pengukur yang sesuai, kandungan zat yang ditentukan dalam larutan ditemukan.
b) Metode tidak langsung adalah metode titrasi yang akhir titrasinya ditentukan berdasarkan pengukuran parameter kelistrikan sistem.
Sesuai dengan klasifikasi ini, perbedaan dibuat antara, misalnya, konduktometri langsung dan titrasi konduktometri.
BAB 2. METODE ANALISIS POTENSIOMETRI (POTENSIOMETRI)
1 Prinsip metode
Analisis potensiometri (potensiometri) didasarkan pada pengukuran ggl dan potensial elektroda sebagai fungsi dari konsentrasi larutan yang dianalisis.
Jika dalam sistem elektrokimia - dalam sel galvanik - terjadi reaksi pada elektroda:
aA+bB↔dD + eE
dengan transfer n elektron, maka persamaan Nernst untuk ggl E reaksi ini berbentuk:
E꞊E˚- RTnFlnaDda Eea(A)a aBb
dimana, seperti biasa, E° adalah EMF standar reaksi (perbedaan potensial elektroda standar), R adalah konstanta gas, T adalah suhu absolut di mana reaksi terjadi, F adalah bilangan Faraday; a(A), a(B), a(D) dan i(E) - aktivitas reagen yang berpartisipasi dalam reaksi. Persamaan (10.1) berlaku untuk ggl sel galvanik yang beroperasi secara reversibel.
Untuk suhu ruangan, persamaan (10.1) dapat direpresentasikan dalam bentuk:
E꞊E˚- 0,059nlnaDda Eea(A)a aBb
Dalam kondisi dimana aktivitas reagen kira-kira sama dengan konsentrasinya, persamaan (1) menjadi persamaan (3):
꞊E˚- RTnFlncDdc EecAa aBb
dimana c(A), c(B), c(E), c(D) adalah konsentrasi reagen. Untuk suhu ruangan, persamaan ini dapat direpresentasikan sebagai (4):
꞊E˚- 0,059nlncDdc EecAa aBb
Untuk pengukuran potensiometri, dua elektroda digunakan dalam sel elektrokimia: elektroda indikator, yang potensialnya bergantung pada konsentrasi zat analit (penentu potensial) dalam larutan yang dianalisis, dan elektroda referensi, yang potensialnya tetap konstan. dalam kondisi analisis. Oleh karena itu, besarnya EMF yang ditentukan oleh persamaan (1)-(4) dapat dihitung sebagai selisih antara potensial nyata kedua elektroda tersebut.
Dalam potensiometri, jenis elektroda berikut digunakan: elektroda jenis pertama, kedua, redoks, elektroda membran.
Elektroda jenis pertama adalah elektroda yang dapat dibalik oleh kation yang umum pada bahan elektroda. Ada tiga jenis elektroda jenis pertama.
a) Logam M direndam dalam larutan garam dari logam yang sama. Reaksi reversibel terjadi pada permukaan elektroda tersebut:
Mn+ + ne = M
Potensi sebenarnya dari elektroda jenis pertama tersebut bergantung pada aktivitas a(Mn+) kation logam dan dijelaskan oleh persamaan (5)-(8).
Secara umum, untuk suhu berapa pun:
꞊E˚+ RTnFln a(Mn+)
Untuk suhu ruangan:
꞊E˚+ 0,059nln a(Mn+)
Pada konsentrasi rendah c(Mn+), ketika aktivitas kation logam a(Mn+) kira-kira sama dengan konsentrasinya:
꞊E˚+ RTnFln c(Mn+)
Untuk suhu ruangan:
b) Elektroda gas, misalnya elektroda hidrogen, termasuk elektroda hidrogen standar. Potensi elektroda gas hidrogen yang beroperasi secara reversibel ditentukan oleh aktivitas ion hidrogen, yaitu nilai pH larutan, dan pada suhu kamar sama dengan:
꞊E˚+ 0,059 lg a(H30+) = 0,059 lg a(H3O+) = -0,059рН
karena untuk elektroda hidrogen potensial standar dianggap nol ( £° =0), dan sesuai dengan reaksi elektroda: H++e = N jumlah elektron yang berpartisipasi dalam reaksi ini sama dengan satu: n = 1. c) Elektroda amalgam, yaitu amalgam logam yang direndam dalam larutan yang mengandung kation dari logam yang sama. Potensial elektroda jenis pertama tersebut bergantung pada aktivitas kation logam a(Mn+) dalam larutan dan aktivitas logam a(M) dalam amalgam: ꞊E˚+ RTnFlna(Mn+)a(M) Elektroda amalgam sangat reversibel. Elektroda tipe kedua adalah anion yang dapat dibalik. Jenis elektroda tipe kedua berikut ini dibedakan. a) Logam yang permukaannya dilapisi dengan garam yang sedikit larut dari logam yang sama, direndam dalam larutan yang mengandung anion-anion yang membentuk garam yang sedikit larut tersebut. Contohnya adalah elektroda perak klorida Ag|AgCl, KS1 atau elektroda kalomel Hg|Hg2Cl2, KS1. Elektroda perak klorida terdiri dari kawat perak yang dilapisi dengan garam yang sedikit larut dalam air, AgCI, direndam dalam larutan kalium klorida. Reaksi reversibel terjadi pada elektroda perak klorida Elektroda kalomel terdiri dari logam merkuri yang dilapisi dengan pasta merkuri(1) klorida Hg2Cl2 - kalomel yang sukar larut, dikontakkan dengan larutan kalium klorida dalam air. Reaksi reversibel terjadi pada elektroda kalomel: Cl2 + 2e = 2Hg + 2SG. Potensi sebenarnya dari elektroda jenis kedua bergantung pada aktivitas anion dan elektroda reversibel tempat terjadinya reaksi: Ne = M + An- dijelaskan oleh persamaan Nernst (9)-(12). Secara umum, pada suhu apa pun yang dapat diterima T: ꞊E˚- RTnFln a(An-) Untuk suhu ruangan: ꞊E˚- 0,059nln a(An-) Untuk kondisi di mana aktivitas anion kira-kira sama dengan konsentrasinya c(A"~): E꞊E˚- RTnFln c(An-) Untuk suhu ruangan: ꞊E˚- 0,059nln c(An-) Misalnya, potensial nyata E1 dan E2 masing-masing elektroda perak klorida dan kalomel pada suhu kamar dapat direpresentasikan sebagai: ꞊E1˚- 0,0591g a(Cl-),꞊E2˚- 0,0591g a(Cl-). Elektroda tipe kedua sangat reversibel dan stabil dalam pengoperasiannya, sehingga sering digunakan sebagai elektroda referensi yang mampu mempertahankan nilai potensial konstan secara stabil. b) Elektroda gas jenis kedua, misalnya elektroda klor Pt, Cl2 KS1. Elektroda gas tipe kedua jarang digunakan dalam analisis potensiometri kuantitatif. Elektroda redoks terdiri dari bahan inert (platinum, emas, tungsten, titanium, grafit, dll.) yang direndam dalam larutan yang mengandung Ox teroksidasi dan bentuk Merah tereduksi dari zat ini. Ada dua jenis elektroda redoks: a) elektroda yang potensialnya tidak bergantung pada aktivitas ion hidrogen, misalnya Pt | FeCl3, FeCI2, Pt | K3, K4, dst.; b) elektroda yang potensialnya bergantung pada aktivitas ion hidrogen, misalnya elektroda kuinhidron. Pada elektroda redoks, yang potensialnya tidak bergantung pada aktivitas ion hidrogen, terjadi reaksi reversibel: Sapi + ne = Merah Potensi sebenarnya dari elektroda redoks tersebut bergantung pada aktivitas bentuk teroksidasi dan tereduksi dari suatu zat dan untuk elektroda yang beroperasi secara reversibel dijelaskan, tergantung pada kondisi (dengan analogi dengan potensi yang dibahas di atas), dengan persamaan Nernst ( 13)-(16): ꞊E˚+ RTnFln a (Sapi)a (Merah)꞊E˚+ 0,059nlg a (Sapi)a (Merah)꞊E˚+ RTnFln c(Sapi)c (Merah)꞊E˚+ 0,059nlg c (Sapi) c (Merah) Jika ion hidrogen berpartisipasi dalam reaksi elektroda, maka aktivitas (konsentrasi) mereka diperhitungkan dalam persamaan Nernst yang sesuai untuk setiap kasus tertentu. Elektroda membran, atau selektif ion, adalah elektroda yang bersifat reversibel untuk ion tertentu (kation atau anion) yang diserap oleh membran padat atau cair. Potensi sebenarnya dari elektroda tersebut bergantung pada aktivitas ion-ion dalam larutan yang diserap oleh membran. Elektroda membran padat mengandung membran yang sangat tipis, pada kedua sisinya terdapat larutan berbeda yang mengandung ion yang sama untuk ditentukan, tetapi dengan konsentrasi berbeda: larutan (standar) dengan konsentrasi ion yang akan ditentukan diketahui secara tepat, dan a larutan yang akan dianalisis dengan konsentrasi ion yang tidak diketahui yang akan ditentukan. Karena perbedaan konsentrasi ion dalam kedua larutan, ion-ion pada sisi membran yang berbeda diserap dalam jumlah yang tidak sama, dan muatan listrik yang timbul dari penyerapan ion pada sisi membran yang berbeda juga berbeda. Akibatnya timbul perbedaan potensial membran. Penentuan ion menggunakan elektroda selektif ion membran disebut ionometri. Seperti disebutkan di atas, dalam pengukuran potensiometri, sel elektrokimia mencakup dua elektroda - elektroda indikator dan elektroda referensi. Besarnya EMF yang dihasilkan dalam sel sama dengan beda potensial antara kedua elektroda tersebut. Karena potensial elektroda referensi tetap konstan pada kondisi penentuan potensiometri, ggl hanya bergantung pada potensial elektroda indikator, yaitu. pada aktivitas (konsentrasi) ion-ion tertentu dalam larutan. Ini adalah dasar penentuan potensiometri konsentrasi zat tertentu dalam larutan yang dianalisis. Untuk menentukan konsentrasi suatu zat dalam larutan secara potensiometri, digunakan potensiometri langsung dan titrasi potensiometri, meskipun metode kedua lebih sering digunakan daripada metode pertama. Penentuan konsentrasi suatu zat dalam potensiometri langsung biasanya dilakukan dengan menggunakan metode kurva kalibrasi atau metode penambahan standar. a) Metode grafik kalibrasi. Siapkan serangkaian 5-7 larutan standar dengan kandungan analit yang diketahui. Konsentrasi analit dan kekuatan ionik dalam larutan standar tidak boleh berbeda jauh dari konsentrasi dan kekuatan ion larutan yang dianalisis: dalam kondisi ini, kesalahan penentuan dapat dikurangi. Kekuatan ionik semua larutan dipertahankan konstan dengan memasukkan elektrolit yang acuh tak acuh. Larutan standar dimasukkan secara berurutan ke dalam sel elektrokimia (potensiometri). Biasanya sel ini berupa gelas kimia yang di dalamnya ditempatkan elektroda indikator dan elektroda referensi. EMF larutan standar diukur dengan mencuci elektroda dan kaca secara menyeluruh dengan air suling sebelum mengisi sel dengan setiap larutan standar. Berdasarkan data yang diperoleh, dibuat grafik kalibrasi pada koordinat EMF-log c, dimana c adalah konsentrasi analit dalam larutan standar. Biasanya grafik ini berupa garis lurus. Kemudian larutan yang dianalisis ditambahkan ke sel elektrokimia (setelah mencuci sel dengan air suling) dan ggl sel diukur. Dengan menggunakan grafik kalibrasi, log c(X) ditemukan, di mana c(X) adalah konsentrasi analit dalam larutan yang dianalisis. b) Metode penjumlahan standar. Volume V(X) yang diketahui dari larutan yang dianalisis dengan konsentrasi c(X) ditambahkan ke sel elektrokimia dan ggl sel diukur. Kemudian, volume kecil larutan standar V(st) yang diukur secara akurat dengan konsentrasi c(st) analit yang diketahui dan cukup besar ditambahkan ke larutan yang sama dan ggl sel ditentukan kembali. Hitung konsentrasi c(X) analit dalam larutan yang dianalisis menggunakan rumus (10.17): c(X)= c(st) V (st)V X+ V (st) Di mana △ E adalah selisih antara dua nilai EMF yang diukur, n adalah jumlah elektron yang berpartisipasi dalam reaksi elektroda. Penerapan potensiometri langsung. Metode tersebut digunakan untuk menentukan konsentrasi ion hidrogen (pH larutan), anion, dan ion logam (ionometri). Saat menggunakan potensiometri langsung, pemilihan elektroda indikator yang sesuai dan pengukuran potensial kesetimbangan yang akurat memainkan peran penting. Saat menentukan pH larutan, elektroda digunakan sebagai elektroda indikator, yang potensialnya bergantung pada konsentrasi ion hidrogen: kaca, hidrogen, quinhydrone, dan beberapa lainnya. Elektroda kaca membran yang dapat dibalik dalam ion hidrogen lebih sering digunakan. Potensi elektroda kaca tersebut ditentukan oleh konsentrasi ion hidrogen, oleh karena itu EMF suatu rangkaian yang menyertakan elektroda kaca sebagai indikator dijelaskan pada suhu kamar dengan persamaan: K + 0,059рН, dimana konstanta K bergantung pada bahan membran dan sifat elektroda referensi. Elektroda kaca memungkinkan Anda menentukan pH dalam kisaran pH = 0-10 (lebih sering dalam kisaran pH = 2-10) dan sangat reversibel dan stabil dalam pengoperasiannya. Elektroda quinhydrone, yang sering digunakan di masa lalu, adalah elektroda redoks yang potensialnya bergantung pada konsentrasi ion hidrogen. Ini terdiri dari kawat platina yang direndam dalam larutan asam (biasanya HC1) jenuh dengan quinhydrone, senyawa ekuimolekular kuinon dan hidrokuinon dengan komposisi C6H402 C6H4(OH)2 (bubuk hijau tua, sedikit larut dalam air). Penunjukan skema elektroda quinhydrone: Pt | kuinhidron, HC1. Reaksi redoks terjadi pada elektroda quinhydrone: C6H402 + 2H+ + 2e = C6H4(OH)2 Potensi elektroda kuinhidron pada suhu kamar dijelaskan dengan rumus E°-0,059рН. Elektroda quinhydrone memungkinkan Anda mengukur pH larutan dalam kisaran pH = 0-8,5. Pada pH< 0 хингидрон гидролитически расщепляется: при рН >8,5 hidrokuinon, yang merupakan asam lemah, mengalami reaksi netralisasi.Elektroda kuinhidron tidak dapat digunakan dengan adanya zat pengoksidasi dan pereduksi kuat. Elektroda selektif ion membran digunakan, seperti disebutkan di atas, dalam ionometri sebagai indikator untuk menentukan berbagai kation (Li+, Na+, K+ Mg2t, Ca2+, Cd2+, Fe2+, Ni2+, dll.) ion (F-, Cl-, Br -, I-, S2-, dst). Keuntungan potensiometri langsung meliputi kesederhanaan dan kecepatan pengukuran; pengukuran memerlukan volume larutan yang kecil. 3Titrasi potensiometri Titrasi potensiometri adalah metode penentuan volume titran yang digunakan untuk titrasi analit dalam larutan yang dianalisis dengan mengukur EMF (selama proses titrasi) menggunakan rangkaian galvanik yang terdiri dari elektroda indikator. dan elektroda referensi. Dalam titrasi potensiometri, larutan yang dianalisis yang terletak di sel elektrokimia dititrasi titran yang sesuai, memperbaiki akhir titrasi dengan perubahan tajam pada EMF dari rangkaian yang diukur - potensial elektroda indikator, yang bergantung pada konsentrasi ion yang sesuai dan berubah tajam pada titik ekivalen. Perubahan potensial elektroda indikator selama proses titrasi diukur tergantung pada volume titran yang ditambahkan. Berdasarkan data yang diperoleh, kurva titrasi potensiometri dibuat dan volume titran yang dikonsumsi dalam sel bahan bakar ditentukan dari kurva ini. Titrasi potensiometri tidak memerlukan penggunaan indikator yang berubah warna di dekat elemen bahan bakar. Penerapan titrasi potensiometri. Metode ini bersifat universal, dapat digunakan untuk menunjukkan akhir titrasi pada semua jenis titrasi: asam basa, redoks, kompleksimetri, pengendapan, dan saat titrasi dalam media non-air. Elektroda kaca, merkuri, selektif ion, platinum, dan perak digunakan sebagai elektroda indikator, dan kalomel, perak klorida, dan elektroda kaca digunakan sebagai elektroda referensi. Metode ini memiliki akurasi tinggi dan sensitivitas tinggi: metode ini memungkinkan titrasi dalam media keruh, berwarna, tidak berair, dan penentuan komponen campuran secara terpisah dalam satu larutan yang dianalisis, misalnya, penentuan ion klorida dan iodida secara terpisah selama titrasi argentometri. Metode titrasi potensiometri digunakan untuk menganalisis banyak zat obat, misalnya asam askorbat, obat sulfa, barbiturat, alkaloid, dll. Pendiri analisis konduktometri dianggap sebagai fisikawan dan ahli kimia fisik Jerman F.V.G. Kohlrausch (1840-1910), yang pertama kali pada tahun 1885 mengusulkan persamaan yang menetapkan hubungan antara konduktivitas listrik larutan elektrolit kuat dan konsentrasinya. DI DALAM pertengahan 40an abad XX metode titrasi konduktometri frekuensi tinggi dikembangkan. Sejak awal tahun 60an. abad XX Detektor konduktometri mulai digunakan dalam kromatografi cair. 1 Prinsip metode. Konsep dasar Analisis konduktometri (konduktometri) didasarkan pada penggunaan hubungan antara konduktivitas listrik (konduktivitas listrik) larutan elektrolit dan konsentrasinya. Konduktivitas listrik larutan elektrolit - konduktor tipe kedua - dinilai berdasarkan pengukuran hambatan listriknya dalam sel elektrokimia, yang merupakan bejana kaca (kaca) dengan dua elektroda yang disolder ke dalamnya, di antaranya larutan elektrolit uji berada. terletak. Arus listrik bolak-balik dialirkan melalui sel. Elektroda paling sering dibuat dari logam platina, yang, untuk menambah permukaan elektroda, dilapisi dengan lapisan platina spons dengan pengendapan elektrokimia senyawa platina dari larutan (elektroda platina berlapis). Untuk menghindari komplikasi yang terkait dengan proses elektrolisis dan polarisasi, pengukuran konduktometri dilakukan dalam medan listrik bolak-balik. Hambatan listrik R lapisan larutan elektrolit antar elektroda, seperti hambatan listrik konduktor jenis pertama, berbanding lurus dengan panjang (ketebalan) l lapisan ini dan berbanding terbalik dengan luas permukaan S elektroda: R= ρ lS lkS dimana koefisien proporsionalitas p disebut hambatan listrik spesifik, dan nilai kebalikannya k = 1/p disebut daya hantar listrik spesifik (konduktivitas listrik). Karena hambatan listrik R diukur dalam ohm, ketebalan l lapisan larutan elektrolit dalam cm, dan luas permukaan S elektroda dalam cm2, maka konduktivitas listrik spesifik k diukur dalam satuan Ohm-1 cm-1, atau, karena Ohm-1 adalah Siemens (Sm), maka - dalam satuan Sm cm-1. Dalam arti fisis, daya hantar listrik spesifik adalah daya hantar listrik suatu lapisan elektrolit yang terletak di antara sisi-sisi kubus yang panjang sisinya 1 cm, secara numerik sama dengan kuat arus yang melalui lapisan larutan elektrolit dengan luas penampang. 1 cm2 dengan gradien potensial listrik yang diterapkan sebesar 1 V/cm. Konduktivitas listrik spesifik bergantung pada sifat elektrolit dan pelarut, konsentrasi larutan, dan suhu. Dengan meningkatnya konsentrasi larutan elektrolit, konduktivitas listrik spesifiknya mula-mula meningkat, kemudian melewati maksimum, dan kemudian menurun. Sifat perubahan konduktivitas listrik ini disebabkan oleh alasan berikut. Awalnya, dengan meningkatnya konsentrasi elektrolit, jumlah ion – partikel pembawa arus – meningkat baik untuk elektrolit kuat maupun lemah. Oleh karena itu, konduktivitas listrik larutan (arus listrik yang melewatinya) meningkat. Kemudian, dengan meningkatnya konsentrasi larutan, viskositasnya (penurunan kecepatan pergerakan ion) dan interaksi elektrostatis antar ion meningkat, yang mencegah peningkatan arus listrik dan, pada konsentrasi yang cukup tinggi, membantu menguranginya. Dalam larutan elektrolit lemah, dengan meningkatnya konsentrasi, derajat disosiasi molekul elektrolit menurun, yang menyebabkan penurunan jumlah ion - partikel konduktif - dan penurunan konduktivitas listrik spesifik. Dalam larutan elektrolit kuat pada konsentrasi tinggi, pembentukan asosiasi ionik (kembar ionik, tee, dll.) dimungkinkan, yang juga menyebabkan penurunan konduktivitas listrik. Konduktivitas listrik spesifik larutan elektrolit meningkat seiring dengan meningkatnya suhu karena penurunan viskositas larutan, yang menyebabkan peningkatan kecepatan pergerakan ion, dan untuk elektrolit lemah, juga peningkatan derajat ionisasinya. (disosiasi menjadi ion). Oleh karena itu, pengukuran konduktometri kuantitatif harus dilakukan pada suhu konstan, termostat sel konduktometri. Selain konduktivitas listrik spesifik, konduktometri menggunakan konduktivitas listrik setara X dan konduktivitas listrik molar p. Dalam istilah fisika, daya hantar listrik ekivalen X adalah daya hantar listrik suatu lapisan larutan elektrolit setebal 1 cm yang terletak di antara elektroda-elektroda yang identik dengan luas sedemikian rupa sehingga volume larutan elektrolit yang tertutup di antara keduanya mengandung 1 g ekuivalen zat terlarut. Dalam hal ini, massa molar ekuivalen dianggap sebagai massa molar partikel identik dengan nomor muatan satuan (“muatan”), misalnya, H+, Br -, 12Ca2+, 13Fe3+, dst. Konduktivitas listrik setara meningkat dengan menurunnya konsentrasi larutan elektrolit. Nilai maksimum konduktivitas listrik setara dicapai dengan pengenceran larutan yang tak terbatas. Konduktivitas listrik setara, seperti konduktivitas spesifik, meningkat seiring dengan meningkatnya suhu. Konduktivitas listrik ekivalen X berhubungan dengan konduktivitas listrik spesifik k melalui hubungan (20): λ= 1000 kc Pada konduktometri langsung, konsentrasi suatu zat dalam larutan yang dianalisis ditentukan dari hasil pengukuran konduktivitas listrik spesifik larutan tersebut. Saat mengolah data pengukuran, dua metode digunakan: metode perhitungan dan metode grafik kalibrasi. Metode kalkulasi. Sesuai dengan persamaan (10.20), konsentrasi molar ekuivalen c elektrolit dalam larutan dapat dihitung jika konduktifitas listrik spesifik k dan konduktifitas listrik ekivalen diketahui. : c = 1000kλ Konduktivitas listrik spesifik ditentukan secara eksperimental berdasarkan pengukuran hambatan listrik sel konduktometri termostat. Konduktivitas listrik setara larutan λ sama dengan jumlah mobilitas kation λ+ dan anion X λ -:
λ = λ + + λ-
Jika mobilitas kation dan anion diketahui, maka konsentrasi dapat dihitung dengan menggunakan rumus (24): c = 1000 kλ + + λ- Hal ini dilakukan ketika menentukan dengan konduktometri langsung konsentrasi elektrolit yang sukar larut dalam larutan jenuhnya (kalsium, barium sulfat; perak halida, dll.). Metode grafik kalibrasi. Serangkaian larutan standar disiapkan, yang masing-masing mengandung konsentrasi analit yang diketahui secara tepat, dan konduktivitas listriknya diukur pada suhu konstan dalam sel konduktometri termostat. Berdasarkan data yang diperoleh, dibuat grafik kalibrasi yang memplot konsentrasi larutan standar pada sumbu absis, dan nilai daya hantar listrik spesifik pada sumbu ordinat. Sesuai dengan persamaan (24), grafik yang diplot biasanya mewakili garis lurus pada rentang perubahan konsentrasi yang relatif kecil. Dalam rentang konsentrasi yang luas, ketika mobilitas kation dan anion yang termasuk dalam persamaan (24) dapat berubah secara nyata, penyimpangan dari ketergantungan linier diamati. Kemudian, dalam kondisi yang sama, konduktivitas listrik spesifik k(X) dari elektrolit yang ditentukan dalam larutan yang dianalisis dengan konsentrasi c(X) yang tidak diketahui diukur dan nilai c(X) yang diinginkan ditemukan dari grafik. Misalnya, kandungan barium dalam air barit, larutan jenuh barium hidroksida, ditentukan. Penerapan konduktometri langsung. Metode konduktometri langsung ditandai dengan kesederhanaan dan sensitivitas tinggi. Namun cara yang dilakukan tidak terlalu selektif. Konduktometri langsung memiliki kegunaan yang terbatas dalam analisis. Ini digunakan untuk menentukan kelarutan elektrolit yang sukar larut, untuk mengontrol kualitas air suling dan produk makanan cair (susu, minuman, dll.), untuk menentukan kandungan garam total dalam air mineral, laut, sungai dan dalam beberapa kasus lainnya. . 3 Titrasi konduktometri Dalam titrasi konduktometri, kemajuan titrasi dipantau oleh perubahan konduktivitas listrik dari larutan yang dianalisis yang terletak di sel konduktometri antara dua elektroda inert (biasanya terbuat dari platina berlapis). Berdasarkan data yang diperoleh, ditarik kurva titrasi konduktometri yang mencerminkan ketergantungan konduktivitas listrik larutan yang dititrasi pada volume titran yang ditambahkan. Titik akhir titrasi paling sering ditemukan dengan mengekstrapolasi bagian kurva titrasi di daerah yang kemiringannya berubah. Dalam hal ini, penggunaan indikator yang berubah warna di dekat TE tidak diperlukan. Dalam titrasi konduktometri, berbagai jenis reaksi digunakan: asam-basa, redoks, pengendapan, proses kompleksasi. Penerapan titrasi konduktometri. Metode titrasi konduktometri memiliki sejumlah keunggulan. Titrasi dapat dilakukan pada media yang keruh, berwarna, dan buram. Sensitivitas metode ini cukup tinggi - hingga ~10~* mol/l; kesalahan penentuan berkisar antara 0,1 hingga 2%. Analisisnya dapat diotomatisasi. Kerugian dari metode ini termasuk selektivitas yang rendah. Konsep titrasi konduktometri frekuensi tinggi (frekuensi radio). Kemajuan titrasi dipantau menggunakan teknik konduktometri arus bolak-balik yang dimodifikasi, di mana frekuensi arus bolak-balik dapat mencapai jutaan osilasi per detik. Biasanya elektroda ditempatkan (dipasang) di bagian luar bejana titrasi (sel konduktifitas) agar tidak bersentuhan dengan larutan yang dititrasi. Berdasarkan hasil pengukuran, ditarik kurva titrasi konduktometri. Titik akhir titrasi ditentukan dengan mengekstrapolasi bagian kurva titrasi pada daerah dimana kemiringannya berubah. BAB 4. ANALISIS KONDUKTOMETRI (KONDUKTOMETRI) 4.1 Inti dari metode ini Analisis polarografi (polarografi) didasarkan pada penggunaan hubungan berikut antara parameter listrik sel elektrokimia (dalam hal ini, polarografi), di mana potensial eksternal diterapkan, dan sifat larutan yang dianalisis yang terkandung di dalamnya. a) Analisis polarografi kualitatif menggunakan hubungan antara besarnya potensial listrik eksternal yang diterapkan pada mikroelektroda, di mana reduksi (atau oksidasi) analit diamati pada mikroelektroda dalam kondisi tertentu, dan sifat zat yang direduksi (atau teroksidasi). b) Dalam analisis polarografi kuantitatif, digunakan hubungan antara besarnya arus listrik difusi dan konsentrasi zat yang ditentukan (pereduksi atau pengoksidasi) dalam larutan yang dianalisis. Parameter kelistrikan - besarnya potensial listrik yang diterapkan dan besarnya arus difusi - ditentukan dengan menganalisis kurva polarisasi, atau arus-tegangan, yang dihasilkan, yang secara grafis mencerminkan ketergantungan arus listrik dalam sel polarografik pada besarnya potensial yang diterapkan dari mikroelektroda. Oleh karena itu, polarografi kadang-kadang disebut voltametri langsung. Metode analisis polarografi klasik menggunakan elektroda penjatuh merkuri dikembangkan dan diusulkan pada tahun 1922 oleh ilmuwan Ceko Jaroslav Heyrovsky (1890-1967), meskipun elektroda penjatuh merkuri sendiri digunakan oleh fisikawan Ceko B. Kucera pada tahun 1903. Pada tahun 1925. J. Heyrovsky dan M. Shikata merancang polarograf pertama, yang memungkinkan perekaman kurva polarisasi secara otomatis. Selanjutnya berbagai modifikasi metode polarografi dikembangkan. Nilai arus difusi rata-rata iD ditentukan oleh persamaan Ilkovich (25): dimana K adalah koefisien proporsionalitas, c adalah konsentrasi (mmol/l) zat depolarisasi yang aktif secara polarografis; iD diukur dalam microamps sebagai perbedaan antara arus pembatas dan arus sisa. Koefisien proporsionalitas K dalam persamaan Ilkovich bergantung pada sejumlah parameter dan sama dengan K=607nD12m23τ16 dimana n adalah jumlah elektron yang mengambil bagian dalam reaksi redoks elektroda; D adalah koefisien difusi zat pereduksi (cm2/s); t adalah massa merkuri yang mengalir keluar kapiler per detik (mg); t adalah waktu pembentukan (dalam detik) setetes air raksa pada potensial setengah gelombang (biasanya 3-5 detik). Karena koefisien difusi D bergantung pada suhu, koefisien proporsionalitas K dalam persamaan Ilkovich berubah seiring suhu. Untuk larutan berair dalam kisaran suhu 20-50 °C, koefisien difusi zat depolarisasi yang aktif secara polarografis meningkat sekitar 3% dengan peningkatan suhu sebesar satu derajat, yang menyebabkan peningkatan arus difusi rata-rata iD sebesar ~1 -2%. Oleh karena itu, polarografi dilakukan pada suhu konstan, termostat sel polarografi biasanya pada 25 ± 0,5°C. Massa merkuri t dan waktu pembentukan tetesan t bergantung pada karakteristik elektroda penjatuh merkuri dan ketinggian kolom merkuri di kapiler dan di reservoir yang terhubung ke kapiler. Kapiler kaca dari mikroelektroda tetesan merkuri biasanya memiliki diameter luar 3-7 mm, diameter dalam 0,03 hingga 0,05 mm, dan panjang 6-15 cm Ketinggian kolom merkuri dari ujung bawah kapiler ke permukaan air raksa bagian atas di reservoir adalah 40-80 cm; Kandungan elektrolit acuh tak acuh dalam larutan terpolarisasi yang dianalisis harus kira-kira 100 kali lebih tinggi dari kandungan zat depolarisasi yang ditentukan, dan ion-ion elektrolit latar belakang tidak boleh dibuang dalam kondisi polarografi sampai zat aktif secara polarografis habis. Polarografi dilakukan dengan menggunakan air, campuran air-organik (air - etanol, air - aseton, air - dimetilformamida, dll) dan media non-air (etanol, aseton, dimetilformamida, dimetil sulfoksida, dll) sebagai pelarut. Sebelum polarografi dimulai, arus gas inert (nitrogen, argon, dll.) dialirkan melalui larutan yang dianalisis untuk menghilangkan oksigen terlarut, yang juga menghasilkan gelombang polarografi akibat reduksi sesuai skema berikut: 2Н+ + 2е = Н202 Н202 + 2Н+ + 2е = 2Н20 Kadang-kadang - dalam kasus larutan basa - alih-alih melewatkan arus gas inert, sejumlah kecil zat pereduksi aktif - natrium sulfit, metol - ditambahkan ke larutan yang dianalisis, yang mengikat oksigen terlarut dengan bereaksi dengannya. 4.2 Analisis polarografi kuantitatif Dari uraian di atas dapat disimpulkan bahwa analisis polarografi kuantitatif didasarkan pada pengukuran arus difusi iD sebagai fungsi dari konsentrasi zat depolarisasi yang aktif secara polarografis yang ditentukan dalam larutan yang dipolarisasi. Saat menganalisis polarogram yang dihasilkan, konsentrasi analit ditentukan menggunakan metode kurva kalibrasi, penambahan standar, dan larutan standar. a) Metode kurva kalibrasi paling sering digunakan. Dengan menggunakan metode ini, serangkaian larutan standar disiapkan, yang masing-masing mengandung konsentrasi analit yang diketahui secara tepat. Setiap larutan dibuat polarografnya (setelah meniupkan arus gas inert melaluinya) dalam kondisi yang sama, polarogram diperoleh dan nilai E12 (sama untuk semua larutan) dan arus difusi iD (berbeda untuk semua larutan) ditemukan . Berdasarkan data yang diperoleh, dibuat grafik kalibrasi pada koordinat iD-c yang biasanya berupa garis lurus sesuai dengan persamaan Ilkovich. Kemudian dilakukan polarografi pada larutan yang dianalisis dengan konsentrasi c(X) analit yang tidak diketahui, diperoleh polarogram, arus difusi iD(X) diukur, dan konsentrasi c(X) dicari dari grafik kalibrasi. . b) Metode penjumlahan standar. Polarogram larutan yang dianalisis dengan konsentrasi analit c(X) yang tidak diketahui diperoleh dan nilai arus difusi ditemukan, yaitu. tinggi h dari polarogram. Kemudian sejumlah analit yang diketahui secara pasti ditambahkan ke dalam larutan yang dianalisis, meningkatkan konsentrasinya sebesar nilai c(st), polarografi dilakukan lagi dan nilai arus difusi baru ditemukan - ketinggian polarogram h + △ H. Sesuai dengan persamaan Ilkovich (25), kita dapat menulis: h = Kc(X), △ h = Kc(st), Di mana H △ h = c(X)c(st) dan c(X) = h △ hc(st) c) Metode solusi standar. Dalam kondisi yang sama, polarografi dilakukan pada dua larutan: larutan yang dianalisis dengan konsentrasi c(X) yang tidak diketahui dan larutan standar dengan konsentrasi c(st) yang diketahui secara tepat dari zat yang ditentukan. Dari polarogram yang dihasilkan, tinggi gelombang polarografik h(X) dan h(st) ditemukan, sesuai dengan arus difusi pada konsentrasi c(X) dan c(st), masing-masing. Menurut persamaan Ilkovich (25) kita mempunyai: (X) = Kc(X), h(st) = Kc(st), Larutan standar dibuat sedemikian rupa sehingga konsentrasinya sedekat mungkin dengan konsentrasi larutan yang ditentukan. Dalam kondisi ini, kesalahan penentuan dapat diminimalkan. 3 Penerapan polarografi Penerapan metode. Polarografi digunakan untuk menentukan sejumlah kecil zat anorganik dan organik. Ribuan teknik analisis polarografi kuantitatif telah dikembangkan. Metode telah diusulkan untuk penentuan polarografik hampir semua kation logam, sejumlah anion (bromat, iodat, nitrat, ion permanganat), senyawa organik dari berbagai kelas yang mengandung gugus diazo, karbonil, peroksida, gugus epoksi, ikatan rangkap karbon-karbon , serta ikatan karbon-halogen, nitrogen-oksigen, sulfur-sulfur. Metode farmakope digunakan untuk penentuan asam salisilat, norsulfazol, alkaloid vitamin B, asam folat, kellin dalam bentuk bubuk dan tablet, nikotinamida, piridoksin hidroklorida, sediaan arsenik, glikosida jantung, serta oksigen dan berbagai pengotor dalam obat-obatan. Metode ini memiliki sensitivitas tinggi (hingga 10"5-10T6 mol/l); selektivitas; reproduktifitas hasil yang relatif baik (hingga ~2%); jangkauan aplikasi yang luas; memungkinkan Anda menganalisis campuran zat tanpa pemisahannya, diwarnai larutan, larutan dalam volume kecil (volume sel polarografik bisa sekecil 1 ml); melakukan analisis dalam aliran larutan; mengotomatisasi analisis." Kerugian dari metode ini termasuk toksisitas merkuri, oksidasinya yang cukup mudah dengan adanya zat pengoksidasi, dan kompleksitas relatif dari peralatan yang digunakan. Varian lain dari metode polarografi. Selain polarografi klasik yang dijelaskan di atas, yang menggunakan mikroelektroda merkuri yang menetes dengan potensial listrik yang meningkat secara seragam pada arus listrik konstan, varian lain dari metode polarografi telah dikembangkan - polarografi turunan, diferensial, pulsa, osilografi; polarografi arus bolak-balik - juga dalam versi yang berbeda. BAB 5. TITRASI AMPEROMETRI Inti dari metode ini. Titrasi amperometri (titrasi polarisasi potensiostatik) adalah salah satu jenis metode voltametri (bersama dengan polarografi). Hal ini didasarkan pada pengukuran arus antara elektroda sel elektrokimia, yang diberi tegangan tertentu, sebagai fungsi dari volume titran yang ditambahkan. Sesuai dengan persamaan Ilkovich (25): Arus difusi iD dalam sel polarografik semakin besar, semakin tinggi konsentrasi c zat aktif polarografis. Jika, ketika titran ditambahkan ke larutan titrasi yang dianalisis yang terletak di sel polarografi, konsentrasi zat tersebut berkurang atau bertambah, maka arus difusi juga berkurang atau meningkat. Titik ekivalen ditentukan oleh perubahan tajam dalam penurunan atau peningkatan arus difusi, yang berhubungan dengan berakhirnya reaksi zat yang dititrasi dengan titran. Ada perbedaan antara titrasi amperometri dengan satu elektroda terpolarisasi, disebut juga titrasi dengan membatasi arus, titrasi polarografik atau polarimetri, dan titrasi amperometri dengan dua elektroda terpolarisasi identik, atau titrasi “sampai arus berhenti sepenuhnya”, titrasi biamperometri. Titrasi amperometri dengan satu elektroda terpolarisasi. Hal ini didasarkan pada pengukuran arus dalam sel polarografi tergantung pada jumlah titran yang ditambahkan pada potensial eksternal konstan pada mikroelektroda, sedikit lebih tinggi dari potensial setengah gelombang pada kurva tegangan arus zat X atau titran T yang dititrasi. Biasanya, potensial eksternal yang dipilih sesuai dengan daerah pembatas arus pada polarogram X atau T. Titrasi dilakukan pada instalasi yang terdiri dari sumber arus searah dengan tegangan yang dapat disesuaikan, dimana galvanometer dan sel titrasi polarografi dihubungkan secara seri. Elektroda kerja (penunjuk) sel dapat berupa elektroda tetes merkuri, elektroda platina atau grafit yang diam atau berputar. Bila menggunakan elektroda padat, larutan perlu diaduk selama titrasi. Elektroda perak klorida atau kalomel digunakan sebagai elektroda referensi. Latar belakangnya adalah, tergantung pada kondisinya, berbagai elektrolit yang tidak aktif secara polarografis pada potensial tertentu (HN03, H2S04, NH4NO3, dll.). Pertama, kurva arus-tegangan (polarogram) diperoleh untuk X dan T pada kondisi yang sama dimana titrasi amperometri seharusnya dilakukan. Berdasarkan pertimbangan kurva ini, nilai potensial dipilih dimana nilai arus pembatas dari X atau T yang aktif secara polarografis tercapai.Nilai potensial yang dipilih dijaga konstan selama proses titrasi. Konsentrasi titran T yang digunakan untuk titrasi amperometri harus kira-kira 10 kali lebih tinggi dari konsentrasi X; dalam hal ini, praktis tidak perlu melakukan koreksi pengenceran larutan selama titrasi. Jika tidak, semua kondisi yang diperlukan untuk mendapatkan polarogram terpenuhi. Persyaratan untuk termostasi tidak seketat polarografi langsung, karena akhir titrasi tidak ditentukan oleh nilai absolut arus difusi, tetapi oleh perubahan nilainya yang tajam. Larutan analisis yang mengandung X ditambahkan ke sel polarografi, dan titran T ditambahkan dalam porsi kecil, mengukur arus i setiap kali. Besarnya arus i bergantung pada konsentrasi zat aktif secara polarografis. Pada titik ekivalen, nilai i berubah drastis. Berdasarkan hasil titrasi amperometri, dibuat kurva titrasi. Kurva titrasi amperometri adalah representasi grafis dari perubahan arus / sebagai fungsi dari volume V titran yang ditambahkan. Kurva titrasi diplot dalam arus koordinat i - volume V dari titran yang ditambahkan T (atau derajat titrasi). Tergantung pada sifat zat X yang dititrasi dan titran T, kurva titrasi amperometri dapat bermacam-macam jenisnya. Titrasi biamperometri dilakukan dengan pengadukan larutan yang kuat dalam suatu pengaturan yang terdiri dari sumber arus searah dengan potensiometer, dari mana beda potensial yang dapat disesuaikan (0,05-0,25 V) disuplai melalui mikroammeter sensitif ke elektroda sel elektrokimia. Sebelum titrasi, larutan yang akan dititrasi ditambahkan ke dalam larutan tersebut dan titran ditambahkan sedikit demi sedikit sampai arus tiba-tiba berhenti atau muncul, sebagaimana dinilai dari pembacaan mikroammeter. Elektroda platina yang digunakan dalam sel elektrokimia dibersihkan secara berkala dengan merendamnya selama ~30 menit dalam asam nitrat pekat mendidih yang mengandung aditif besi klorida, diikuti dengan mencuci elektroda dengan air. Titrasi biamperometri adalah metode farmakope; digunakan dalam iodometri, nitritometri, aquametri, dan untuk titrasi dalam media non-air. BAB 6. ANALISIS KOULOMETRI (KOULOMETRI) 1 Prinsip metode koulometri titrasi konduktometri elektrokimia Analisis koulometri (koulometri) didasarkan pada penggunaan hubungan antara massa m suatu zat yang bereaksi selama elektrolisis dalam sel elektrokimia dan jumlah listrik Q yang melewati sel elektrokimia selama elektrolisis hanya zat tersebut. Sesuai dengan hukum terpadu elektrolisis M Faraday, massa t (dalam gram) berhubungan dengan jumlah listrik Q (dalam coulomb) melalui hubungan (27) dimana M adalah massa molar zat yang bereaksi selama elektrolisis, g/mol; n adalah jumlah elektron yang berpartisipasi dalam reaksi elektroda; 96487 C/mol adalah bilangan Faraday. Banyaknya listrik Q (dalam C) yang melewati sel elektrokimia selama elektrolisis sama dengan hasil kali arus listrik i (dalam A) dan waktu elektrolisis τ ( di c): Jika jumlah listrik Q diukur, maka menurut (27) massa m dapat dihitung, hal ini berlaku jika seluruh jumlah listrik Q yang melewati sel elektrokimia selama elektrolisis dihabiskan hanya untuk elektrolisis a substansi tertentu; proses sampingan harus dikecualikan. Dengan kata lain output saat ini (efisiensi) harus 100%. Karena, sesuai dengan hukum terpadu elektrolisis M. Faraday, untuk menentukan massa t (g) suatu zat yang bereaksi selama elektrolisis, perlu mengukur jumlah listrik Q yang dihabiskan untuk transformasi elektrokimia zat yang ditentukan. , dalam coulomb, metode ini disebut koulometri. Tugas utama pengukuran koulometri adalah menentukan jumlah listrik Q seakurat mungkin. Analisis koulometri dilakukan baik dalam mode amerostatik (galvanostatik), yaitu. dengan arus listrik konstan i=konstanta, atau dengan potensial konstan elektroda kerja yang terkontrol (koulometri potensiostatik), bila arus listrik berubah (berkurang) selama proses elektrolisis. Pada kasus pertama, untuk menentukan besarnya listrik Q, cukup mengukur waktu elektrolisis t(s), arus searah /(A) seakurat mungkin dan menghitung nilai Q menggunakan rumus (10.28). Dalam kasus kedua, nilai Q ditentukan dengan perhitungan atau menggunakan koulometer kimia. Ada koulometri langsung dan koulometri tidak langsung (titrasi koulometri). Inti dari metode ini. Koulometri langsung pada arus konstan jarang digunakan. Lebih sering, koulometri digunakan dengan potensial konstan terkontrol dari elektroda kerja atau koulometri potensiostatik langsung. Dalam koulometri potensiostatik langsung, zat yang ditentukan dielektrolisis secara langsung. Jumlah listrik yang dihabiskan untuk elektrolisis zat ini diukur, dan massa m zat yang ditentukan dihitung menggunakan persamaan. Selama proses elektrolisis, potensial elektroda kerja dijaga konstan, E = const, yang biasanya digunakan perangkat - potensiostat. Nilai konstanta potensial E dipilih terlebih dahulu berdasarkan pertimbangan kurva arus-tegangan (polarisasi) yang dibangun pada koordinat arus i - potensial E (seperti yang dilakukan dalam polarografi), diperoleh pada kondisi yang sama di mana elektrolisis akan dilakukan. dilakukan. Biasanya, nilai potensial E dipilih yang sesuai dengan wilayah arus pembatas untuk zat yang dianalisis dan sedikit lebih tinggi dari potensial setengah gelombang E12 (sebesar -0,05-0,2 V). Pada nilai potensial ini, seperti pada polarografi, elektrolit latar belakang tidak boleh mengalami elektrolisis. Ketika proses elektrolisis berlangsung pada potensial konstan, arus listrik dalam sel berkurang, seiring dengan berkurangnya konsentrasi zat elektroaktif yang berpartisipasi dalam reaksi elektroda. Dalam hal ini arus listrik berkurang terhadap waktu menurut hukum eksponensial dari nilai awal i0 pada waktu t = O ke nilai i pada waktu t: dimana koefisien k bergantung pada sifat reaksi, geometri sel elektrokimia, luas elektroda kerja, koefisien difusi zat yang ditentukan, kecepatan pengadukan larutan dan volumenya. Metode untuk menentukan jumlah listrik yang dilewatkan melalui suatu larutan dalam koulometri potensiostatik langsung. Nilai Q dapat ditentukan dengan metode perhitungan atau menggunakan koulometer kimia. a) Perhitungan kuantitas Q dari area di bawah kurva i versus m Untuk menentukan Q tanpa kesalahan yang nyata, metode ini memerlukan penyelesaian proses elektrolisis yang hampir lengkap, yaitu. untuk waktu yang lama. Dalam praktiknya, seperti disebutkan di atas, luas diukur dengan nilai m yang sesuai 0,001i0 (0,1% dari i0). b) Perhitungan nilai Q berdasarkan ketergantungan In / pada m Sesuai dengan yang kita peroleh: Q = 0∞i0e-k τ D τ =i00∞e-k τ D τ =i0k Karena ∞i0e-k τ D τ = - k-1 e-k∞-e-k0= k-10-1=k-1 Penerapan koulometri langsung. Metode ini memiliki selektivitas tinggi, sensitivitas (hingga 10~8-10~9 g atau hingga ~10~5 mol/l), reproduktifitas (hingga ~1-2%), dan memungkinkan penentuan kandungan pengotor mikro. Kerugian dari metode ini termasuk intensitas tenaga kerja dan durasi analisis yang tinggi, serta kebutuhan peralatan yang mahal. Koulometri langsung dapat digunakan untuk menentukan - selama reduksi katodik - ion logam, turunan nitro dan halogen organik; selama oksidasi anodik - anion klorida, bromida, iodida, tiosianat, ion logam dengan bilangan oksidasi lebih rendah jika diubah ke bilangan oksidasi lebih tinggi, contoh: As(IH) -> As(V),Cr(II) -> Cr(III ), Fe(II) -» Fe(III), T1(I) -> Tl(III), dst. Dalam analisis farmasi, koulometri langsung digunakan untuk menentukan asam askorbat dan pikrat, novokain, hidroksikuinolin, dan dalam beberapa kasus lainnya. Seperti disebutkan di atas, koulometri langsung cukup memakan waktu dan tenaga kerja. Selain itu, dalam beberapa kasus, proses sampingan mulai terjadi bahkan sebelum selesainya reaksi elektrokimia utama, sehingga mengurangi efisiensi arus dan dapat menyebabkan kesalahan analisis yang signifikan. Oleh karena itu, koulometri tidak langsung - titrasi koulometri - lebih sering digunakan. 3 Titrasi koulometri Inti dari metode ini. Dalam titrasi koulometri, analit X, yang berada dalam larutan dalam sel elektrokimia, bereaksi dengan “titran” T, suatu zat yang terus menerus terbentuk (dihasilkan) pada elektroda generator selama elektrolisis zat tambahan yang juga terdapat dalam larutan. Akhir titrasi - momen ketika semua analit X telah bereaksi sempurna dengan "titran" T yang dihasilkan, dicatat baik secara visual dengan metode indikator, dengan memasukkan indikator yang sesuai ke dalam larutan yang berubah warna di dekat TE, atau menggunakan metode instrumental. - secara potensiometri, amperometri, fotometri. Jadi, dalam titrasi koulometri, titran tidak ditambahkan dari buret ke dalam larutan yang dititrasi. Peran titran dimainkan oleh zat T, yang terus menerus dihasilkan selama reaksi elektroda pada elektroda generator. Jelasnya, ada analogi antara titrasi konvensional, ketika titran dimasukkan dari luar ke dalam larutan yang dititrasi dan, ketika ditambahkan, bereaksi dengan analit, dan pembentukan zat T, yang ketika terbentuk, juga bereaksi. dengan analitnya. Oleh karena itu, metode yang dipertimbangkan disebut “titrasi koulometri”. Titrasi koulometri dilakukan dalam mode amerostatik (galvanostatik) atau potensiostatik. Lebih sering, titrasi koulometri dilakukan dalam mode amerostatik, menjaga arus listrik tetap konstan sepanjang waktu elektrolisis. Alih-alih volume titran yang ditambahkan, dalam titrasi koulometri, waktu t dan arus i elektrolisis diukur. Proses pembentukan zat T dalam sel koulometri selama elektrolisis disebut pembangkitan titran. Titrasi koulometri pada arus konstan. Selama titrasi koulometri dalam mode amerostatik (pada arus konstan), waktu t selama elektrolisis dilakukan diukur, dan jumlah listrik Q yang dikonsumsi selama elektrolisis dihitung menggunakan rumus, setelah itu massa analit X ditemukan oleh rasio. Misalnya, standarisasi larutan asam klorida HC1 dengan metode titrasi koulometri dilakukan dengan mentitrasi ion hidrogen H30+ dari larutan standar yang mengandung HC1, yang dihasilkan secara elektrik di katoda platina oleh ion hidroksida OH- selama elektrolisis. air: Н20 + 2е = 20Н- + Н2 Titran yang dihasilkan - ion hidroksida - bereaksi dengan ion H30+ dalam larutan: H30+ + OH- = 2H20 Titrasi dilakukan dengan adanya indikator fenolftalein dan dihentikan bila larutan tampak berwarna merah muda terang. Mengetahui besarnya arus searah i (dalam ampere) dan waktu t (dalam detik) yang dihabiskan untuk titrasi, dihitung banyaknya listrik Q (dalam coulomb) menggunakan rumus (28) dan massa (dalam gram) HC1 yang bereaksi terkandung dalam rumus (27) dalam aliquot larutan standar HC1 yang ditambahkan ke dalam sel koulometri (ke dalam bejana generator). Syarat titrasi koulometri. Dari penjelasan di atas dapat disimpulkan bahwa kondisi untuk melakukan titrasi koulometri harus menjamin efisiensi arus 100%. Untuk melakukan ini, Anda harus memenuhi setidaknya persyaratan berikut. a) Reagen tambahan yang menghasilkan titran pada elektroda kerja harus terdapat dalam larutan dalam jumlah berlebih yang besar dibandingkan dengan zat yang ditentukan (~ kelebihan 1000 kali lipat). Dalam kondisi ini, reaksi elektrokimia samping biasanya dihilangkan, yang utamanya adalah oksidasi atau reduksi elektrolit latar belakang, misalnya ion hidrogen: Н+ + 2е = Н2 b) Nilai arus searah i=const selama elektrolisis harus lebih kecil dari nilai arus difusi reagen tambahan untuk menghindari reaksi yang melibatkan ion-ion elektrolit latar. c) Perlu ditentukan seakurat mungkin jumlah listrik yang dikonsumsi selama elektrolisis, yang memerlukan pencatatan awal dan akhir penghitungan waktu serta besarnya arus elektrolisis secara akurat. Titrasi koulometri pada potensial konstan. Mode potensiostatik lebih jarang digunakan dalam titrasi koulometri. Titrasi koulometri dalam mode potensiostatik dilakukan pada nilai potensial konstan yang sesuai dengan potensial pelepasan suatu zat pada elektroda kerja, misalnya selama reduksi katodik kation logam M "* pada elektroda kerja platina. Sebagai reaksi berlangsung, potensial tetap konstan sampai semua kation logam bereaksi, setelah itu potensial menurun tajam, karena tidak ada lagi kation logam penentu potensial dalam larutan. Penerapan titrasi koulometri. Dalam titrasi koulometri, semua jenis reaksi analisis titrimetri dapat digunakan: asam basa, redoks, pengendapan, reaksi kompleksasi. Jadi, sejumlah kecil asam dapat ditentukan dengan titrasi asam basa koulometri dengan ion OH- yang dihasilkan secara elektrogenerasi yang terbentuk selama elektrolisis air di katoda: Н20 + 2е = 20Н" + Н2 Basa juga dapat dititrasi dengan ion hidrogen H+ yang dihasilkan di anoda selama elektrolisis air: Н20-4е = 4Н+ + 02 Dengan titrasi koulometri redoks bromometri, dimungkinkan untuk menentukan senyawa arsenik(III), antimon(III), iodida, hidrazin, fenol dan zat organik lainnya. Brom, yang dihasilkan secara listrik di anoda, bertindak sebagai titran: VG -2e = Vg2 Titrasi koulometri presipitatif dapat menentukan ion halida dan senyawa organik yang mengandung sulfur melalui elektrogenerasi kation perak Ag+, kation seng Zn2+ dengan elektrogenerasi ion ferosianida, dll. Titrasi koulometri kompleksometri kation logam dapat dilakukan dengan anion EDTA yang dihasilkan secara elektro pada katoda kompleksonat merkuri(I). Titrasi koulometri memiliki akurasi tinggi, berbagai aplikasi dalam analisis kuantitatif, memungkinkan Anda menentukan sejumlah kecil zat, senyawa dengan resistansi rendah (karena bereaksi segera setelah pembentukannya), misalnya tembaga (1), perak (H) , timah (P), titanium(III), mangan(III), klorin, brom, dll. Keuntungan dari metode ini juga mencakup fakta bahwa penyiapan, standarisasi dan penyimpanan titran tidak diperlukan, karena titran terbentuk secara terus menerus selama elektrolisis dan segera dikonsumsi dalam reaksi dengan zat yang ditentukan. KESIMPULAN Metode analisis elektrokimia didasarkan pada proses yang terjadi pada elektroda atau ruang antarelektroda. Metode analisis elektrokimia adalah salah satu metode analisis fisikokimia tertua (beberapa dijelaskan pada akhir abad ke-19). Keuntungannya adalah akurasi tinggi dan kesederhanaan komparatif dari peralatan dan teknik analisis. Akurasi yang tinggi ditentukan oleh hukum yang sangat tepat yang digunakan dalam metode analisis elektrokimia, misalnya hukum Faraday. Kemudahan yang besar adalah mereka menggunakan pengaruh listrik, dan fakta bahwa hasil pengaruh (respon) tersebut kemudian diperoleh dalam bentuk sinyal listrik. Hal ini memastikan kecepatan dan akurasi pembacaan yang tinggi serta membuka kemungkinan luas untuk otomatisasi. Metode analisis elektrokimia dibedakan berdasarkan sensitivitas dan selektivitas yang baik, dalam beberapa kasus metode ini dapat diklasifikasikan sebagai mikroanalisis, karena terkadang kurang dari 1 ml larutan sudah cukup untuk analisis. Instrumen mereka adalah sel elektrokimia, yaitu bejana berisi larutan elektrolit yang di dalamnya setidaknya dua elektroda direndam. Tergantung pada masalah yang dipecahkan, bentuk dan bahan bejana, jumlah dan sifat elektroda, larutan, dan kondisi analisis (tegangan (arus) yang diberikan dan sinyal analitik yang direkam, suhu, pengadukan, pembersihan dengan gas inert, dll. ) bisa beragam. Zat yang ditentukan dapat menjadi bagian dari elektrolit yang mengisi sel dan salah satu elektroda. Metode analisis elektrokimia memainkan peran penting di dunia modern. Saat ini, menjaga lingkungan sangatlah penting. Dengan menggunakan metode ini, dimungkinkan untuk menentukan kandungan sejumlah besar zat organik dan anorganik yang berbeda. Mereka sekarang lebih efektif dalam mengidentifikasi zat berbahaya.
Mengirimkan karya bagus Anda ke basis pengetahuan itu sederhana. Gunakan formulir di bawah ini
Pelajar, mahasiswa pascasarjana, ilmuwan muda yang menggunakan basis pengetahuan dalam studi dan pekerjaan mereka akan sangat berterima kasih kepada Anda.
Diposting pada http://www.allbest.ru
Kementerian Pendidikan dan Ilmu Pengetahuan Federasi Rusia
Institusi Pendidikan Anggaran Negara Federal
pendidikan yang lebih tinggi
"Universitas Teknik Riset Nasional Irkutsk"
Departemen Metalurgi Logam Non-Ferrous
(nama departemen)
"Metode penelitian elektrokimia"
Abstrak tentang disiplin
“Metode fisika-kimia untuk mempelajari proses metalurgi”
Diselesaikan oleh siswa dari kelompok MCM-16-1
Zakharenkov R.I.
Diperiksa oleh guru departemen MCM
Kuzmina M.Yu.
Irkutsk 2017
PERKENALAN
Elektrokimia adalah cabang kimia fisik yang membahas sistem yang mengandung ion (larutan atau lelehan elektrolit) dan proses yang terjadi pada batas dua fase dengan partisipasi partikel bermuatan.
Gagasan pertama tentang hubungan antara fenomena kimia dan listrik diketahui pada abad ke-18, karena sejumlah besar eksperimen fisika dan kimia dilakukan dengan pelepasan listrik dan petir, dengan muatan yang terletak di toples Leyden, tetapi semuanya terjadi secara acak. alam karena kurangnya sumber energi listrik yang kuat dan konstan. Asal usul elektrokimia dikaitkan dengan nama L. Galvani dan A. Volta. Saat mempelajari fungsi fisiologis katak, Galvani secara tidak sengaja membuat sirkuit elektrokimia. Itu terdiri dari dua logam berbeda dan kaki katak yang sudah disiapkan. Cakar merupakan elektrolit sekaligus indikator arus listrik, namun kesimpulan yang diberikan salah, yaitu menurut Galvani, arus listrik yang timbul pada rangkaian tersebut berasal dari hewan, yaitu dikaitkan dengan sifat fungsional dari tersebut. tubuh katak (teori “listrik hewan”).
Penafsiran yang benar atas eksperimen Galvani diberikan oleh A. Volta. Dia menciptakan baterai sel galvanik pertama - kolom volta. Sel baterai terdiri dari cakram tembaga dan seng, dan elektrolitnya berupa bahan spons yang direndam dalam air garam atau asam. Hubungan inilah yang memungkinkan diperolehnya arus listrik. Segera, melalui karya ilmuwan besar A. Volta, J. Daniel, B. S. Jacobi, P. R. Bagration, G. Plante dan lainnya, sel dan baterai galvanik yang kuat, mudah digunakan, muncul. Kemudian A. Volta mengembangkan rangkaian tegangan logam. Jika dua logam berbeda dikontakkan lalu dipisahkan, kemudian dengan menggunakan alat fisis, misalnya elektroskop, terlihat bahwa logam yang satu bermuatan positif dan logam lainnya bermuatan negatif. Deret logam ini, yang masing-masing logam sebelumnya bermuatan positif, tetapi setelah bersentuhan dengan deret berikutnya, yaitu deret Volta, ternyata serupa dengan deret tegangan.
Selanjutnya, pada awal abad ke-19, elektrolisis dikembangkan, dan M. Faraday menetapkan hukum kuantitatif elektrolisis. Para ilmuwan memberikan kontribusi besar terhadap perkembangan elektrokimia: S. A. Arrhenius, V. F. Ostwald, R. A. Colley, P. Debye, W. Nernst, G. Helmholtz, dll. Sekarang elektrokimia dibagi menjadi teoritis dan terapan. Melalui penggunaan metode elektrokimia, ia dihubungkan dengan cabang kimia fisik lainnya, serta kimia analitik dan ilmu-ilmu lainnya.
potensiometri elektrokimia konduktometri koulometri
1 . METODE PENELITIAN ELEKTROKIMIA
Kebutuhan untuk menggunakan berbagai metode untuk mempelajari proses elektrokimia disebabkan oleh banyaknya variasi laju transfer elektron dalam reaksi elektroda. Masing-masing metode memiliki batasan tertentu pada nilai kerapatan arus pertukaran yang ditentukan, di atasnya parameter elektrokimia dari reaksi elektroda tidak dapat ditentukan. Sehubungan dengan setiap objek tertentu, perlu untuk memilih metode yang memberikan jumlah informasi yang dapat dipercaya sebanyak mungkin. Dalam melakukan studi elektrokimia perlu diketahui komposisi kimia bahan awal dan produk reaksi. Untuk menentukan komposisi elektrolit digunakan berbagai metode fisika dan kimia: spektrofotometri, potensiometri, analitik dan lain-lain. Saat melakukan studi elektrokimia, kondisi berikut harus diperhatikan.
1. Kemurnian maksimum reagen yang digunakan; komposisi elektroda harus diketahui secara ketat, begitu pula kondisi permukaannya. Perhatian harus diberikan untuk memastikan bahwa permukaan elektroda tidak mengalami perubahan selama proses pengukuran.
2. Desain sel elektrokimia dan elektroda-elektroda yang terletak di dalamnya harus menjamin pemerataan arus ke seluruh permukaan elektroda kerja.
3. Pengukuran harus dilakukan pada suhu yang dikontrol secara ketat.
4. Pertahankan tekanan dan komposisi fasa gas yang konstan di atas elektrolit. Biasanya, penelitian dilakukan dalam lingkungan gas inert (N 2, Ar, Ne, He H 2), karena oksigen dalam fase gas dapat mempunyai pengaruh yang signifikan terhadap mekanisme proses.
5. Penting untuk memastikan kondisi eksperimental di mana potensi penurunan pada bagian difusi lapisan ganda listrik akan minimal atau diketahui secara tepat. Untuk mengurangi potensi ini, biasanya digunakan elektrolit latar belakang, yang konsentrasinya tidak boleh kurang dari 20 kali lebih tinggi dari zat utama. Namun, pertama-tama Anda harus memastikan bahwa elektrolit latar belakang tidak merusak kurva polarisasi reaksi yang sedang dipelajari.
6. Pengukuran potensial elektroda kerja yang akurat. Untuk melakukan ini, perlu untuk menghilangkan potensi difusi antara elektrolit yang diteliti dan elektrolit elektroda referensi. Potensi ini mencapai nilai maksimumnya ketika mendekati arus pembatas dan dapat mendistorsi hasil pengukuran secara signifikan. Untuk menghilangkan potensial difusi antara elektrolit yang diteliti dengan elektrolit elektroda acuan, sebaiknya: a) memilih elektroda acuan yang mempunyai komposisi elektrolit yang sama dengan yang diteliti. Misalnya, ketika meneliti larutan klorida, akan lebih mudah untuk menggunakan elektroda perak klorida, kalomel, dan klorin; dalam larutan asam sulfat - elektroda merkuri-sulfat, dll.; b) menggunakan elektroda referensi dengan elektrolit yang batasnya dengan elektrolit yang diteliti, potensial difusi dapat dihitung menggunakan rumus yang diketahui.
Saat mengukur dalam larutan dengan kekuatan ionik konstan, dan pada konsentrasi latar belakang yang tinggi - dengan konsentrasi ionik konstan, pada prinsipnya Anda dapat menggunakan elektroda referensi apa pun. Potensi difusi dalam hal ini bisa sangat besar, tetapi juga konstan - dapat dihitung atau ditentukan secara eksperimental.
Dalam semua kasus mempelajari kinetika proses elektrokimia, perlu dilakukan pengukuran kerapatan arus. Biasanya mereka memulai dengan mencari tahu menggunakan metode kimia analitik dan koulometri untuk menentukan apakah hanya satu reaksi yang diteliti terjadi pada elektroda atau diperumit oleh reaksi samping. Dalam kasus reaksi samping, perlu untuk mengetahui berapa proporsi arus yang hanya disebabkan oleh pelaksanaan reaksi yang dipelajari (buatlah apa yang disebut karakteristik polarisasi parsial untuk reaksi yang dipelajari).
Mekanisme reaksi elektroda dapat diinterpretasikan secara sederhana hanya jika zat awal diubah menjadi satu produk dengan efisiensi arus 100%. Memeriksa kepatuhan reaksi terhadap hukum Faraday atau melakukan pengukuran koulometri memungkinkan Anda secara bersamaan menentukan jumlah elektron yang berpartisipasi dalam reaksi elektroda total. Mengetahui komposisi zat awal dan produk reaksi, serta jumlah total elektron yang ditransfer, memungkinkan untuk menuliskan persamaan reaksi elektroda total.
Langkah selanjutnya dalam mempelajari mekanisme reaksi elektroda adalah mencari tahu tahap mana yang membatasi.
Jika tahap pembatasnya adalah tahap ionisasi pelepasan, dan tahap lainnya berlangsung secara reversibel, maka parameter kinetik utama dari proses tersebut dapat ditentukan secara grafis atau analitis dengan menerapkan persamaan teori pelepasan lambat pada karakteristik polarisasi.
1.1 Metode analisis elektrokimia
Metode elektrokimiaanalisis adalah seperangkat metode analisis kualitatif dan kuantitatif berdasarkan fenomena elektrokimia yang terjadi pada media yang diteliti atau pada antarmuka dan berhubungan dengan perubahan struktur, komposisi kimia atau konsentrasi zat yang dianalisis.
Ada metode elektrokimia langsung dan tidak langsung. Metode langsung menggunakan ketergantungan kekuatan arus (potensial, dll) pada konsentrasi komponen yang ditentukan. Dalam metode tidak langsung, kekuatan arus (potensial, dll.) diukur untuk menemukan titik akhir titrasi analit dengan titran yang sesuai, yaitu. Ketergantungan parameter yang diukur pada volume titran yang digunakan.
Untuk segala jenis pengukuran elektrokimia, diperlukan sirkuit elektrokimia atau sel elektrokimia, yang mana larutan yang dianalisis merupakan bagian integralnya.
Metode elektrokimia diklasifikasikan berdasarkan jenis fenomena yang diukur selama proses analisis. Ada dua kelompok metode elektrokimia:
1. Metode tanpa pengenaan potensial asing, didasarkan pada pengukuran beda potensial yang terjadi pada sel elektrokimia yang terdiri dari elektroda dan bejana berisi larutan uji. Kelompok metode ini disebut potensiometri. Metode potensiometri menggunakan ketergantungan potensial kesetimbangan elektroda pada konsentrasi ion yang berpartisipasi dalam reaksi elektrokimia pada elektroda.
2. Metode dengan pembebanan potensi asing, berdasarkan pengukuran:
a) Konduktivitas listrik larutan? konduktometri;
b) Banyaknya listrik yang melewati larutan? koulometri;
c) Ketergantungan arus pada potensial yang diterapkan? volt-amperometri;
d) Waktu yang diperlukan untuk terjadinya reaksi elektrokimia - metode kronoelektrokimia(kronovoltametri, kronokonduktometri).
Dalam metode kelompok ini, potensial asing diterapkan pada elektroda sel elektrokimia.
Elemen utama instrumen analisis elektrokimia adalah sel elektrokimia. Dalam metode tanpa memaksakan potensi asing, memang demikian sel galvanik, di mana arus listrik terjadi karena reaksi redoks kimia. Dalam sel seperti sel galvanik, dua elektroda bersentuhan dengan larutan yang dianalisis - elektroda indikator, yang potensialnya bergantung pada konsentrasi zat, dan elektroda dengan potensial konstan - elektroda referensi, yang terhadapnya potensial elektroda indikator diukur. Beda potensial diukur menggunakan perangkat khusus - potensiometer.
Dalam metode dengan pemaksaan potensi asing, sel elektrokimia, dinamakan demikian karena pada elektroda sel, di bawah pengaruh potensial yang diterapkan, terjadi elektrolisis - oksidasi atau reduksi suatu zat. Dalam analisis konduktometri, sel konduktometri digunakan untuk mengukur konduktivitas listrik suatu larutan. Menurut cara penerapannya, metode elektrokimia dapat diklasifikasikan menjadi metode langsung, di mana konsentrasi zat diukur sesuai dengan pembacaan alat, dan titrasi elektrokimia, di mana indikasi titik ekivalen dicatat dengan menggunakan pengukuran elektrokimia. Sesuai dengan klasifikasi ini, bedakan potensiometri dan titrasi potensiometri, konduktometri dan titrasi konduktometri, dll.
Instrumen penentuan elektrokimia, selain sel elektrokimia, pengaduk, dan hambatan beban, juga mencakup alat untuk mengukur beda potensial, arus, hambatan larutan, dan besaran listrik. Pengukuran ini dapat dilakukan dengan instrumen penunjuk (voltmeter atau mikroammeter), osiloskop, dan potensiometer perekam otomatis. Jika sinyal listrik dari sel sangat lemah, maka diperkuat dengan menggunakan penguat radio. Dalam perangkat metode dengan pengenaan potensial asing, bagian penting adalah perangkat untuk memasok sel dengan potensi arus searah atau bolak-balik yang stabil (tergantung pada jenis metode). Unit catu daya untuk perangkat analisis elektrokimia biasanya mencakup penyearah dan penstabil tegangan, yang memastikan pengoperasian perangkat secara konstan.
1.2 Potensiometri
Potensiometri didasarkan pada pengukuran beda potensial listrik yang timbul antara elektroda-elektroda yang berbeda yang direndam dalam suatu larutan dengan zat yang ditentukan. Potensi listrik timbul pada elektroda ketika terjadi reaksi redoks (elektrokimia). Reaksi redoks terjadi antara zat pengoksidasi dan zat pereduksi dengan pembentukan pasangan redoks, potensial E ditentukan oleh persamaan Nernst dengan konsentrasi komponen pasangan [ok] dan [rec]:
Di mana E°- potensial elektroda standar, V;
N- jumlah elektron yang berpartisipasi dalam proses.
Pengukuran potensiometri dilakukan dengan menurunkan dua elektroda ke dalam larutan - elektroda indikator, yang bereaksi terhadap konsentrasi ion yang ditentukan, dan elektroda standar atau referensi, yang digunakan untuk mengukur potensi indikator. Beberapa jenis indikator dan elektroda standar digunakan.
Elektroda jenis pertama reversibel terhadap ion logam yang membentuk elektroda. Ketika elektroda tersebut diturunkan ke dalam larutan yang mengandung kation logam, pasangan elektroda terbentuk: M N + /M.
Elektroda jenis kedua sensitif terhadap anion dan merupakan logam M yang dilapisi dengan lapisan garam MA yang tidak larut dengan anion A- yang elektrodanya sensitif. Ketika elektroda tersebut bersentuhan dengan larutan yang mengandung anion tertentu A-, timbul potensial E yang besarnya bergantung pada hasil kali kelarutan garam
DLL MA. dan konsentrasi anion [ A-] dalam solusi.
Elektroda tipe kedua adalah perak klorida dan kalomel. Elektroda perak klorida dan kalomel jenuh mempertahankan potensial konstan dan digunakan sebagai elektroda referensi untuk mengukur potensial elektroda indikator.
Elektroda inert- pelat atau kawat yang terbuat dari logam yang sulit teroksidasi - platinum, emas, paladium. Mereka digunakan untuk mengukur E dalam larutan yang mengandung pasangan redoks (misalnya, Fe 3+ /Fe 2+).
Elektroda membran jenis yang berbeda memiliki membran di mana timbul potensial membran E. Nilai E bergantung pada perbedaan konsentrasi ion yang sama pada sisi membran yang berbeda. Elektroda membran yang paling sederhana dan umum digunakan adalah elektroda kaca.
Mencampur jenis garam yang tidak larut AgBr, AgCl, AgI dan lainnya dengan beberapa plastik (karet, polietilen, polistiren) mengarah pada penciptaan elektroda selektif ion pada Sdr-, Kl-, SAYA-, secara selektif mengadsorpsi ion-ion tertentu dari larutan karena aturan Paneth - Faience - Hahn. Karena konsentrasi ion yang terdeteksi di luar elektroda berbeda dengan konsentrasi di dalam elektroda, kesetimbangan pada permukaan membran berbeda, yang menyebabkan munculnya potensial membran.
Untuk melakukan penentuan potensiometri, sel elektrokimia dirakit dari elektroda referensi indikator, yang direndam dalam larutan yang dianalisis dan dihubungkan ke potensiometer. Elektroda yang digunakan dalam potensiometri memiliki resistansi internal yang tinggi (500-1000 MOhm), sehingga ada jenis potensiometer yang merupakan voltmeter elektronik kompleks dengan resistansi tinggi. Untuk mengukur EMF sistem elektroda pada potensiometer, digunakan rangkaian kompensasi untuk mengurangi arus pada rangkaian sel.
Paling sering, potensiometer digunakan untuk pengukuran langsung pH, indikator konsentrasi ion lain pNa, pK, pNH?, pCl dan mV. Pengukuran dilakukan dengan menggunakan elektroda selektif ion yang sesuai.
Untuk mengukur pH, elektroda kaca dan elektroda referensi - perak klorida - digunakan. Sebelum melakukan analisis, perlu dilakukan pengecekan kalibrasi pH meter menggunakan larutan buffer standar yang fiksasinya dipasang pada alat.
pH meter selain penentuan langsung pH, pNa, pK, pNH?, pCl dan lainnya memungkinkan titrasi potensiometri ion yang ditentukan.
1.3 Titrasi potensiometri
Titrasi potensiometri dilakukan bila indikator kimia tidak dapat digunakan atau indikator yang sesuai tidak tersedia.
Dalam titrasi potensiometri, elektroda potensiometer yang ditempatkan dalam larutan titrasi digunakan sebagai indikator. Dalam hal ini, elektroda yang digunakan sensitif terhadap ion yang dititrasi. Selama proses titrasi terjadi perubahan konsentrasi ion yang dicatat pada skala pengukuran potensiometer. Setelah mencatat pembacaan potensiometer dalam satuan pH atau mV, plot ketergantungannya pada volume titran (kurva titrasi), tentukan titik ekuivalen dan volume titran yang dikonsumsi untuk titrasi. Berdasarkan data yang diperoleh, dibuat kurva titrasi potensiometri.
Kurva titrasi potensiometri memiliki bentuk yang mirip dengan kurva titrasi pada analisis titrimetri. Kurva titrasi digunakan untuk menentukan titik ekivalen yang terletak di tengah lompatan titrasi. Untuk melakukan ini, garis singgung ditarik ke bagian kurva titrasi dan titik ekivalen ditentukan di tengah garis singgung lompatan titrasi. Nilai perubahan terbesar ? pH/?V diperoleh pada titik kesetaraan.
Titik ekivalen dapat ditentukan lebih akurat lagi dengan metode Gran, yang digunakan untuk membangun ketergantungan ? VE dari volume titran. Dengan menggunakan metode Gran, titrasi potensiometri dapat dilakukan tanpa membawanya ke titik ekuivalen.
Titrasi potensiometri digunakan dalam semua kasus analisis titrimetri.
Titrasi asam basa menggunakan elektroda kaca dan elektroda referensi. Karena elektroda kaca sensitif terhadap perubahan pH medium, ketika dititrasi, perubahan pH medium dicatat pada potensiometer. Titrasi potensiometri asam basa berhasil digunakan dalam titrasi asam dan basa lemah (pK?8). Saat mentitrasi campuran asam, pK-nya harus berbeda lebih dari 4 satuan, jika tidak, sebagian asam lemah akan dititrasi bersama dengan asam kuat, dan lompatan titrasi tidak dinyatakan dengan jelas.
Hal ini memungkinkan penggunaan potensiometri untuk membuat kurva titrasi eksperimental, memilih indikator untuk titrasi, dan menentukan konstanta keasaman dan kebasaan.
Dalam titrasi potensiometri pengendapan, elektroda yang terbuat dari logam yang membentuk pasangan elektroda dengan ion yang ditentukan digunakan sebagai indikator.
Ketika titrasi kompleksometri digunakan: a) elektroda logam yang dapat dibalik terhadap ion logam yang ditentukan; b) elektroda platina dengan adanya pasangan redoks dalam larutan. Ketika salah satu komponen pasangan redoks diikat oleh titran, konsentrasinya berubah, yang menyebabkan perubahan potensial elektroda platina indikator. Titrasi balik dari larutan EDTA berlebih yang ditambahkan ke garam logam dengan larutan garam besi (III) juga digunakan.
Untuk titrasi redoks, digunakan elektroda referensi dan elektroda indikator platinum, yang sensitif terhadap pasangan redoks.
Titrasi potensiometri adalah salah satu metode analisis instrumental yang paling banyak digunakan karena kesederhanaan, aksesibilitas, selektivitas, dan kemampuannya yang luas.
1.4 Konduktometri. Titrasi konduktometri
Konduktometri didasarkan pada pengukuran konduktivitas listrik suatu larutan. Jika dua elektroda ditempatkan dalam larutan suatu zat dan beda potensial diterapkan pada elektroda, arus listrik akan mengalir melalui larutan. Seperti setiap konduktor listrik, larutan mempunyai ciri hambatan R dan kuantitas kebalikannya - konduktivitas listrik L:
Di mana R- resistensi, Ohm;
Resistensi spesifik, Ohm. cm;
S - luas permukaan, cm 2.
Di mana L - konduktivitas listrik, Ohm-1;
R- resistensi, Ohm.
Analisis konduktometri dilakukan dengan menggunakan konduktometer - alat yang mengukur resistansi larutan. Berdasarkan nilai resistansi R tentukan konduktivitas listrik larutan yang merupakan nilai kebalikannya L.
Konsentrasi larutan ditentukan dengan konduktometri langsung dan titrasi konduktometri. Konduktometri langsung digunakan untuk menentukan konsentrasi suatu larutan menggunakan grafik kalibrasi. Untuk membuat grafik kalibrasi, konduktivitas listrik dari serangkaian larutan dengan konsentrasi yang diketahui diukur dan grafik kalibrasi konduktivitas listrik versus konsentrasi dibuat. Kemudian konduktivitas listrik larutan yang dianalisis diukur dan konsentrasinya ditentukan dari grafik.
Lebih sering digunakan titrasi konduktometri. Dalam hal ini, larutan yang dianalisis ditempatkan dalam sel dengan elektroda, sel ditempatkan pada pengaduk magnet dan dititrasi dengan titran yang sesuai. Titran ditambahkan dalam porsi yang sama. Setelah menambahkan setiap porsi titran, ukur konduktivitas listrik larutan dan gambarkan hubungan antara konduktivitas listrik dan volume titran. Ketika titran ditambahkan, terjadi perubahan konduktivitas listrik larutan. kurva titrasi berubah.
Dari n mobilitas ion bergantung pada listrik konduktivitas larutan: semakin tinggi mobilitasnya b ion, semakin besar listriknya konduktivitas larutan.
Titrasi konduktometri mempunyai beberapa keunggulan. Hal ini dapat dilakukan di lingkungan yang keruh dan berwarna, tanpa adanya indikator kimia. Metode ini memiliki sensitivitas yang meningkat dan memungkinkan Anda menganalisis larutan encer suatu zat (hingga 10-4 mol/dmі). Campuran zat dianalisis dengan titrasi konduktometri, karena perbedaan mobilitas berbagai ion sangat signifikan dan dapat dititrasi secara berbeda dengan adanya satu sama lain.
Analisis konduktometri dapat dengan mudah diotomatisasi jika larutan titran disuplai dari buret dengan kecepatan konstan, dan perubahan konduktivitas listrik larutan dicatat pada alat perekam.
Konduktometri jenis ini disebut krono- analisis konduktometri.
Dalam titrasi asam basa, asam kuat, asam lemah, garam basa lemah, dan asam kuat dapat ditentukan dengan konduktometri.
DI DALAM bersifat presipitatif konduktometrititrasi konduktivitas listrik larutan yang dititrasi mula-mula berkurang atau tetap pada tingkat konstan tertentu karena pengikatan elektrolit yang dititrasi menjadi endapan, setelah itu yaitu ketika kelebihan titran muncul, itu meningkat lagi.
DI DALAM komplekstitrasi konduktometri metrik perubahan daya hantar listrik larutan terjadi akibat pengikatan kation logam menjadi kompleks dengan EDTA.
Konduktometri redokstitro- tion berdasarkan perubahan konsentrasi ion-ion yang bereaksi dan munculnya ion-ion baru dalam larutan, yang mengubah konduktivitas listrik larutan.
Beberapa tahun terakhir telah terjadi perkembangan konduktometri frekuensi tinggi, di mana elektroda tidak bersentuhan dengan larutan, yang penting saat menganalisis media agresif dan larutan dalam bejana tertutup.
Dua opsi telah dikembangkan - luruskonduktometri frekuensi tinggi dan titrasi frekuensi tinggi.
Konduktometri frekuensi tinggi langsung digunakan untuk menentukan kadar air zat, biji-bijian, kayu, konsentrasi larutan dalam wadah tertutup - ampul, dan saat menganalisis cairan agresif.
Titrasi frekuensi tinggi dilakukan pada titrator khusus - TV-6, TV-6L.
Titrasi konduktometri frekuensi tinggi dilakukan sebagai titrasi asam-basa, redoks, atau presipitasi jika indikator yang sesuai tidak tersedia atau ketika menganalisis campuran zat.
1.5 Koulometri. Titrasi koulometri
Dalam koulometri, suatu zat ditentukan dengan mengukur jumlah listrik yang dihabiskan untuk transformasi elektrokimia kuantitatifnya. Analisis koulometri dilakukan dalam sel elektrolitik di mana larutan zat yang ditentukan ditempatkan. Ketika potensial yang sesuai diterapkan pada elektroda sel, terjadi reduksi elektrokimia atau oksidasi zat. Menurut hukum elektrolisis yang ditemukan oleh Faraday, jumlah zat yang bereaksi pada elektroda sebanding dengan jumlah listrik yang melewati larutan:
Di mana G- massa zat yang dilepaskan, g;
N- jumlah elektron yang ditransfer dalam proses elektroda;
F- Bilangan Faraday (F = 96485 C/mol);
SAYA- kekuatan saat ini, A;
T- waktu;
M- massa molar zat yang dilepaskan, g/mol.
Analisis koulometri memungkinkan untuk menentukan zat yang tidak mengendap pada elektroda atau terlepas ke atmosfer selama reaksi elektrokimia.
Ada koulometri langsung dan titrasi koulometri.. Akurasi dan sensitivitas tinggi dari metode pengukuran arus listrik memberikan analisis koulometri dengan akurasi unik 0,1-0,001%, dan sensitivitas hingga 1 10 -8? 1 10 -10 g Oleh karena itu, analisis koulometri digunakan untuk menentukan pengotor mikro dan produk penghancuran suatu zat, yang penting ketika memantau kualitasnya.
Untuk menunjukkan yaitu. Ketika titrasi koulometri, metode kimia dan instrumental dapat digunakan - menambahkan indikator, mendeteksi senyawa berwarna secara fotometrik atau spektrofotometri.
Tidak seperti metode analisis lainnya, koulometri dapat diotomatisasi sepenuhnya, sehingga meminimalkan kesalahan penentuan acak. Fitur ini digunakan untuk membuat titrator koulometri otomatis - instrumen sensitif yang digunakan untuk analisis yang sangat akurat ketika metode lain tidak cukup sensitif. Saat menganalisis zat yang sukar larut dalam air, koulometri dapat dilakukan pada elektroda yang terbuat dari asetilen hitam, yang merupakan adsorben yang baik dan menghilangkan zat tersebut dari media reaksi dengan cukup lengkap. Titrasi koulometri adalah metode analisis instrumental yang menjanjikan. Hal ini dapat diterapkan secara luas untuk memecahkan sejumlah masalah analitis khusus - analisis pengotor, sejumlah kecil obat, penentuan zat beracun, elemen jejak dan senyawa lain dalam bahan biologis dan lingkungan.
KESIMPULAN
Makalah ini memberikan tinjauan tentang metode penelitian elektrokimia utama, menjelaskan secara rinci prinsip, penerapan, kelebihan dan kekurangannya.
Metode analisis elektrokimia adalah sekelompok metode analisis kimia kuantitatif berdasarkan penggunaan elektrolisis.
Macam-macam metodenya adalah analisis elektrogravimetri (elektroanalisis), elektrolisis internal, pertukaran kontak logam (sementasi), analisis polarografi, koulometri, dll. Secara khusus, analisis elektrogravimetri didasarkan pada penimbangan zat yang dilepaskan pada salah satu elektroda. Metode ini memungkinkan tidak hanya untuk melakukan penentuan kuantitatif tembaga, nikel, timbal, dll., tetapi juga untuk memisahkan campuran zat.
Selain itu, metode analisis elektrokimia mencakup metode yang didasarkan pada pengukuran konduktivitas listrik (konduktometri) atau potensial elektroda (potensiometri). Beberapa metode elektrokimia digunakan untuk mencari titik akhir titrasi (titrasi amperometri, titrasi konduktometri, titrasi potensiometri, titrasi koulometri).
DAFTAR REFERENSI YANG DIGUNAKAN
1. Dasar-dasar analisis elektrokimia modern. Budnikov G.K., Maistrenko V.N., Vyaselev M.R., M., Mir, 2003.
2. J. Plambeck, penyunting. S. G. Mayranovsky Metode analisis elektrokimia. Dasar-dasar teori dan aplikasi: trans. dari bahasa Inggris / Vidannya : Mir, 1985.
3. Damaskin B.B., Petriy O.A., Tsirlina G.A. Elektrokimia - M.: kimia, 2001. 624 hal.
4. STO 005-2015. Sistem Manajemen Mutu. Kegiatan pendidikan dan metodologis. Pendaftaran proyek kursus (pekerjaan) dan karya kualifikasi akhir spesialisasi teknis.
Diposting di Allbest.ru
...Dokumen serupa
Klasifikasi metode analisis elektrokimia, esensi voltametri, konduktometri, potensiometri, amperometri, koulometri, penerapannya dalam perlindungan lingkungan. Karakteristik peralatan analisis kimia dan perusahaan penjualan utama.
tugas kursus, ditambahkan 01/08/2010
Metode elektrokimia didasarkan pada pengukuran parameter listrik dari fenomena elektrokimia yang terjadi dalam larutan yang diteliti. Klasifikasi metode analisis elektrokimia. Titrasi potensiometri, konduktometri, koulometri.
abstrak, ditambahkan 01/07/2011
Klasifikasi metode analisis elektrokimia. Penentuan potensiometri konsentrasi suatu zat dalam suatu larutan. Prinsip konduktometri. Jenis reaksi selama titrasi konduktometri. Analisis polarografi kuantitatif. Koulometri langsung.
tugas kursus, ditambahkan 04/04/2013
Inti dari metode elektroanalitik, kemampuan memperoleh informasi eksperimental tentang kinetika dan termodinamika sistem kimia. Kelebihan, kekurangan dan kesesuaian voltametri, konduktometri, potensiometri, amperometri dan koulometri.
abstrak, ditambahkan 20/11/2009
Ciri-ciri umum analisis potensiometri. Elektroda indikator (pertukaran elektron dan selektif ion). Jenis metode analisis potensiometri. Potensiometri langsung dan titrasi potensiometri. Pengukuran EMF rangkaian elektrokimia.
tugas kursus, ditambahkan 06/08/2012
Konsep umum, kondisi dan klasifikasi metode analisis elektrokimia. Analisis potensiometri (potensiometri). Titrasi amperometri (titrasi polarisasi potensiometri). Analisis polarografi kuantitatif.
abstrak, ditambahkan 10/01/2012
Metode penelitian elektrokimia, klasifikasi dan esensinya, sejarah terjadinya. Penentuan konsentrasi asam dengan titrasi konduktometri; potensi elektroda, EMF sel galvanik, setara elektrokimia tembaga.
tugas kursus, ditambahkan 15/12/2014
Kajian metode analisis potensiometri. Analisis dan evaluasi objek penelitian. Kajian teknik analisis potensiometri yang diterapkan pada objek ini. Menentukan kemungkinan penggunaan metode analisis potensiometri produk daging.
tugas kursus, ditambahkan 16/09/2017
Metode analisis elektrokimia dasar. Ciri-ciri umum analisis potensiometri. Jenis metode analisis potensiometri. Penggunaan sel galvanik yang terdiri dari dua elektroda. Tata cara pengukuran potensial elektroda indikator.
tugas kursus, ditambahkan 11/08/2014
Klasifikasi metode analisis instrumental menurut parameter yang ditentukan dan metode pengukurannya. Inti dari titrasi potensiometri, amperometri, kromatografi dan fotometri. Penentuan kualitatif dan kuantitatif seng klorida.
Metode analisis elektrokimia adalah seperangkat metode analisis kualitatif dan kuantitatif berdasarkan fenomena elektrokimia yang terjadi pada media yang diteliti atau pada antarmuka dan berhubungan dengan perubahan struktur, komposisi kimia atau konsentrasi analit.
Metode analisis elektrokimia (ECMA) didasarkan pada proses yang terjadi pada elektroda atau ruang antarelektroda. Keunggulannya adalah akurasi tinggi dan kesederhanaan komparatif dari peralatan dan metode analisis. Akurasi yang tinggi ditentukan oleh pola yang sangat presisi yang digunakan dalam ECMA. Kemudahan yang besar adalah metode ini menggunakan pengaruh listrik, dan fakta bahwa hasil pengaruh (respon) tersebut juga diperoleh dalam bentuk sinyal listrik. Hal ini memastikan kecepatan dan keakuratan pembacaan yang tinggi, dan membuka kemungkinan luas untuk otomatisasi. ECMA dibedakan berdasarkan sensitivitas dan selektivitasnya yang baik, dalam beberapa kasus ECMA dapat diklasifikasikan sebagai mikroanalisis, karena terkadang kurang dari 1 ml larutan sudah cukup untuk analisis.
Menurut jenis sinyal analitisnya, mereka dibagi menjadi:
1) konduktometri - pengukuran konduktivitas listrik larutan uji;
2) potensiometri - pengukuran potensial kesetimbangan bebas arus dari elektroda indikator yang bahan ujinya menentukan potensinya;
3) koulometri - pengukuran jumlah listrik yang diperlukan untuk transformasi lengkap (oksidasi atau reduksi) zat yang diteliti;
4) voltametri - pengukuran karakteristik polarisasi elektroda stasioner atau non-stasioner dalam reaksi yang melibatkan zat uji;
5) elektrogravimetri - pengukuran massa suatu zat yang dilepaskan dari larutan selama elektrolisis.
27. Metode potensiometri.
potensiometri - pengukuran potensial kesetimbangan bebas arus dari elektroda indikator, yang zat ujinya menentukan potensiasi.
A) standar (elektroda referensi) - memiliki potensi konstan, tidak tergantung pada pengaruh eksternal. Ketentuan
B) elektroda individu - potensinya tergantung pada konsentrasi zat.
Potensial bergantung pada konsentrasi: E = f(c)
Persamaan Nerist E= E° + lna kucing
E° - standar. Elektron. Potensi (konstanta)
R- Universitas. Konstanta gaskonstanta)
T – suhu absolut (T)- +273 °
.п – jumlah elektron yang terlibat. Dalam oksidasi/reduksi Reaksi
. a – konsentrasi aktif
Metode potensiometri
Potensiometri ionometri (larutan kecil ditambahkan ke dalam larutan penelitian. Larutan standar (titran) ditambahkan sedikit demi sedikit, setiap penambahan diukur potensialnya. - E)
Titik kesetaraan
EСх Vх = aku t *Vt
28. Metode konduktometri.
konduktometri - pengukuran konduktivitas listrik larutan uji.
Titrasi konduktometri
Konduktometer (perangkat)
Analisis konduktometri (konduktometri) didasarkan pada penggunaan hubungan antara konduktivitas listrik (konduktivitas listrik) larutan elektrolit dan konsentrasinya.
Konduktivitas listrik larutan elektrolit - konduktor tipe kedua - dinilai berdasarkan pengukuran hambatan listriknya dalam sel elektrokimia, yang merupakan bejana kaca (kaca) dengan dua elektroda yang disolder ke dalamnya, di antaranya larutan elektrolit uji berada. terletak. Arus listrik bolak-balik dialirkan melalui sel. Elektroda paling sering dibuat dari logam platina, yang, untuk menambah permukaan elektroda, dilapisi dengan lapisan platina spons dengan pengendapan elektrokimia senyawa platina dari larutan (elektroda platina berlapis).
29.Polarografi.
Polarografi adalah metode analisis kimia kualitatif dan kuantitatif yang didasarkan pada perolehan kurva arus versus tegangan dalam suatu rangkaian yang terdiri dari larutan yang diteliti dan elektroda-elektroda yang direndam di dalamnya, salah satunya sangat terpolarisasi dan yang lainnya praktis tidak terpolarisasi. Kurva seperti itu - polarogram - diperoleh dengan menggunakan polarograf.
Metode polarografi ditandai dengan sensitivitas yang tinggi. Untuk melakukan analisis, biasanya cukup 3-5 ml larutan uji. Analisis menggunakan polarograf auto-recording hanya berlangsung sekitar 10 menit. Polarografi digunakan untuk mengetahui kandungan zat beracun pada benda asal biologis (misalnya senyawa merkuri, timbal, talium, dll), untuk menentukan derajat saturasi oksigen dalam darah, untuk mempelajari komposisi udara yang dihembuskan, dan zat berbahaya di udara perusahaan industri Metode analisis polarografi sangat sensitif dan memungkinkan untuk menentukan zat pada konsentrasi yang sangat rendah (hingga 0,0001%) dalam larutan.
30. Klasifikasi metode analisis spektral. Konsep spektrum.
Analisis spektral adalah seperangkat metode untuk menentukan kualitas dan kuantitas. Komposisi, serta struktur materi (berdasarkan interaksi objek penelitian dengan berbagai jenis radiasi.)
Semua metode spektroskopi didasarkan pada interaksi atom, molekul atau ion yang menyusun zat yang dianalisis dengan radiasi elektromagnetik. Interaksi ini diwujudkan dalam penyerapan atau emisi foton (kuanta). Tergantung pada sifat interaksi sampel dengan radiasi elektromagnetik, dua kelompok metode dibedakan:
Emisi dan penyerapan. Tergantung pada partikel mana yang membentuk sinyal analitik, perbedaan dibuat antara metode spektroskopi atom dan metode spektroskopi molekuler
Emisi
Dalam metode emisi, sampel yang dianalisis memancarkan foton sebagai akibat eksitasinya.
penyerapan
Dalam metode penyerapan, radiasi dari sumber eksternal dilewatkan melalui sampel, dan beberapa kuanta diserap secara selektif oleh atom atau molekul.
Jangkauan- distribusi nilai suatu besaran fisis (biasanya energi, frekuensi atau massa). Representasi grafis dari distribusi semacam itu disebut diagram spektral. Biasanya, spektrum mengacu pada spektrum elektromagnetik - spektrum frekuensi (atau sama dengan energi kuantum) radiasi elektromagnetik.
1.pantulan cahaya
2.perputaran berkas cahaya (defraksi)
3.hamburan cahaya: nefelometri, turbidimetri
4. penyerapan cahaya
5re-emisi
A) pendar (berlangsung lama)
B) fluoresensi (sangat singkat)
Menurut sifat sebaran nilai besaran fisika, spektrum dapat berupa diskrit (garis), kontinu (padat), dan juga merupakan kombinasi (superposisi) spektrum diskrit dan kontinu.
Contoh spektrum garis meliputi spektrum massa dan spektrum transisi elektron terikat-ikatan suatu atom; contoh spektrum kontinu adalah spektrum radiasi elektromagnetik benda padat yang dipanaskan dan spektrum transisi elektronik bebas atom; contoh spektrum gabungan adalah spektrum emisi bintang, di mana garis serapan kromosfer atau sebagian besar spektrum suara ditumpangkan pada spektrum kontinu fotosfer.
31. Fotometri: prinsip metode, penerapan dalam penelitian forensik.
Fotometri - metode spektral berdasarkan penyerapan radiasi elektromagnetik dalam rentang ultraviolet tampak dan dekat (metode ini didasarkan pada penyerapan cahaya)
Atom Molekuler
Spektroskopi spektroskopi (Dalam analisis elektron)
Cuvette - cahaya dilewatkan melaluinya
aku
I (intensitas cahaya keluaran)
I° adalah intensitas cahaya datang.
Fotometri adalah bagian dari optik fisik dan teknologi pengukuran yang dikhususkan untuk metode mempelajari karakteristik energi radiasi optik dalam proses emisinya, propagasinya di berbagai media dan interaksi dengan benda. Fotometri dilakukan dalam rentang inframerah (panjang gelombang - 10 -3 ... 7 · 10 -7 m), tampak (7 · 10 -7 ... 4 · 10 -7 m) dan ultraviolet (4 · 10 -7 ... 10 -8 m) radiasi optik. Ketika radiasi elektromagnetik dari rentang optik menyebar di lingkungan biologis, sejumlah efek utama diamati: penyerapan dan hamburan radiasi oleh atom dan molekul medium, hamburan ketidakhomogenan medium oleh partikel, depolarisasi radiasi. Dengan mencatat data interaksi radiasi optik dengan medium, dimungkinkan untuk menentukan parameter kuantitatif yang terkait dengan karakteristik medis dan biologis dari objek yang diteliti. Untuk mengukur besaran fotometrik digunakan alat yang disebut fotometer. Dalam istilah fotometrik, cahaya adalah radiasi yang mampu menghasilkan sensasi terang bila terkena mata manusia. Landasan fotometri sebagai ilmu adalah teori medan cahaya yang dikembangkan oleh A. Gershun.
Ada dua metode umum fotometri: 1) fotometri visual, yang menggunakan kemampuan mata manusia untuk melihat perbedaan kecerahan dengan menyamakan kecerahan dua bidang perbandingan dengan cara mekanis atau optik; 2) fotometri fisik, di mana berbagai penerima cahaya dari jenis yang berbeda digunakan untuk membandingkan dua sumber cahaya - fotosel vakum, fotodioda semikonduktor, dll.
32. Hukum Bouguer-Lambert-Beer, penggunaannya dalam analisis kuantitatif.
Hukum fisika yang menentukan redaman berkas cahaya monokromatik paralel ketika merambat dalam medium penyerap.
Hukum tersebut dinyatakan dengan rumus berikut:
![]() ,
,

dimana adalah intensitas sinar yang masuk, adalah ketebalan lapisan zat yang dilalui cahaya, adalah indeks serapan (jangan bingung dengan indeks serapan tak berdimensi, yang berhubungan dengan rumus, dimana adalah panjang gelombang) .
Indeks serapan mencirikan sifat-sifat suatu zat dan bergantung pada panjang gelombang cahaya yang diserap. Ketergantungan ini disebut spektrum serapan suatu zat.
Untuk larutan zat penyerap dalam pelarut yang tidak menyerap cahaya, indeks serapannya dapat ditulis sebagai
dimana adalah koefisien yang mencirikan interaksi molekul zat terlarut yang menyerap dengan cahaya dengan panjang gelombang λ, adalah konsentrasi zat terlarut, mol/l.
Pernyataan yang tidak bergantung pada disebut hukum Beer (jangan disamakan dengan hukum Beer). Hukum ini mengasumsikan bahwa kemampuan suatu molekul untuk menyerap cahaya tidak dipengaruhi oleh molekul lain di sekitarnya dari zat yang sama dalam larutan. Namun, terdapat banyak penyimpangan dari undang-undang ini, terutama pada masyarakat luas.
Jika fluks cahaya dengan intensitas I melewati lapisan tertentu larutan atau gas dengan ketebalan I, maka menurut hukum Lambert-Beer, banyaknya cahaya yang diserap akan sebanding dengan intensitas /, konsentrasi c zat yang menyerap. cahaya, dan ketebalan LAPISAN) hukum BMB, yang menghubungkan intensitas cahaya yang datang pada zat dan zat yang melewatinya, dengan konsentrasi zat dan tebalnya lapisan penyerap. sama seperti pembiasan, hanya redaman pada zatnya. Yang menyerap cahaya dengan persentase tertentu. Artinya, sisa keluaran cahayanya adalah
33. Spektroskopi IR.
Metode analisis ini didasarkan pada pencatatan spektrum serapan inframerah suatu zat. Penyerapan oleh materi di daerah inframerah terjadi karena adanya getaran atom-atom dalam molekul. Getaran dibagi menjadi regangan (ketika jarak antar atom berubah selama getaran) dan getaran (ketika sudut antar ikatan berubah selama getaran). Transisi antara keadaan getaran yang berbeda dalam molekul dikuantisasi, sehingga serapan di daerah IR berbentuk spektrum, dimana setiap getaran memiliki panjang gelombangnya sendiri. Jelas bahwa panjang gelombang untuk setiap getaran bergantung pada atom mana yang berpartisipasi di dalamnya, dan selain itu, tidak terlalu bergantung pada lingkungannya.
Metode spektroskopi IR bukanlah suatu metode pemisahan, yaitu ketika mempelajari suatu zat, bisa jadi yang dipelajari sebenarnya adalah campuran dari beberapa zat, yang tentunya akan sangat merusak hasil penguraian spektrum. Yah, tidak sepenuhnya benar untuk berbicara tentang identifikasi yang jelas suatu zat menggunakan metode spektroskopi IR, karena metode ini memungkinkan seseorang untuk mengidentifikasi gugus fungsi tertentu, daripada kuantitasnya dalam suatu senyawa dan metode komunikasinya satu sama lain.
Metode spektroskopi IR digunakan untuk melakukan penelitian pada bahan polimer, serat, pelapis cat, dan obat-obatan narkotika (saat mengidentifikasi bahan pengisi, sering digunakan karbohidrat, termasuk polisakarida). Metode ini sangat diperlukan dalam studi pelumas, karena memungkinkan untuk secara bersamaan menentukan sifat dasar pelumas dan kemungkinan bahan tambahan (aditif) pada bahan dasar ini.
34. Analisis fluoresensi sinar-X.
(XRF) adalah salah satu metode spektroskopi modern untuk mempelajari suatu zat untuk memperoleh komposisi unsurnya, yaitu analisis unsurnya. Dapat digunakan untuk menganalisis berbagai unsur mulai dari berilium (Be) hingga uranium (U). Metode XRF didasarkan pada pengumpulan dan analisis selanjutnya dari spektrum yang diperoleh dengan memaparkan bahan yang diteliti pada radiasi sinar-X. Ketika disinari, atom memasuki keadaan tereksitasi, yang terdiri dari transisi elektron ke tingkat energi yang lebih tinggi. Atom tetap berada dalam keadaan tereksitasi untuk waktu yang sangat singkat, sekitar satu mikrodetik, setelah itu kembali ke posisi tenang (keadaan dasar). Dalam hal ini, elektron dari kulit terluar mengisi kekosongan yang dihasilkan, dan kelebihan energi dipancarkan dalam bentuk foton, atau energi ditransfer ke elektron lain dari kulit terluar (elektron Auger)
Ekologi dan perlindungan lingkungan: penentuan logam berat dalam tanah, sedimen, air, aerosol, dll.
Geologi dan mineralogi: analisis kualitatif dan kuantitatif tanah, mineral, batuan, dll.
Industri metalurgi dan kimia: pengendalian kualitas bahan baku, proses produksi dan produk jadi
Industri cat dan pernis: analisis cat timbal
35. Spektroskopi emisi atom.
Analisis spektral emisi atom adalah seperangkat metode analisis unsur yang didasarkan pada studi spektrum emisi atom dan ion bebas dalam fase gas. Biasanya, spektrum emisi dicatat dalam rentang panjang gelombang optik yang paling nyaman dari 200 hingga 1000 nm.
AES (spektrometri emisi atom) adalah metode untuk menentukan komposisi unsur suatu zat dari spektrum emisi optik atom dan ion dari sampel yang dianalisis, tereksitasi dalam sumber cahaya. Sebagai sumber cahaya untuk analisis emisi atom, nyala api pembakar atau berbagai jenis plasma digunakan, termasuk percikan listrik atau plasma busur, plasma percikan laser, plasma berpasangan induktif, pelepasan cahaya, dll. AES adalah metode ekspres yang paling umum dan sangat sensitif untuk mengidentifikasi dan mengukur pengotor unsur dalam zat gas, cair dan padat, termasuk zat dengan kemurnian tinggi.
Area penggunaan:
Metalurgi: analisis komposisi logam dan paduan,
Industri pertambangan: studi sampel geologi dan bahan baku mineral,
Ekologi: analisis air dan tanah,
Peralatan: analisis oli motor dan cairan teknis lainnya untuk mengetahui kotoran logam,
Penelitian biologi dan medis.
Prinsip operasi.
Prinsip pengoperasian spektrometer emisi atom cukup sederhana. Hal ini didasarkan pada fakta bahwa atom dari setiap unsur dapat memancarkan cahaya dengan panjang gelombang tertentu - garis spektrum, dan panjang gelombang ini berbeda untuk unsur yang berbeda. Agar atom mulai memancarkan cahaya, atom harus tereksitasi - dengan panas, pelepasan listrik, laser, atau cara lain. Semakin banyak atom suatu unsur tertentu dalam sampel yang dianalisis, semakin terang radiasi dengan panjang gelombang yang sesuai.
Intensitas garis spektral unsur yang dianalisis, selain konsentrasi unsur yang dianalisis, bergantung pada sejumlah besar faktor yang berbeda. Karena alasan ini, secara teoritis tidak mungkin menghitung hubungan antara intensitas garis dan konsentrasi unsur yang bersangkutan. Oleh karena itu, diperlukan sampel standar yang komposisinya mirip dengan sampel yang dianalisis. Sampel standar ini pertama kali diekspos (dibakar) pada perangkat. Berdasarkan hasil pembakaran tersebut, dibuat grafik kalibrasi untuk setiap elemen yang dianalisis, yaitu. ketergantungan intensitas garis spektrum suatu unsur pada konsentrasinya. Selanjutnya, saat menganalisis sampel, grafik kalibrasi ini digunakan untuk menghitung ulang intensitas yang diukur menjadi konsentrasi.
Persiapan sampel untuk dianalisis.
Perlu diingat bahwa pada kenyataannya beberapa miligram sampel dari permukaannya dianalisis. Oleh karena itu, untuk memperoleh hasil yang benar, sampel harus homogen komposisi dan strukturnya, serta komposisi sampel harus identik dengan komposisi logam yang dianalisis. Saat menganalisis logam di pengecoran atau peleburan, disarankan untuk menggunakan cetakan khusus untuk sampel pengecoran. Dalam hal ini, bentuk sampel bisa berubah-ubah. Sampel yang dianalisis hanya perlu memiliki luas permukaan yang cukup dan dapat dijepit pada dudukannya. Adaptor khusus dapat digunakan untuk menganalisis sampel kecil seperti batang atau kabel.
Keuntungan dari metode ini:
Non-kontak,
Kemungkinan penentuan kuantitatif secara simultan sejumlah besar elemen,
Akurasi tinggi,
Batas deteksi rendah,
Kemudahan persiapan sampel,
Biaya rendah.
36. Spektroskopi serapan atom.
suatu metode untuk menentukan secara kuantitatif komposisi unsur suatu zat yang diteliti menggunakan spektrum serapan atom, berdasarkan kemampuan atom untuk secara selektif menyerap radiasi elektromagnetik dalam dekomposisi. bagian dari spektrum. A.-a.a. dilakukan secara khusus perangkat - penyerapan spektrofotometer. Sampel bahan yang dianalisis dilarutkan (biasanya dengan pembentukan garam); larutan dalam bentuk aerosol dimasukkan ke dalam nyala api pembakar. Di bawah pengaruh nyala api (3000°C), molekul garam terurai menjadi atom, yang dapat menyerap cahaya. Kemudian seberkas cahaya dilewatkan melalui nyala api pembakar, yang spektrumnya terdapat garis-garis spektral yang bersesuaian dengan unsur tertentu. Garis spektral yang diteliti diisolasi dari total radiasi menggunakan monokromator, dan intensitasnya dicatat oleh unit perekam. Matematika. pengolahannya dilakukan dengan rumus : J = J0 * e-kvI,
dimana J dan J0 adalah intensitas cahaya yang ditransmisikan dan datang; kv – koefisien penyerapan, tergantung frekuensinya; I - ketebalan lapisan penyerap
lebih sensitif dibandingkan pembangkit listrik tenaga nuklir
37. Nefelometri dan turbidimetri.
S = log (I°/I) intensitas turun. Dalam larutan (I°) bagi dengan intensitas yang meninggalkan larutan (I) =
kekeruhan k-const
b – panjang jalur berkas cahaya
N adalah jumlah partikel per unit. larutan
Analisis nefelometri dan turbidimetri menggunakan fenomena hamburan cahaya oleh partikel padat yang tersuspensi dalam larutan.
Nefelometri adalah metode untuk menentukan dispersi dan konsentrasi sistem koloid berdasarkan intensitas cahaya yang dihamburkannya. Nefelometri, pengukuran dilakukan dalam alat khusus, nefelometer, yang tindakannya didasarkan pada perbandingan intensitas cahaya yang dihamburkan oleh medium yang diteliti dengan intensitas cahaya yang dihamburkan oleh medium lain, yang berfungsi sebagai standar. Teori hamburan cahaya oleh sistem koloid, di mana ukuran partikel tidak melebihi setengah panjang gelombang cahaya datang, dikembangkan oleh fisikawan Inggris J. Rayleigh pada tahun 1871. Menurut hukum Rayleigh, intensitas cahaya I tersebar dalam arah tegak lurus terhadap berkas datang dinyatakan dengan rumus I = QNvlk - dimana q adalah intensitas cahaya datang, N adalah jumlah total partikel per satuan volume, atau konsentrasi parsial, v adalah volume satu partikel, \ adalah panjang gelombang cahaya datang, k adalah konstanta yang bergantung pada indeks bias partikel koloid dan media pendispersi di sekitarnya, jarak dari sumber cahaya, serta pada satuan pengukuran yang diterima
Turbidimetri adalah suatu metode untuk menganalisis media keruh berdasarkan pengukuran intensitas cahaya yang diserapnya. Pengukuran turbidimetri dilakukan pada cahaya yang ditransmisikan menggunakan turbidimeter visual atau kolorimeter fotolistrik. Teknik pengukurannya mirip dengan kolorimetri dan didasarkan pada penerapan hukum Bouguer-Lambert pada media keruh, yang dalam kasus suspensi hanya berlaku untuk lapisan yang sangat tipis atau pada pengenceran yang signifikan. Turbidimetri memerlukan pengamatan yang cermat terhadap kondisi pembentukan fase terdispersi, serupa dengan kondisi yang diamati pada nefelometri. Peningkatan yang signifikan dalam turbidimetri adalah penggunaan titrasi kekeruhan puncak turbidimetri menggunakan kolorimeter fotolistrik. Turbidimetri berhasil digunakan untuk penentuan analitik sulfat, fosfat, klorida, sianida, timbal, seng, dll.
Keuntungan utama metode nefelometri dan turbidimetri adalah sensitivitasnya yang tinggi, yang sangat berharga dalam kaitannya dengan unsur atau ion yang tidak memiliki reaksi warna. Dalam praktiknya, misalnya, penentuan klorida dan sulfat secara nefelometri di perairan alami dan benda serupa banyak digunakan. Dalam hal akurasi, turbidimetri dan nefelometri lebih rendah daripada metode fotometri, hal ini terutama disebabkan oleh kesulitan memperoleh suspensi dengan ukuran partikel yang sama, stabilitas dari waktu ke waktu, dll. Selain kesalahan yang biasanya relatif kecil dalam penentuan fotometri, kesalahan terkait dengan kurangnya reproduktifitas metode analisis kimia ditambahkan sifat suspensi.
Nefelometri dan turbidimetri digunakan misalnya untuk menentukan SO4 berupa suspensi BaSO4, Cl- berupa suspensi AgCl, S2- berupa suspensi CuS dari bawah. batas kandungan yang dapat dideteksi adalah ~ 0,1 μg/ml. Untuk membakukan kondisi analisis dalam percobaan, perlu dikontrol secara ketat suhu, volume suspensi, konsentrasi reagen, kecepatan pengadukan, dan waktu pengukuran. Curah hujan harus berlangsung cepat, dan partikel yang diendapkan harus berukuran kecil dan memiliki pH rendah. Untuk mencegah koagulasi partikel besar, zat penstabil sering ditambahkan ke dalam larutan, misalnya. agar-agar, gliserin.
38. Kromatografi: sejarah asal usul, prinsip metode, penerapan di pengadilan. Riset.
Kromatografi adalah metode penyerapan dinamis untuk memisahkan dan menganalisis campuran zat, serta mempelajari sifat fisikokimia zat. Hal ini didasarkan pada distribusi zat antara dua fase - stasioner (fase padat atau cair yang terikat pada pembawa inert) dan bergerak (fase gas atau cair, eluen). Nama metode ini dikaitkan dengan percobaan pertama dalam kromatografi, di mana pengembang metode ini, Mikhail Tsvet, memisahkan pigmen tumbuhan berwarna cerah.
Metode kromatografi pertama kali digunakan oleh ahli botani Rusia Mikhail Semenovich Tsvet pada tahun 1900. Dia menggunakan kolom berisi kalsium karbonat untuk memisahkan pigmen tumbuhan. Laporan pertama tentang perkembangan metode kromatografi dibuat oleh Tsvet pada tanggal 30 Desember 1901 di Kongres Naturalis dan Dokter XI di St. Karya cetak pertama tentang kromatografi diterbitkan pada tahun 1903, di jurnal Prosiding Masyarakat Naturalis Warsawa. Istilah pertama kali kromatografi muncul dalam dua karya cetak Color pada tahun 1906, diterbitkan di majalah Jerman Berichte der Deutschen Botanischen Gesellschaft. Pada tahun 1907, Tsvet mendemonstrasikan metodenya Masyarakat Botani Jerman.
Pada tahun 1910-1930, metode ini tidak dapat dilupakan dan praktis tidak berkembang.
Pada tahun 1931, R. Kuhn, A. Winterstein dan E. Lederer, menggunakan kromatografi, mengisolasi fraksi α dan β dalam bentuk kristal dari karoten mentah, sehingga menunjukkan nilai preparatif dari metode ini.
Pada tahun 1941, A. J. P. Martin dan R. L. M. Singh mengembangkan jenis kromatografi baru, yang didasarkan pada perbedaan koefisien distribusi zat yang dipisahkan antara dua cairan yang tidak dapat bercampur. Metode itu disebut " kromatografi partisi».
Pada tahun 1947, T. B. Gapon, E. N. Gapon dan F. M. Shemyakin mengembangkan metode “kromatografi pertukaran ion”.
Pada tahun 1952, J. Martin dan R. Singh dianugerahi Hadiah Nobel Kimia atas penemuan metode kromatografi partisi.
Sejak pertengahan abad ke-20 hingga saat ini, kromatografi telah berkembang secara intensif dan menjadi salah satu metode analisis yang paling banyak digunakan.
Klasifikasi: Gas, Cair
Dasar-dasar kromatografi proses. Untuk melakukan kromatografi pemisahan zat atau penentuan fisika-kimianya. karakteristik biasanya digunakan khusus. perangkat - kromatografi. Dasar unit kromatografi - kromatografi. kolom, detektor, dan perangkat injeksi sampel. Kolom yang berisi sorben berfungsi memisahkan campuran yang dianalisis menjadi komponen-komponen penyusunnya, dan detektor berfungsi memisahkan kuantitasnya. definisi. Detektor yang terletak di outlet kolom secara otomatis terus menerus menentukan konsentrasi senyawa yang dipisahkan. dalam aliran fase gerak Setelah memasukkan campuran yang dianalisis dengan aliran fase gerak ke dalam kolom, zona semua zat terletak di awal kromatografi. kolom (Gbr. 1). Di bawah pengaruh aliran fase gerak, komponen campuran mulai bergerak sepanjang kolom dengan dekomposisi. kecepatan, yang nilainya berbanding terbalik dengan koefisien distribusi K komponen yang dikromatografi. Zat yang terjerap dengan baik, yang nilai konstanta distribusinya besar, bergerak sepanjang lapisan sorben sepanjang kolom lebih lambat daripada zat yang terjerap buruk. Oleh karena itu, komponen A paling cepat meninggalkan kolom, kemudian komponen B, dan yang terakhir meninggalkan kolom adalah komponen C (K A<К Б <К В). Сигнал детектора, величина к-рого пропорциональна концентрации определяемого в-ва в потоке элюента, автоматически непрерывно записывается и регистрируется (напр., на диаграммной ленте). Полученная хроматограмма отражает расположение хроматографич. зон на слое сорбента или в потоке подвижной фазы во времени.

Beras. 1. Pemisahan campuran tiga komponen (A, B dan C) pada kolom kromatografi K dengan detektor D: a - posisi zona kromatografi komponen yang dipisahkan dalam kolom pada selang waktu tertentu; b - kromatogram (C - sinyal, t - waktu) .
Dengan kromatografi lapis datar Saat memisahkan, selembar kertas atau pelat dengan lapisan sorben dengan sampel bahan uji ditempatkan dalam kromatografi. kamera. Setelah pemisahan, komponen ditentukan dengan metode apa pun yang sesuai.
39. Klasifikasi metode kromatografi.
Kromatografi adalah metode pemisahan dan analisis zat berdasarkan distribusi analit. Perbedaan antara 2 fase: bergerak dan diam
Suatu larutan campuran zat yang akan dipisahkan dilewatkan melalui tabung gelas (kolom adsorpsi) yang diisi dengan adsorben. Akibatnya, komponen-komponen campuran tertahan pada ketinggian kolom adsorben yang berbeda dalam bentuk zona (lapisan) terpisah. Bahannya lebih baik dari adsorbir. Mereka berada di bagian atas kolom, dan teradsorpsi lebih buruk di bagian bawah kolom. Zat yang tidak dapat diadsorpsi melewati kolom tanpa henti dan dikumpulkan dalam filter.
Klasifikasi:
1. Menurut keadaan agregasi fase-fasenya.
1) Bergerak
A) gas (gas inert: helium, argon, azon)
B) cair
2. menurut cara pelaksanaannya
1) di pesawat (planar); kertas lapis tipis
2) berbentuk kolom
A) dikemas (kolom dikemas diisi dengan sorben)
B) kapiler (kapiler kaca/kuarsa tipis pada permukaan bagian dalam yang diberi fase diam)
Anda bisa yakin. Barang dalam jumlah kecil.
Zat-zat yang mudah menguap dipisahkan.
40. Kromatogram. Parameter dasar puncak kromatografi.
Kromatogram merupakan hasil pencatatan ketergantungan konsentrasi komponen pada keluaran kolom terhadap waktu.
H S
Setiap puncak dalam kromatogram dicirikan oleh dua puncak parameter utama
1. Waktu retensi ( T R) adalah waktu dari saat sampel yang dianalisis dimasukkan hingga puncak kromatografi maksimum tercatat. Hal ini tergantung pada sifat zat dan merupakan karakteristik kualitatif.
2. Tinggi ( H) atau daerah ( S) puncak
S = ½ ω × H. (4)
Tinggi dan luas puncak bergantung pada jumlah zat dan merupakan sifat kuantitatif.
Waktu retensi terdiri dari dua komponen - waktu tinggal zat dalam fase gerak ( T M) dan waktu tinggal dalam fase diam ( T S):
Identifikasi puncak komponen yang tidak diketahui pada campuran yang dianalisis dilakukan dengan cara perbandingan (comparison). nilai ditentukan langsung dari kromatogram, dengan data tabulasi yang sesuai untuk senyawa yang diketahui. Saat mengidentifikasi dengan kromatografi, hanya negatif yang dapat diandalkan. menjawab; misalnya, puncak i bukan item A jika waktu retensi puncak i dan item A tidak bersamaan. Kebetulan waktu retensi puncak i dan item A merupakan kondisi yang diperlukan tetapi tidak cukup untuk menyimpulkan bahwa puncak i adalah item A.
Dalam kerja praktek, pilihan satu atau beberapa parameter untuk penguraian kode kuantitatif kromatogram ditentukan oleh pengaruh gabungan beberapa faktor: kecepatan dan kemudahan perhitungan, bentuk (lebar, sempit) dan derajat asimetri puncak kromatografi, efisiensi kolom yang digunakan, kelengkapan pemisahan komponen campuran, ketersediaan perangkat otomatis yang diperlukan (integrator, sistem komputer untuk memproses data kromatografi).
Parameter puncak kromatografi yang ditentukan diukur secara manual oleh operator pada kromatogram pada akhir siklus pemisahan komponen campuran yang dianalisis.
Parameter puncak kromatografi yang ditentukan diukur secara otomatis menggunakan voltmeter digital, integrator atau komputer khusus secara bersamaan dengan pemisahan komponen campuran yang dianalisis dalam kolom dan pencatatan kromatogram.
Karena teknik penguraian kode kromatogram dilakukan untuk mengukur parameter puncak kromatografi dari senyawa yang diinginkan dan senyawa standar, kondisi kromatografi harus memastikan pemisahan selengkap mungkin; semua komponen lain dari sampel asli di bawah kondisi analisis yang diterima dapat tidak lepas satu sama lain atau bahkan tidak tampak sama sekali pada kromatogram (inilah keunggulan metode standar internal dibandingkan metode normalisasi internal)
41.Analisis kromatografi kualitatif.
Jika panjang kolom cukup, pemisahan komponen-komponen campuran secara sempurna dapat dicapai. Dan setelah mengelusi komponen-komponen yang dipisahkan menjadi fraksi-fraksi terpisah (eluat), tentukan jumlah komponen campuran (sesuai dengan jumlah eluat), tetapkan komposisi kualitatifnya, tentukan jumlah masing-masing komponen, dengan menggunakan metode analisis kuantitatif yang sesuai. .
Analisis kromatografi kualitatif, mis. Identifikasi suatu zat menurut kromatogramnya dapat dilakukan dengan membandingkan karakteristik kromatografi, paling sering volume tertahan (yaitu, volume fase gerak yang melewati kolom dari awal pemasukan campuran hingga munculnya komponen ini di saluran keluar. kolom), ditemukan dalam kondisi tertentu untuk komponen campuran zat yang dianalisis dan untuk standar.
42.Analisis kromatografi kuantitatif.
Analisis kromatografi kuantitatif biasanya dilakukan pada kromatografi. Metode ini didasarkan pada pengukuran berbagai parameter puncak kromatografi, tergantung pada konsentrasi zat yang dikromatografi - tinggi, lebar, luas dan volume tertahan, atau produk dari volume tertahan dan tinggi puncak.
Dalam kromatografi gas kuantitatif, metode kalibrasi absolut dan normalisasi internal, atau normalisasi, digunakan. Metode standar internal juga digunakan. Dengan kalibrasi absolut, ketergantungan ketinggian atau luas puncak pada konsentrasi zat ditentukan secara eksperimental dan grafik kalibrasi dibuat atau koefisien yang sesuai dihitung. Selanjutnya, karakteristik puncak yang sama dalam campuran yang dianalisis ditentukan, dan konsentrasi analit ditentukan dari grafik kalibrasi. Metode sederhana dan akurat ini adalah metode utama untuk menentukan jejak pengotor.
Saat menggunakan metode normalisasi internal, jumlah parameter puncak apa pun, misalnya, jumlah ketinggian semua puncak atau jumlah luasnya, diambil 100%. Maka perbandingan tinggi suatu puncak individu dengan jumlah tingginya atau perbandingan luas suatu puncak dengan jumlah luasnya jika dikalikan 100 akan mencirikan fraksi massa (%) komponen dalam campuran. Dengan pendekatan ini, ketergantungan nilai parameter yang diukur terhadap konsentrasi harus sama untuk semua komponen campuran.
43.Kromatografi planar. Penggunaan kromatografi lapis tipis untuk analisis tinta.
Bentuk pertama penggunaan selulosa dalam kromatografi lapis tipis adalah kromatografi kertas. TLC yang tersedia dan pelat TLC throughput tinggi memungkinkan pemisahan campuran zat polar, menggunakan setidaknya campuran air terner, pelarut organik yang tidak dapat bercampur, dan pelarut yang larut dalam air yang mendorong pembentukan satu fase sebagai eluen)