Ηλεκτροχημικές μέθοδοι- Η πιο δυναμική ανάπτυξη όσον αφορά την εφαρμογή τους στην περιβαλλοντική παρακολούθηση. Οι πιο συνηθισμένες μέθοδοι που χρησιμοποιούνται στα συστήματα MOS είναι η βολταμετρία (συμπεριλαμβανομένης της πολαρογραφίας), η ποτενσιομετρία (συμπεριλαμβανομένης της ιοντομετρίας), η κουλομετρία και η αγωγιμότητα.
Οι ηλεκτροχημικές μέθοδοι ανάλυσης χρησιμοποιούν την εξάρτηση των διαφόρων ηλεκτρικών ιδιοτήτων του μέσου από την ποσοτική περιεκτικότητα και την ποιοτική σύνθεση των ουσιών που αναλύονται σε αυτό:
· αλλαγή δυνητικόςηλεκτρόδιο ανάλογα με τις φυσικές και χημικές διεργασίες που εμφανίζονται στην ουσία ( ποτενσιομετρικήμέθοδος), συμπεριλαμβανομένου Επιλεκτικές αντιδράσεις των επιλεκτικών ιόντων ηλεκτροδίων, μεμονωμένα ευαίσθητα σε μεγάλο αριθμό κατιόντων και ανιόντων ( ιονομετρικήμέθοδος);
· αλλαγή ηλεκτρική αγωγιμότητα (ρεύμα)και διηλεκτρική σταθερά μιας ουσίας ανάλογα με τη φύση του μέσου και τη συγκέντρωση των συστατικών της ( αγωγομετρικήΚαι αμπερομετρικήμέθοδοι)·
· αλλαγές ποσότητα ηλεκτρικής ενέργειαςΌταν ο αναλυόμενος μπαίνει στο ηλεκτροχημικό κύτταρο ( κουλομετρικήμέθοδος);
· ανάκτηση της αναλυόμενης ένωσης σε ένα ηλεκτρόδιο που στάζει ή περιστρεφόμενο υδράργυρο, κατά κανόνα, όταν αναλύονται ίχνη ουσιών σε διαφορετικές καταστάσεις συσσωμάτωσης ( πολογραφικήή βολταμετρικόμέθοδος).
Οι πολωγραφές όλων των συσκευών σε αυτή την ομάδα έχουν την υψηλότερη ευαισθησία, ίσες με 0,005-1 μg/ml δείγματος.
ΒολταμετρίαΠεριλαμβάνει μια ομάδα μεθόδων ηλεκτροχημικής ανάλυσης που βασίζονται στη μελέτη των καμπυλών πόλωσης. Αυτές οι μέθοδοι είναι πολαρογραφίαΚαι αμπερομετρική ογκομέτρηση – έχουν πολλές ποικιλίες και τροποποιήσεις. Το συνηθέστερο σταθερό ρεύμαπολαρογραφία.
Μια πολωγραφική εγκατάσταση αποτελείται από μια άμεση πηγή ρεύματος, έναν διαιρέτη τάσης, ένα πτωτικό (συνήθως υδράργυρο) ή περιστρεφόμενο ηλεκτρόδιο και ένα βοηθητικό (συνήθως επίσης υδράργυρο ή άλλο) ηλεκτρόδιο. Για να μετρηθεί το ρεύμα, ένα μικροαιμυρόμετρο συνδέεται με το σύστημα. Τα ηλεκτρόδια τοποθετούνται μαζί με το διάλυμα δοκιμής σε ηλεκτρολύτη (κύτταρο).
Η τάση που εφαρμόζεται σε ένα ηλεκτρολυτικό στοιχείο προκαλεί πόλωση της ανόδου και της καθόδου μι= στ ένα– στ κ +iR, Οπου Εγώ– τρέχουσα ισχύς ΠΡΟΣ ΤΗΝ -αντίσταση διαλύματος; φά ένακαι στ κ– δυναμικά της ανόδου και της καθόδου.
Εάν μειώσετε την αντίσταση του διαλύματος προσθέτοντας έναν ισχυρό ηλεκτρολύτη (φόντο), τότε η τιμή iR(πιθανή πτώση του διαλύματος) μπορεί να παραμεληθεί.
Το δυναμικό της ανόδου παραμένει ουσιαστικά σταθερό κατά τη λειτουργία της κυψέλης, καθώς η πυκνότητα ρεύματος είναι χαμηλή και η σχετικά μεγάλη επιφάνεια της ανόδου δεν είναι πολωμένη. Τότε το δυναμικό μιας πολωτικής καθόδου που στάζει με μικρή επιφάνεια θα είναι ίσο με: μι= -στ κ. Συχνά στις πολογραφικές μετρήσεις, αντί για ένα στρώμα υδραργύρου στον πυθμένα του δοχείου, χρησιμοποιείται ένα μη πολωτικό κορεσμένο ηλεκτρόδιο καλομέλας, το δυναμικό του οποίου λαμβάνεται ίσο με μηδέν.
Τα πολογραφικά δεδομένα λαμβάνονται με τη μέτρηση του ρεύματος που διέρχεται από ένα ηλεκτρολυτικό στοιχείο ως συνάρτηση του δυναμικού που εφαρμόζεται στα ηλεκτρόδια. Η γραφική εξάρτηση του ρεύματος από το δυναμικό ονομάζεται πολογραφικό κύμα ( ρύζι. 2).
Στην αρχή της ηλεκτρόλυσης, σε χαμηλές τιμές του επιβαλλόμενου EMF, η ισχύς του ρεύματος θα είναι σχεδόν σταθερή και θα αυξάνεται μόνο πολύ αργά. Αυτό είναι το λεγόμενο υπολειπόμενο ρεύμα, το οποίο παραμένει καθ' όλη τη διάρκεια της ηλεκτρόλυσης.
Ρύζι. 2. Πολαρόγραμμα ενός διαλύματος χλωριούχου ψευδαργύρου 10–3 M και ενός διαλύματος χλωριούχου καλίου 1 M (καμπύλη 1) και ενός διαλύματος 1 M χλωριούχου καλίου (καμπύλη 2)
Μόλις επιτευχθεί το δυναμικό μείωσης ιόντων (για παράδειγμα, για τα καθορισμένα ιόντα ψευδαργύρου είναι ίσο με -1,0 V), η εκφόρτισή τους αρχίζει με μια σταγόνα υδραργύρου:
Zn2 + + 2 + Hg ® Zn (Hg).
Ένα αραιό αμάλγαμα ψευδαργύρου Zn (Hg) σχηματίζεται στην κάθοδο, το οποίο αποσυντίθεται στα συστατικά του μόλις η σταγόνα που πέφτει έρθει σε επαφή με την άνοδο:
Zn (Hg) - 2 ® Zn2 + + Hg.
Στο δυναμικό μείωσης των ιόντων ψευδαργύρου, η ισχύς του ρεύματος αυξάνεται απότομα ( ρύζι. 2), αλλά μετά την επίτευξη μιας ορισμένης τιμής, παρά την αύξηση του εφαρμοζόμενου EMF, παραμένει σχεδόν σταθερή. Αυτό το ρεύμα ονομάζεται περιοριστικό ή διάχυτο· η τιμή του είναι συνήθως ανάλογη της συγκέντρωσης της ουσίας που προσδιορίζεται.
Κατά τη λήψη πολωρογραμμάτων, ένας αδιάφορος ηλεκτρολύτης με κατιόντα που μειώνονται πολύ πιο δύσκολα από το αναλυόμενο κατιόν προστίθεται στον υπό μελέτη ηλεκτρολύτη, για παράδειγμα, KCl, KNO 3, NH 4 Cl. σε συγκέντρωση 100–1000 φορές μεγαλύτερη από τη συγκέντρωση της ουσίας που προσδιορίζεται. Αυτός ο ηλεκτρολύτης ονομάζεται "φόντο". Δημιουργείται στο διάλυμα δοκιμής για να αυξήσει την ηλεκτρική αγωγιμότητα και να θωρακίσει το ηλεκτρικό πεδίο του ηλεκτροδίου δείκτη (κάθοδος). Επομένως, τα κατιόντα της αναλυόμενης ουσίας δεν έλκονται από το ηλεκτρικό πεδίο της καθόδου, αλλά κινούνται προς αυτό λόγω διάχυσης.
Το πιο σημαντικό χαρακτηριστικό ενός πολαρογράμματος είναι το δυναμικό μισού κύματος μι 1/2 και ύψος πολωγραφικού κύματος η(όριο ρεύματος διάχυσης). Το δυναμικό μισού κύματος χρησιμοποιείται στο ποιότηταπολογραφική ανάλυση. Τα δυναμικά ημικυμάτων διαφόρων ουσιών, διατεταγμένα κατά σειρά αυξανόμενης αρνητικής τιμής, αποτελούν το λεγόμενο «πολαρογραφικό φάσμα». Δεδομένου ότι το δυναμικό μισού κύματος εξαρτάται σημαντικά από τη σύνθεση του διαλύματος (το μέσο που αναλύεται), το φόντο υποδεικνύεται πάντα στους πολογραφικούς πίνακες.
ΣΕ ποσοτικόςΣτην πολαρογραφική ανάλυση, για τη μέτρηση της συγκέντρωσης χρησιμοποιούνται οι μέθοδοι γραφήματος βαθμονόμησης, πρόσθετα, συγκρίσεις και μέθοδοι υπολογισμού.
Μεταξύ των διαφόρων επιλογών για πολαρογραφία, η μέθοδος Διαφορική πολωογραφία παλμού (DIP) ) είναι πιο αποτελεσματικό για την επίλυση προβλημάτων περιβαλλοντικής παρακολούθησης, κυρίως λόγω της υψηλής ευαισθησίας του. Η μέθοδος DIP σας επιτρέπει να αξιολογήσετε την περιεκτικότητα όλων των ουσιών που προσδιορίζονται από την κλασική πολαρογραφία. Μεταξύ άλλων πολωγραφικών μεθόδων, είναι ιδιαίτερα βολικό για ανάλυση ιχνών τετραγωνικό κύμαπολαρογραφία, το οποίο παρέχει ένα όριο ανίχνευσης κοντά σε αυτό του DIP, αλλά μόνο στην περίπτωση διεργασιών αναστρέψιμων ηλεκτροδίων, και επομένως αυτή η μέθοδος χρησιμοποιείται συχνά για τον προσδιορισμό των ιχνών βαρέων μετάλλων. Η μέθοδος DIP μπορεί επίσης να χρησιμοποιηθεί για τον προσδιορισμό επιφανειοδραστικών ουσιών που αλλάζουν την χωρητικότητα του διπλού ηλεκτρικού στρώματος του ηλεκτροδίου.
Μπορούν να χρησιμοποιηθούν μέθοδοι για τον προσδιορισμό της μικροπεριεκτικότητας ιόντων βαρέων μετάλλων Ηλεκτροχημική ανάλυση αναστροφής (IEA) ή με άλλο τρόπο, Απόκτηση βολταμετρικής ανάλυσης (IVA ), στο οποίο τα μέταλλα που πρόκειται να προσδιοριστούν εναποτίθενται εκ των προτέρων στο ηλεκτρόδιο και στη συνέχεια διαλύονται κατά τη διάρκεια του πολωγραφικού ελέγχου. Αυτή η επιλογή, σε συνδυασμό με το DIP, είναι μια από τις πιο ευαίσθητες μεθόδους ηλεκτροχημικής ανάλυσης. Ο σχεδιασμός υλικού του IEA (IVA) είναι σχετικά απλός, γεγονός που καθιστά δυνατή τη διενέργεια αναλύσεων επιτόπου, και οι αυτοματοποιημένοι σταθμοί συνεχούς ελέγχου (παρακολούθησης) μπορούν επίσης να λειτουργήσουν σε αυτήν την αρχή.
Οι μέθοδοι IEA (IVA) παρέχουν τον προσδιορισμό των ιόντων Cu, Pb, Bi, Sb, As, Sn In, Ga, Ag, Tl, Cd, Zn, Hg, Au, Ge, Te, Ni, Co και πολλών ανιόντων. Ένα σημαντικό πλεονέκτημα των μεθόδων IEA (IEA) είναι (σε αντίθεση με άλλες μεθόδους, για παράδειγμα, όπως η φασματομετρία ατομικής απορρόφησης) ικανότητα διάκρισης των ελεύθερων ιόντων από τις δεσμευμένες χημικές τους μορφές, το οποίο είναι επίσης σημαντικό για την αξιολόγηση των φυσικοχημικών ιδιοτήτων των αναλυόμενων ουσιών από την άποψη του περιβαλλοντικού αναλυτικού ελέγχου (για παράδειγμα, κατά την αξιολόγηση της ποιότητας του νερού). Πολλές οργανικές ουσίες μπορούν επίσης να προσδιοριστούν με μεθόδους IEA (IEA) μετά τη συσσώρευση προσρόφησής τους στην επιφάνεια του ηλεκτροδίου.
Οι πολογραφικές μέθοδοι μπορούν επίσης να χρησιμοποιηθούν για τον προσδιορισμό των αερολυμάτων διαφόρων μετάλλων στην ατμόσφαιρα και τον αέρα των βιομηχανικών χώρων αφού συλληφθούν σε κατάλληλα φίλτρα, ακολουθούμενη από μεταφορά των συμπυκνωμάτων σε διάλυμα. Οι οργανικές ενώσεις που υπάρχουν με τη μορφή αερίων και ατμών στην ατμόσφαιρα μπορούν να προσδιοριστούν πολογραφικά αφού απορροφηθούν από ειδικά επιλεγμένα διαλύματα. Τα μέταλλα και οι διάφορες ενώσεις σε βιολογικά υλικά προσδιορίζονται συνήθως πολογραφικά μετά την εξαγωγή τους. Όλες οι πολογραφικές μετρήσεις, συμπεριλαμβανομένου του IEA (IVA), μπορούν να είναι πλήρως αυτοματοποιημένες, κάτι που είναι απαραίτητο κατά την εκτέλεση σειριακών αναλύσεων.
Ένας από τους σημαντικότερους τομείς εφαρμογής της πολαρογραφίας είναι ο προσδιορισμός του οξυγόνου στο νερό. Για το σκοπό αυτό χρησιμοποιούνται αμπερομετρικοί ανιχνευτές που παράγουν ρεύμα ανάλογο με τη συγκέντρωση οξυγόνου στο διάλυμα.
Με την εφαρμογή ενός ενζύμου στην επιφάνεια της μεμβράνης του ανιχνευτή, είναι δυνατό να ληφθούν διάφοροι ενζυμικοί αμπερομετρικοί αισθητήρες κατάλληλοι για βιοχημικές και κλινικές αναλύσεις. Τέτοιοι αισθητήρες χρησιμοποιούνται επίσης σε συστήματα περιβαλλοντικής παρακολούθησης.
Τα ηλεκτρόδια που λειτουργούν με την ηλεκτροκαταλυτική αρχή είναι κατάλληλα για την παρακολούθηση διαφόρων αερίων (SO 2, H 2 S, CO, NO x) στον αέρα των βιομηχανικών χώρων. Οι ηλεκτροχημικές αντιδράσεις αυτών των αερίων (που παίζουν το ρόλο του καταλύτη) που συμβαίνουν στην επιφάνεια του ηλεκτροδίου δημιουργούν ένα ρεύμα στο σύστημα ηλεκτροδίων που σχετίζεται λειτουργικά με τη συγκέντρωση των αερίων στον αέρα.
Η χρήση της πολαρογραφίας δεν περιορίζεται στην ανάλυση διακριτών δειγμάτων και η μέθοδος κινείται σταδιακά στις αρχές της συνεχούς ανάλυσης αερίων και υγρών.
Οι βολταμετρικοί πολογραφικοί ανιχνευτές έχουν χρησιμοποιηθεί με επιτυχία στην υγρή χρωματογραφία υψηλής απόδοσης (HPLC). Στην περίπτωση αυτή, ο συνδυασμός μιας εξαιρετικά επιλεκτικής μεθόδου διαχωρισμού με μια ευαίσθητη μέθοδο ανίχνευσης οδηγεί σε αξιοσημείωτη διεύρυνση του εύρους των ουσιών που καθορίζονται με τη χρωματογραφική μέθοδο (ίχνη άκρως τοξικών ουσιών, ζιζανιοκτόνα, φάρμακα, διεγερτικά ανάπτυξης κ.λπ.).
Οι λεπτομέρειες της μεθόδου μπορούν να διευκρινιστούν στην εξειδικευμένη βιβλιογραφία.
Ποτενσιομετρία– μέθοδος προσδιορισμού της συγκέντρωσης ουσιών, βασισμένη στη μέτρηση του emf των αναστρέψιμων γαλβανικών κυψελών.
Στην πράξη, χρησιμοποιούνται δύο μέθοδοι ανάλυσης: απευθείαςποτενσιομετρίαγια τον προσδιορισμό της δραστηριότητας των σωματιδίων, η οποία μπορεί να υπολογιστεί χρησιμοποιώντας την εξίσωση Nernst από το emf του γαλβανικού στοιχείου, και ποτενσιομετρική τιτλοδότηση , στην οποία μια αλλαγή στη δραστηριότητα των χημικών ουσιών κατά τη διαδικασία τιτλοδότησης οδηγεί σε αλλαγή στο emf του γαλβανικού στοιχείου.
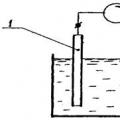
Ο εξοπλισμός για τη διεξαγωγή ποτενσιομετρικών τιτλοδοτήσεων και για την άμεση ποτενσιομετρία είναι ο ίδιος. Το ποτενσιομετρικό κύκλωμα μέτρησης περιλαμβάνει ένα ηλεκτρόδιο δείκτη και ένα ηλεκτρόδιο αναφοράς με σταθερό σταθερό δυναμικό, καθώς και μια δευτερεύουσα συσκευή. Το βασικό διάγραμμα της μεθόδου φαίνεται στο ρύζι. 3.

1 – ηλεκτρόδιο δείκτη. 2 - ηλεκτρόδιο αναφοράς
Ρύζι. 3. Ποτενσιομετρικό κελί
Το δυναμικό ενός ζεύγους ηλεκτροδίων είναι σταθερό. Η αλλαγή της συγκέντρωσης της αναλυόμενης ουσίας στο διάλυμα αλλάζει το EMF του κυκλώματος. Τα ηλεκτρόδια ένδειξης συνήθως διατίθενται σε τέσσερα τύπους, ανάλογα με τη χρησιμοποιούμενη μεμβράνη, η οποία διαχωρίζει το διάλυμα του ηλεκτροδίου από το διάλυμα δοκιμής: 1) ηλεκτρόδια με ομοιογενή μεμβράνη από σκόνη ή κρυσταλλικό υλικό. 2) ηλεκτρόδια με ετερογενή μεμβράνη, στην οποία η δραστική ουσία του ηλεκτροδίου κατανέμεται, για παράδειγμα, σε καουτσούκ σιλικόνης. 3) ηλεκτρόδια με υγρή μεμβράνη, στα οποία η μεμβράνη είναι ένα διάλυμα που εφαρμόζεται σε μια ουδέτερη ουσία, για παράδειγμα, πορώδες γυαλί. 4) ηλεκτρόδια γυαλιού με διαφορετικές χημικές συνθέσεις γυαλιού.
Τα ηλεκτρόδια ένδειξης αποκτούν το δυναμικό του διαλύματος στο οποίο τοποθετούνται. Υπάρχουν δύο είδοςηλεκτρόδια ένδειξης:
1) αδιάφορα ηλεκτρόδια (μη καταστρεπτά κατά την ηλεκτρόλυση).
2) ηλεκτρόδια που αλλάζουν (οξειδώνονται ή μειώνονται) κατά τις μετρήσεις.
Ρόλος αδιάφορα ηλεκτρόδια(αυτά ονομάζονται μερικές φορές ηλεκτρόδια τρίτοςείδος) είναι να δώσεις ή να κερδίσεις ηλεκτρόνια, δηλ. να είναι αγωγοί του ηλεκτρισμού. Τέτοια ηλεκτρόδια μπορούν να κατασκευαστούν από χρυσό, γυαλισμένη πλατίνα, γραφίτη και άλλα υλικά. Παραδείγματα μεταβλητών ηλεκτροδίων (μερικές φορές ονομάζονται ηλεκτρόδια) πρώταείδος) μπορεί να είναι πλάκες από χαλκό, ψευδάργυρο και άλλα μέταλλα, καθώς και ηλεκτρόδια ένδειξης κινυδρόνης και υδρογόνου. Επιπλέον, τα ηλεκτρόδια ένδειξης μπορούν να είναι ηλεκτρόδια επιλεκτικής μεμβράνης ιόντων για τον προσδιορισμό πολλών κατιόντων: Li +, Pb +, Cs +, Tl +, NH +, Na +, K +, Ag +, κ.λπ. Ως ηλεκτρόδια αναφοράς ( πρότυποηλεκτρόδια), του οποίου το δυναμικό παραμένει σταθερό καθ' όλη τη διάρκεια της μέτρησης, τα πιο συχνά χρησιμοποιούμενα είναι, για παράδειγμα, τα ηλεκτρόδια κανονικής και δεινοκανονικής καλομέλας (calomel) με δυναμικά +0,282 V και +0,334 V, αντίστοιχα, καθώς και ένα ηλεκτρόδιο κορεσμένου χλωριούχου αργύρου με δυναμικό +0,201 V.
Σε μια ιδανική περίπτωση, η άμεση ποτενσιομετρική μέτρηση του EMF ενός γαλβανικού στοιχείου μπορεί να συσχετιστεί μέσω της εξίσωσης Nernst με τη δραστηριότητα του σωματιδίου που προσδιορίζεται ή με τη συγκέντρωση, εάν είναι γνωστοί οι αντίστοιχοι συντελεστές δραστηριότητας:
![]()
Οπου μι 0 – τυπικό δυναμικό ηλεκτροδίου, V; R– σταθερά αερίου. Τ– απόλυτη θερμοκρασία F -Αριθμός Faraday; n– αριθμός ηλεκτρονίων που χάθηκαν ή αποκτήθηκαν. , [μειωμένη] – συγκεντρώσεις ισορροπίας οξειδωμένης και ανηγμένης μορφής, αντίστοιχα, mol/dm 3 .
Αν αντικαταστήσουμε τις τιμές αναφοράς των σταθερών και μετακινηθούμε από τον φυσικό λογάριθμο στον δεκαδικό, τότε για θερμοκρασία 25°C παίρνουμε:

Ο πιο σημαντικός δείκτης για τον χαρακτηρισμό της κατάστασης του περιβάλλοντος είναι η τιμή pH αυτού του περιβάλλοντος, ο προσδιορισμός του οποίου ( pH-μετρία ) επί του παρόντος πραγματοποιείται συνήθως με τη χρήση γυάλινων δεικτών (μέτρησης) ηλεκτροδίων. Για μακροχρόνιες μετρήσεις, έχουν αναπτυχθεί ειδικά σχέδια ηλεκτροδίων γυαλιού με πρόσθετες συσκευές για να διασφαλίζεται ο καθαρισμός της γυάλινης μεμβράνης. Γυάλινα ηλεκτρόδια καλυμμένα με ημιπερατή μεμβράνη με φιλμ ηλεκτρολύτη χρησιμεύουν επίσης ως βάση για διάφορους τύπους ανιχνευτών ( Αισθητήρες ), χρησιμοποιείται στην ανάλυση του νερού και του αέρα υπό συνθήκες παραγωγής για έναν αριθμό ρύπων (NH 3, CO 2, NO x, SO 2, H 2 S, κ.λπ.).
Η διαδικασία στον τομέα της δημιουργίας ηλεκτροδίων επιλεκτικών ιόντων (ISE) επιτρέπει την παρακολούθηση των ιόντων F – , I – , Br – , Cl – , CN – , SCN – , NO 3 – , NO 2 – , ClO 4 – , S 2 – , Na + , K + Ca 2+ , Ag + , Cu 2+ , Cd 2+ , Pb 2+ σε συγκέντρωση κυμαίνεται από 10 –2 έως 10 –7 mol/l (περίπου 1–10 –5 mg/ml). Η παρακολούθηση με χρήση ISE χαρακτηρίζεται από ταχύτητα, απλότητα και μεγαλύτερες δυνατότητες για συνεχείς μετρήσεις. Έχουν αναπτυχθεί ISE που είναι επιλεκτικά σε μια ευρεία κατηγορία οργανικών ουσιών, καθώς και ισομερή στη μάζα τους, επιφανειοδραστικές ουσίες και απορρυπαντικά που βρίσκονται στον αέρα μιας περιοχής παραγωγής και στο καθεστώς διαχείρισης νερού των βιομηχανικών επιχειρήσεων.
Η ποτενσιομετρία χρησιμοποιείται επίσης για τη μέτρηση των δυναμικών οξειδοαναγωγής διαφόρων συστημάτων οξειδοαναγωγής (O/R) στο νερό. Κατά κανόνα, τα αποτελέσματα των μετρήσεων αντιστοιχούν σε ένα μικτό δυναμικό, καθώς πολλά συστήματα O/W συνυπάρχουν συνήθως ταυτόχρονα στο νερό.
Θα πρέπει να σημειωθεί ότι η χρήση αισθητήρων βασισμένων σε τρανζίστορ χημικά επιλεκτικών και επιλεκτικών ιόντων οξειδίου μετάλλου ημιαγωγών (HSFT, ISFT) είναι πολλά υποσχόμενη. Η επιλεκτικότητα σε αυτά τα συστήματα επιτυγχάνεται με την επιλογή της σύνθεσης της μεμβράνης και του στρώματος που εναποτίθεται στην πύλη του τρανζίστορ. Το σύστημα βυθίζεται στο διάλυμα που αναλύεται και η διαφορά δυναμικού μεταξύ του ηλεκτροδίου αναφοράς και της πύλης του τρανζίστορ ρυθμίζει το ρεύμα που ρέει μεταξύ της πηγής και της αποστράγγισης του. Λόγω της επιλεκτικότητας της μεμβράνης ή της εναποτιθέμενης στρώσης, το διαμορφωμένο ρεύμα γίνεται συνάρτηση της δραστηριότητας του αντίστοιχου συστατικού του διαλύματος. Οι αισθητήρες ημιαγωγών αποτελούν τη βάση των οθονών και των αναλυτών διαφόρων αερίων και ατμών. Το μικρό μέγεθος τέτοιων αισθητήρων καθιστά δυνατό τον συνδυασμό τους με τη μορφή μωσαϊκού σε ένα μόνο υπόστρωμα, έτσι ώστε να λαμβάνεται ένας αναλυτής που μπορεί να παρακολουθεί μια ολόκληρη σειρά επιβλαβών ουσιών. Τα σήματα από μεμονωμένους αισθητήρες που περιλαμβάνονται στο μωσαϊκό μπορούν να καταγράφονται διαδοχικά και περιοδικά από το κέντρο μέτρησης του αναλυτικού συστήματος.
Η ανάπτυξη της μικροηλεκτρονικής καθιστά δυνατό τον σχεδιασμό συμπαγών αναλυτών τύπου ανιχνευτή με χρήση σύγχρονων ISE. Σε αυτήν την περίπτωση, ένα κύκλωμα που επεξεργάζεται την απόκριση από το αντικείμενο περιβαλλοντικού ελέγχου, ακόμη και μια οθόνη, μπορεί να τοποθετηθεί στη λαβή του αισθητήρα.
Στην εξειδικευμένη βιβλιογραφία μπορείτε να μάθετε τις λεπτομέρειες της μεθόδου, , , .
ΚουλομετρικήΗ μέθοδος ανάλυσης είναι μια μέτρηση του ρεύματος της αντίδρασης ηλεκτροδίου στην οποία η υπό μελέτη ουσία εισέρχεται στο κουλομετρικό στοιχείο με την αναλυόμενη ροή. Το σχηματικό διάγραμμα ενός κουλομετρικού κελιού φαίνεται στο ρύζι. 4.

1 – θάλαμος καθόδου. 2 – θάλαμος ανόδου. 3 – μικροαμπερόμετρο
Ρύζι. 4. Σχηματικό σχηματικό κελί
Η κουλομετρική ανάλυση βασίζεται στη μέτρηση της ποσότητας ηλεκτρικής ενέργειας που δαπανάται για την ποσοτική διεξαγωγή μιας δεδομένης ηλεκτροχημικής διεργασίας σε ένα δεδομένο δείγμα, δηλ. υπό την προϋπόθεση ότι η τρέχουσα απόδοση είναι 100%. Αυτή είναι η ποσότητα ηλεκτρικής ενέργειας με τη βοήθεια ενός ολοκληρωτή ρεύματος χρόνου συνδεδεμένου σε σειρά με το κύτταρο μέτρησης ή ενός κουλομέτρου-ηλεκτρολύτη, στον οποίο μια ηλεκτροχημική διεργασία πραγματοποιείται με απόδοση ρεύματος εκατό τοις εκατό, συνοδευόμενη από την απελευθέρωση ενός ουσία, η ποσότητα της οποίας μπορεί να αποκατασταθεί εύκολα και με ακρίβεια.
Συμφωνώς προς Ο νόμος του Faraday:
Μ( Χ)/Μ(Χ) = Μ(κ)/Μ(κ),
Οπου Μ(Χ), m(k) -Η μάζα της ουσίας καθορίζεται Χκαι την ουσία που απελευθερώνεται στο κουλόμετρο, αντίστοιχα. Μ(Χ), Μ(κ) - Μοριακή μάζα ισοδύναμων ουσιών Χκαι ουσία που απελευθερώνεται στο Coulometer, g/mol.

Ο υπολογισμός μπορεί επίσης να γίνει χρησιμοποιώντας την εξίσωση που περιγράφει το νόμο του Faraday:
![]()
Εάν η ισχύς της τρέχουσας αντοχής μετράται κατά την ανάλυση Εγώ, Α και χρόνος t, s, που δαπανήθηκαν για τη διεξαγωγή της ηλεκτροχημικής διαδικασίας.
Σε άλλη τροποποίηση αυτής της μεθόδου, που ονομάζεται
κουλομετρική ογκομέτρηση
, ο τιτλοδοτητής παράγεται ηλεκτρολυτικά στο αναλυόμενο διάλυμα σε δεδομένο ρεύμα. Η κατανάλωση του τιτλοδοτητή στην αναλυτική αντίδραση αντικαθίσταται από το φορτίο που ρέει διαμέσου του διαλύματος όταν παράγεται ο τιτλοδοτητής μέχρι να επιτευχθεί το σημείο ισοδυναμίας.
Ενας από Πλεονεκτήματα των μεθόδων Coulometricείναι ότι η διαδικασία τυποποίησης τιτλοδοτών συχνά δεν είναι απαραίτητη, αφού οι υπολογισμοί βασίζονται στη σταθερά του Faraday, δηλ. η μέθοδος είναι απόλυτη και σας επιτρέπει να εκτιμήσετε την ποσότητα της ουσίας που προσδιορίζεται και όχι τη συγκέντρωσή της. Το μειονέκτημα της κουλομετρίας με δεδομένο δυναμικό είναι η διάρκεια της διαδικασίας ανάλυσης, που σχετίζεται με την ανάγκη για πλήρη ολοκλήρωση της ηλεκτρόλυσης. Η τεχνολογία υπολογιστών καθιστά δυνατή τη μείωση αυτού του χρόνου προβλέποντας το τέλος της ηλεκτρόλυσης επεξεργάζοντας μαθηματικά την καμπύλη ρεύματος-χρόνου για τα αρχικά στάδια της ηλεκτρόλυσης και υπολογίζοντας την ποσότητα ηλεκτρικής ενέργειας ή τη συγκέντρωση μιας ουσίας στο διάλυμα. Κατά την ανάλυση δειγμάτων πολλαπλών συστατικών, μπορεί να χρησιμοποιηθεί κουλομετρία σάρωσης , στην οποία το δυναμικό ηλεκτρόλυσης αλλάζει συνεχώς ή σταδιακά. Για τέτοια συστήματα, η κουλομετρική τιτλοδότηση είναι προτιμότερη από την άμεση κουλομετρία, καθώς η απόδοση ρεύματος 100% στην παραγωγή τιτλοδοτητή μπορεί εύκολα να επιτευχθεί με τη σωστή επιλογή του αντιδραστηρίου τιτλοδότησης και της σύνθεσης του μέσου εργασίας. Η κουλομετρική τιτλοδότηση ισχύει για τον προσδιορισμό ουσιών από 0,01 έως 100 mg (μερικές φορές κάτω από 1 μg). Ο όγκος του δείγματος εργασίας είναι συνήθως από 10 έως 50 ml. Η μέθοδος χαρακτηρίζεται από υψηλή ακρίβεια, το σχετικό σφάλμα δεν υπερβαίνει τα πολλά δέκατα του τοις εκατό ακόμη και με κουλομετρική τιτλοδότηση περιεχομένων μικρογραμμαρίων. Κάτω από βέλτιστες συνθήκες, οι τιτλοδοτήσεις μπορούν να πραγματοποιηθούν με πολύ χαμηλά συνολικά σφάλματα 0,01% (σχετ.). Διάφορα όξινη βάση, οξειδοαναγωγή. Οι επιλογές κατακρήμνισης και συμπλοκομετρικής ογκομέτρησης μπορούν να πραγματοποιηθούν κουλομετρικά.
Οι κουλομετρικοί αναλυτές αερίων και οι υδατοαναλυτές ("κουλομέτρα") έχουν αναπτυχθεί και παραχθεί για τον προσδιορισμό του διοξειδίου του θείου και του υδρόθειου (θειικά και σουλφίδια), του όζοντος (και υπεροξειδίου του υδρογόνου), του χλωρίου στον αέρα (και του ενεργού χλωρίου στο νερό), Το μονοξείδιο του άνθρακα και το διοξείδιο του αζώτου στον αέρα (νιτρικά και νιτρώδη σε νερό). Η κουλομετρία χρησιμοποιείται επίσης ως εργαλείο ηλεκτροχημικής ανίχνευσης σε υγρή χρωματογραφία.
Λεπτομέρειες της μεθόδου μπορούν να βρεθούν στην εξειδικευμένη βιβλιογραφία.
Αγωγομετρική μέθοδοςΗ ανάλυση βασίζεται στη μέτρηση της ηλεκτρικής αγωγιμότητας του διαλύματος. Η αγωγομετρική μέθοδος ανάλυσης συνίσταται στη μέτρηση της μεταβολής της αντίστασης ενός διαλύματος ηλεκτρολύτη όταν ένα συστατικό του μείγματος απορροφάται. Για παράδειγμα χρησιμοποιούνται αγωγιμές εγκαταστάσεις για τον προσδιορισμό του μονοξειδίου του άνθρακα και του διοξειδίου, του ατμού βενζίνης, της αμμωνίας και άλλων.
Η ηλεκτρική αγωγιμότητα είναι η αμοιβαία αντίσταση R, η διάστασή του είναι cm (Siemens) δηλ. æ = 1/ R.
Η ηλεκτρική αγωγιμότητα ενός διαλύματος εξαρτάται από τον αριθμό των ιόντων ανά μονάδα όγκου του διαλύματος, δηλ. στη συγκέντρωση ΜΕσχετικά με την κινητικότητα αυτών των ιόντων – V.Βασισμένο σε γνωστές σχέσεις
![]()
Οπου Ζ– απόσταση μεταξύ ηλεκτροδίων. S -περιοχή ηλεκτροδίου. κ– συντελεστής αναλογικότητας.
Για ένα συγκεκριμένο ζεύγος ηλεκτροδίων με σταθερή απόσταση μεταξύ τους μικρό/Ζ= συνθ. Επειτα
![]() ,
,
Οπου κ 1 = κ(μικρό/Ζ).
Κατά την πραγματοποίηση υπολογισμών στη διεξαγωγή της συμπεριφοράς, χρησιμοποιείται η έννοια της "ηλεκτρικής αγωγιμότητας" æ 0:
![]()
Στους υπολογισμούς είναι βολικό να χρησιμοποιηθεί η ισοδύναμη ηλεκτρική αγωγιμότητα, η οποία είναι ίση με:
Οπου Π -Αριθμός μολυσμάτων ισοδύναμο σε 1 cm 3 διαλύματος. Η ισοδύναμη ηλεκτρική αγωγιμότητα L ¥ σε άπειρη αραίωση είναι ίσο με το άθροισμα των κινητικότητας κατιόντων Uκαι ανιόν V.
Ο λόγος της ισοδύναμης ηλεκτρικής αγωγιμότητας ενός διαλύματος ασθενούς ηλεκτρολύτη προς την ισοδύναμη ηλεκτρική αγωγιμότητα αυτού του ηλεκτρολύτη σε άπειρη αραίωση είναι ίσος με τον βαθμό διάστασης a αυτού του ηλεκτρολύτη:
Παρά τη μη εξειδίκευσή της, αυτή η μέθοδος χρησιμοποιείται αρκετά συχνά σε συστήματα περιβαλλοντικής παρακολούθησης σε σύγκριση με άλλες ηλεκτροχημικές μεθόδους. Αυτό εξηγείται από το γεγονός ότι κατά την αξιολόγηση της ρύπανσης, για παράδειγμα, του νερού και της ατμόσφαιρας, είναι δυνατός όχι σταδιακά, αλλά (τελικός) έλεγχος της παραγωγής των βιομηχανικών διεργασιών. Λόγω της εξαιρετικά χαμηλής ηλεκτρικής αγωγιμότητας του νερού, συχνά αρκεί η εκτίμηση της συνολικής περιεκτικότητας σε ρύπους, κάτι που παρέχει η αγωγιμότητα. Τυπικά παραδείγματα χρήσης αγωγομετρικών μεθόδων στην περιβαλλοντική παρακολούθηση είναι οι αναλυτές απορρυπαντικών στα λύματα, η συγκέντρωση συνθετικών συστατικών στα συστήματα άρδευσης και η ποιότητα (αλατότητα) του πόσιμου νερού. Οι αγωγομετρικοί αναλυτές χρησιμοποιούνται για τη συνεχή παρακολούθηση των ρύπων του αέρα και της βροχόπτωσης όπως το SO 2 και το H 2 SO 4 . Επιπρόσθετα άμεση αγωγιμότηταμπορεί να χρησιμοποιηθεί για τον προσδιορισμό ορισμένων τύπων ρύπανσης έμμεσοςμεθόδους, οι οποίες παρέχουν πολύ αποτελεσματικές εκτιμήσεις της περιεκτικότητας των ουσιών που αναφέρονται παραπάνω, οι οποίες αλληλεπιδρούν πριν από τη μέτρηση με ειδικά επιλεγμένα αντιδραστήρια και η καταγεγραμμένη μεταβολή της ηλεκτρικής αγωγιμότητας προκαλείται μόνο από την παρουσία των αντίστοιχων προϊόντων στην αντίδραση. Με αυτόν τον τρόπο μπορείτε να προσδιορίσετε τα οξείδια του αζώτου μετά την καταλυτική τους αναγωγή της προαμμωνίας, καθώς και τα HCl, HBr και CO 2 μετά από μια προκαταρκτική αντίδραση με Ba(OH) 2 ή NaOH. Η περιγραφόμενη αρχή για τον προσδιορισμό του CO 2 μπορεί επίσης να χρησιμοποιηθεί για τον έμμεσο προσδιορισμό οργανικών ουσιών στο νερό.
Εκτός από την κλασική αγωγιμότητα, υπάρχει επίσης μια έκδοση υψηλής συχνότητας ( παλμομετρία ), στην οποία το σύστημα ηλεκτροδίου δείκτη δεν έρχεται σε επαφή με το δείγμα. Αυτή η αρχή εφαρμόζεται συχνά σε αναλυτές συνεχούς αγωγιμότητας.
Οι ηλεκτροχημικές μέθοδοι ανάλυσης περιγράφονται επίσης σε πλήθος εκπαιδευτικών και ειδικών δημοσιεύσεων.
ΒΙΒΛΙΟΓΡΑΦΙΑ
1. Drugov Yu.S., Rodin A.A.Περιβαλλοντική αναλυτική χημεία.
Αγία Πετρούπολη: 2002. - 464 σελ.
2. Pashkevich Μ.Α., Shuisky V.F. Περιβαλλοντική παρακολούθηση.Φροντιστήριο. Κρατικό Πανεπιστήμιο της Αγίας Πετρούπολης. - Αγία Πετρούπολη, 2002. - 90 σελίδες.
3. Cattrall Robert W. Χημικοί αισθητήρες.Μ.: Scientific World, 2000. - 144 σελ.
4. Turyan Ya.I., Ruvinsky O.E., Zaitsev μ.μ.Πολωγραφική καταλυμετρία.Μ.: Χημεία, 1998. – 272 σελ.
5. Budnikov G.K., Maistrenko V.N., Murinov Yu.I. Βολταμετρία με τροποποιημένα και υπερμικροηλεκτρόδια.Μ.: Nauka, 1994. – 239 σελ.
6. Brainina Kh.Z., Neiman E.Ya., Slepushkin V.V. Ηλεκτροαναλυτικές μέθοδοι αντιστροφής.Μ.: 1988. – 240 σελ.
7. Salikhdzhanova R.F. και τα λοιπά. Οι πολαρογράφοι και η χρήση τους στην πρακτική ανάλυση και έρευνα.Μ.: Χημεία, 1988. – 192 σελ.
8. Kaplan B.Ya., Pats R.G., Salikhdzhanova R.F. Βολταμετρία AC.Μ.: Χημεία, 1985. – 264.
9. Bond A.M. Πολαρογραφικές μέθοδοι στην αναλυτική χημεία.Μ.: Χημεία, 1983.
10. Εφρεμένκο Ο.Α. Ποτενσιομετρική ανάλυση.Μ.: MMA im. ΤΟΥΣ. Sechenova, 1998.
11. Οδηγός αναφοράς για την εφαρμογή των επιλεκτικών ηλεκτροδίων ιόντων.Μ.: Μιρ, 1986.
12. Κορύτα Ι. Ιόντα, ηλεκτρόδια, μεμβράνες.Μ.: Μιρ, 1983.
13. Nikolsky B.V., Materova E.A. Επιλεκτικά ηλεκτρόδια ιόντων.Λ.: Χημεία, 1980.
14. Εφρεμένκο Ο.Α.Κουλομετρική ογκομέτρηση.Μ.: MMA im. ΤΟΥΣ. Sechenova, 1990.
15. Khudyakova T.A., Koreshkov A.P. Αγωγομετρική μέθοδος ανάλυσης.Εγχειρίδιο για τα πανεπιστήμια. Μ.: Ανώτατο Σχολείο, 1975. – 207 σελ.
16. Budnikov G.K., Maistrenko V.N., Vyaselev M.R. Βασικές αρχές της σύγχρονης ηλεκτρικής ανάλυσης.Μ.: Χημεία, 2000.
17. Prokhorova G.V. Εισαγωγή στις ηλεκτροχημικές μεθόδους ανάλυσης.Μ.: Εκδοτικός Οίκος του Κρατικού Πανεπιστημίου της Μόσχας, 1991. – 97 σελ.
18. Ηλεκτροαναλυτικές μέθοδοι στην παρακολούθηση του περιβάλλοντος. /Επιμ. R. Kalvoda, R. Zyka, K. Shtulik και άλλοι M.: Chemistry, 1990. – 240 p.
19. Πλάμπεκ Τζ.Ηλεκτροχημικές μέθοδοι ανάλυσης. Βασικές αρχές θεωρίας και εφαρμογής./Μετ. από τα Αγγλικά Μ.: Μιρ, 1986.
Περιγραφή της δουλειάς
Οι σύγχρονοι κλάδοι παραγωγής και η κοινωνική ζωή των ανθρώπων θέτουν τα δικά τους ειδικά καθήκοντα σε φυσικές και χημικές μεθόδους ανάλυσης για τον έλεγχο της ποιότητας των προϊόντων. Μία από τις κύριες φυσικοχημικές μεθόδους ανάλυσης είναι οι ηλεκτροχημικές μέθοδοι ανάλυσης.
Αυτές οι μέθοδοι μπορούν γρήγορα και με αρκετή ακρίβεια να καθορίσουν πολλούς δείκτες ποιότητας προϊόντων.
Οι ηλεκτροχημικές μέθοδοι για την ανάλυση της σύστασης της ύλης χρησιμοποιούνται ευρέως σε διάφορες βιομηχανίες. Σας επιτρέπουν να αυτοματοποιείτε τη λήψη αποτελεσμάτων σχετικά με την ποιότητα του προϊόντος και να διορθώνετε παραβιάσεις χωρίς να διακόπτετε την παραγωγή. Στη βιομηχανία τροφίμων, αυτές οι μέθοδοι καθορίζουν την οξεοβασική ισορροπία του προϊόντος, την παρουσία επιβλαβών και τοξικών ουσιών και άλλους δείκτες που επηρεάζουν όχι μόνο την ποιότητα, αλλά και την ασφάλεια των τροφίμων.
Ο εξοπλισμός που έχει σχεδιαστεί για ηλεκτροχημική ανάλυση είναι σχετικά φθηνός, προσιτός και εύκολος στη χρήση. Επομένως, αυτές οι μέθοδοι χρησιμοποιούνται ευρέως όχι μόνο σε εξειδικευμένα εργαστήρια, αλλά και σε πολλές βιομηχανίες.
Από αυτή την άποψη, ο σκοπός αυτού του ku
ΕΙΣΑΓΩΓΗ 2
ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ 3
1.1 Γενικά χαρακτηριστικά των φυσικοχημικών μεθόδων ανάλυσης 3
1.2 Χαρακτηριστικά ηλεκτροχημικών μεθόδων 4
1.3 Ταξινόμηση ηλεκτροχημικών μεθόδων ανάλυσης 5
2 ΠΕΙΡΑΜΑΤΙΚΟ-ΠΡΑΚΤΙΚΟ ΜΕΡΟΣ 15ο
ΣΥΜΠΕΡΑΣΜΑ 21
ΑΝΑΦΟΡΕΣ 22
Εισαγωγή
Κεφάλαιο 1. Γενικές έννοιες. Ταξινόμηση ηλεκτροχημικών μεθόδων ανάλυσης
Κεφάλαιο 2. Ποτενσιομετρικές μέθοδοι ανάλυσης (ποτενσιομετρία)
1 Αρχή της μεθόδου
3 Ποτενσιομετρική ογκομέτρηση
Κεφάλαιο 3. Αγωγομετρική μέθοδος ανάλυσης
1 Αρχή της μεθόδου. ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ
2 Αρχή της αγωγιμότητας
3 Αγωγομετρική ογκομέτρηση
Κεφάλαιο 4. Αγωγομετρική ανάλυση (αγωγιμότητα)
1 Η ουσία της μεθόδου
2 Ποσοτική πολογραφική ανάλυση
3 Εφαρμογές πολαρογραφίας
Κεφάλαιο 5. Αμπερομετρική ογκομέτρηση
Κεφάλαιο 6. Κουλομετρική ανάλυση (κουλομετρία)
1 Αρχή της μεθόδου
3 Κουλομετρική ογκομέτρηση
συμπέρασμα
Βιβλιογραφία
ΕΙΣΑΓΩΓΗ
Οι ηλεκτροχημικές μέθοδοι ανάλυσης είναι ένα σύνολο μεθόδων ποιοτικής και ποσοτικής ανάλυσης που βασίζονται σε ηλεκτροχημικά φαινόμενα που συμβαίνουν στο υπό μελέτη μέσο ή στη διεπιφάνεια και σχετίζονται με αλλαγές στη δομή, τη χημική σύνθεση ή τη συγκέντρωση της αναλυόμενης ουσίας.
Οι ηλεκτροχημικές μέθοδοι ανάλυσης χωρίζονται σε πέντε κύριες ομάδες: ποτενσιομετρία, βολταμετρία, κουλομετρία, αγωγιμότητα και αμπερομετρία.
Η χρήση αυτών των μεθόδων στην ποσοτική ανάλυση βασίζεται στην εξάρτηση των τιμών των μετρούμενων παραμέτρων κατά την ηλεκτροχημική διεργασία από τη διαχωρισμένη ουσία στο αναλυόμενο διάλυμα που συμμετέχει σε αυτήν την ηλεκτροχημική διαδικασία. Τέτοιες παράμετροι περιλαμβάνουν τη διαφορά στο ηλεκτρικό δυναμικό και την ποσότητα ηλεκτρικής ενέργειας. Οι ηλεκτροχημικές διεργασίες είναι διεργασίες που συνοδεύονται ταυτόχρονα από μια χημική αντίδραση και μια αλλαγή στις ηλεκτρικές ιδιότητες του συστήματος, που σε τέτοιες περιπτώσεις μπορεί να ονομαστεί ηλεκτροχημικό σύστημα. Στην αναλυτική πρακτική, ένα ηλεκτροχημικό σύστημα τυπικά περιέχει ένα ηλεκτροχημικό στοιχείο που περιλαμβάνει ένα δοχείο που περιέχει ένα ηλεκτρικά αγώγιμο διάλυμα δοκιμής στο οποίο βυθίζονται ηλεκτρόδια.
Υπάρχουν άμεσες και έμμεσες ηλεκτροχημικές μέθοδοι. Σε άμεσες μεθόδους, χρησιμοποιείται η εξάρτηση της ισχύος ρεύματος (δυναμικό κ.λπ.) από τη συγκέντρωση του συστατικού που προσδιορίζεται. Σε έμμεσες μεθόδους μετράται η ένταση ρεύματος (δυναμικό κ.λπ.) προκειμένου να βρεθεί το τελικό σημείο ογκομέτρησης του συστατικού που προσδιορίζεται με κατάλληλο τιτλοδοτητή, δηλαδή χρησιμοποιείται η εξάρτηση της μετρούμενης παραμέτρου από τον όγκο του τιτλοδοτητή.
ΚΕΦΑΛΑΙΟ 1. ΓΕΝΙΚΕΣ ΕΝΝΟΙΕΣ. ΤΑΞΙΝΟΜΗΣΗ ΜΕΘΟΔΩΝ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΑΝΑΛΥΣΗΣ
Η ηλεκτροαναλυτική χημεία περιλαμβάνει ηλεκτροχημικές μεθόδους ανάλυσης που βασίζονται σε αντιδράσεις ηλεκτροδίων και τη μεταφορά ηλεκτρικής ενέργειας μέσω διαλυμάτων.
Η χρήση ηλεκτροχημικών μεθόδων στην ποσοτική ανάλυση βασίζεται στη χρήση των εξαρτήσεων των τιμών των μετρούμενων παραμέτρων των ηλεκτροχημικών διεργασιών (διαφορά ηλεκτρικού δυναμικού, ρεύμα, ποσότητα ηλεκτρικής ενέργειας) από την περιεκτικότητα της αναλυόμενης ουσίας στο αναλυόμενο διάλυμα που συμμετέχει σε αυτή η ηλεκτροχημική διαδικασία. Οι ηλεκτροχημικές διεργασίες είναι διεργασίες που συνοδεύονται από την ταυτόχρονη εμφάνιση χημικών αντιδράσεων και μια αλλαγή στις ηλεκτρικές ιδιότητες του συστήματος, το οποίο σε τέτοιες περιπτώσεις μπορεί να ονομαστεί ηλεκτροχημικό σύστημα. Στην αναλυτική πρακτική, ένα ηλεκτροχημικό σύστημα περιέχει συνήθως ένα ηλεκτροχημικό στοιχείο, συμπεριλαμβανομένου ενός δοχείου με ένα ηλεκτρικά αγώγιμο διάλυμα δοκιμής στο οποίο βυθίζονται ηλεκτρόδια.
Ταξινόμηση ηλεκτροχημικών μεθόδων ανάλυσης. Οι ηλεκτροχημικές μέθοδοι ανάλυσης ταξινομούνται με διαφορετικούς τρόπους.Η ταξινόμηση βασίζεται στο να λαμβάνεται υπόψη η φύση της πηγής ηλεκτρικής ενέργειας στο σύστημα. Υπάρχουν δύο ομάδες μεθόδων:
α) Μέθοδοι χωρίς επιβολή εξωτερικού (εξωγενούς) δυναμικού.
Η πηγή ηλεκτρικής ενέργειας είναι το ίδιο το ηλεκτροχημικό σύστημα, το οποίο είναι ένα γαλβανικό στοιχείο (γαλβανικό κύκλωμα). Αυτές οι μέθοδοι περιλαμβάνουν ποτενσιομετρικές μεθόδους. Η ηλεκτροκινητική δύναμη - EMF - και τα δυναμικά ηλεκτροδίων σε ένα τέτοιο σύστημα εξαρτώνται από την περιεκτικότητα της αναλυόμενης ουσίας στο διάλυμα.
β) Μέθοδοι με την επιβολή εξωτερικού (εξωγενούς) δυναμικού. Αυτές οι μέθοδοι περιλαμβάνουν:
αγωγομετρική ανάλυση - βασίζεται στη μέτρηση της ηλεκτρικής αγωγιμότητας των διαλυμάτων ως συνάρτηση της συγκέντρωσής τους.
βολταμετρική ανάλυση - με βάση τη μέτρηση του ρεύματος ως συνάρτηση της εφαρμοσμένης γνωστής διαφοράς δυναμικού και της συγκέντρωσης του διαλύματος.
κουλομετρική ανάλυση - βασίζεται στη μέτρηση της ποσότητας ηλεκτρικής ενέργειας που διέρχεται από ένα διάλυμα ως συνάρτηση της συγκέντρωσής του.
ηλεκτροβαρυμετρική ανάλυση - βασίζεται στη μέτρηση της μάζας του προϊόντος μιας ηλεκτροχημικής αντίδρασης.
Ταξινόμηση σύμφωνα με τη μέθοδο εφαρμογής ηλεκτροχημικών μεθόδων. Υπάρχουν άμεσες και έμμεσες μέθοδοι.
α) Άμεσες μέθοδοι. Η ηλεκτροχημική παράμετρος μετράται ως γνωστή συνάρτηση της συγκέντρωσης του διαλύματος και, σύμφωνα με τις μετρήσεις της αντίστοιχης συσκευής μέτρησης, βρίσκεται η περιεκτικότητα της ουσίας που προσδιορίζεται στο διάλυμα.
β) Έμμεσες μέθοδοι είναι οι μέθοδοι ογκομέτρησης στις οποίες το τέλος της ογκομέτρησης προσδιορίζεται με βάση μετρήσεις των ηλεκτρικών παραμέτρων του συστήματος.
Σύμφωνα με αυτή την ταξινόμηση, γίνεται διάκριση μεταξύ, για παράδειγμα, άμεσης αγωγιμότητας και αγωγιμότητας ογκομέτρησης.
ΚΕΦΑΛΑΙΟ 2. ΜΕΘΟΔΟΣ ΠΟΕΝΤΙΟΜΕΤΡΙΚΗΣ ΑΝΑΛΥΣΗΣ (ΠΟΤΕΝΤΙΟΜΕΤΡΙΑ)
1 Αρχή της μεθόδου
Η ποτενσιομετρική ανάλυση (ποτενσιομετρία) βασίζεται στη μέτρηση των δυναμικών emf και ηλεκτροδίων ως συνάρτηση της συγκέντρωσης του αναλυόμενου διαλύματος.
Εάν σε ένα ηλεκτροχημικό σύστημα - σε ένα γαλβανικό στοιχείο - συμβαίνει μια αντίδραση στα ηλεκτρόδια:
aA+bB↔dD + eE
με τη μεταφορά n ηλεκτρονίων, τότε η εξίσωση Nernst για το emf E αυτής της αντίδρασης έχει τη μορφή:
E꞊E˚- RTnFlnaDda Eea(A)a aBb
όπου, ως συνήθως, E° είναι το τυπικό EMF της αντίδρασης (η διαφορά στα τυπικά δυναμικά ηλεκτροδίων), R είναι η σταθερά του αερίου, T είναι η απόλυτη θερμοκρασία στην οποία συμβαίνει η αντίδραση, F είναι ο αριθμός Faraday. a(A), a(B), a(D) και i(E) - οι δραστηριότητες των αντιδραστηρίων που συμμετέχουν στην αντίδραση. Η εξίσωση (10.1) ισχύει για το emf ενός αντιστρεπτά λειτουργούντος γαλβανικού στοιχείου.
Για τη θερμοκρασία δωματίου, η εξίσωση (10.1) μπορεί να αναπαρασταθεί με τη μορφή:
E꞊E˚- 0,059nlnaDda Eea(A)a aBb
Υπό συνθήκες όπου οι δράσεις των αντιδραστηρίων είναι περίπου ίσες με τις συγκεντρώσεις τους, η εξίσωση (1) γίνεται η εξίσωση (3):
꞊E˚- RTnFlncDdc EecAa aBb
όπου c(A), c(B), c(E), c(D) είναι οι συγκεντρώσεις των αντιδραστηρίων. Για τη θερμοκρασία δωματίου, αυτή η εξίσωση μπορεί να αναπαρασταθεί ως (4):
꞊E˚- 0,059nlncDdc EecAa aBb
Για ποτενσιομετρικές μετρήσεις, δύο ηλεκτρόδια χρησιμοποιούνται σε ένα ηλεκτροχημικό στοιχείο: ένα ηλεκτρόδιο δείκτη, το δυναμικό του οποίου εξαρτάται από τη συγκέντρωση της αναλυόμενης ουσίας (καθορίζοντας το δυναμικό) ουσία στο αναλυόμενο διάλυμα και ένα ηλεκτρόδιο αναφοράς, το δυναμικό του οποίου παραμένει σταθερό υπό συνθήκες ανάλυσης. Επομένως, το μέγεθος του EMF, που προσδιορίζεται από τις εξισώσεις (1)-(4), μπορεί να υπολογιστεί ως η διαφορά μεταξύ των πραγματικών δυναμικών αυτών των δύο ηλεκτροδίων.
Στην ποτενσιομετρία χρησιμοποιούνται οι ακόλουθοι τύποι ηλεκτροδίων: ηλεκτρόδια πρώτου, δεύτερου είδους, οξειδοαναγωγής, ηλεκτρόδια μεμβράνης.
Τα ηλεκτρόδια του πρώτου είδους είναι ηλεκτρόδια που είναι αναστρέψιμα από ένα κατιόν κοινό στο υλικό του ηλεκτροδίου. Υπάρχουν τρεις τύποι ηλεκτροδίων του πρώτου είδους.
α) Μέταλλο Μ βυθισμένο σε διάλυμα άλατος του ίδιου μετάλλου. Μια αναστρέψιμη αντίδραση εμφανίζεται στην επιφάνεια τέτοιων ηλεκτροδίων:
Mn+ + ne = M
Το πραγματικό δυναμικό ενός τέτοιου ηλεκτροδίου του πρώτου είδους εξαρτάται από τη δραστηριότητα a(Mn+) κατιόντων μετάλλων και περιγράφεται από τις εξισώσεις (5)-(8).
Γενικά, για οποιαδήποτε θερμοκρασία:
꞊E˚+ RTnFln a(Mn+)
Για θερμοκρασία δωματίου:
꞊E˚+ 0,059nln a(Mn+)
Σε χαμηλές συγκεντρώσεις c(Mn+), όταν η δραστηριότητα των κατιόντων μετάλλου a(Mn+) είναι περίπου ίση με τη συγκέντρωσή τους:
꞊E˚+ RTnFln c(Mn+)
Για θερμοκρασία δωματίου:
β) Ηλεκτρόδια αερίου, για παράδειγμα, ηλεκτρόδιο υδρογόνου, συμπεριλαμβανομένου του τυπικού ηλεκτροδίου υδρογόνου. Το δυναμικό ενός ηλεκτροδίου αερίου υδρογόνου που λειτουργεί αναστρέψιμα καθορίζεται από τη δραστηριότητα των ιόντων υδρογόνου, δηλ. η τιμή του pH του διαλύματος και σε θερμοκρασία δωματίου είναι ίση με:
꞊E˚+ 0,059 lg a(H30+) = 0,059 lg a(H3O+) = -0,059rН
δεδομένου ότι για ένα ηλεκτρόδιο υδρογόνου το τυπικό δυναμικό λαμβάνεται ως μηδέν ( £° =0), και σύμφωνα με την αντίδραση ηλεκτροδίου: H++e = N Ο αριθμός των ηλεκτρονίων που συμμετέχουν σε αυτή την αντίδραση είναι ίσος με ένα: n = 1. γ) Ηλεκτρόδια αμαλγάματος, τα οποία είναι ένα μεταλλικό αμάλγαμα βυθισμένο σε διάλυμα που περιέχει κατιόντα του ίδιου μετάλλου. Το δυναμικό τέτοιων ηλεκτροδίων του πρώτου είδους εξαρτάται από τη δραστηριότητα κατιόντων μετάλλου a(Mn+) σε διάλυμα και από τη δραστηριότητα ενός μετάλλου α(Μ) στο αμάλγαμα: ꞊E˚+ RTnFlna(Mn+)a(M) Τα ηλεκτρόδια αμαλγάματος είναι εξαιρετικά αναστρέψιμα. Τα ηλεκτρόδια του δεύτερου τύπου είναι αναστρέψιμα ανιόν. Οι ακόλουθοι τύποι ηλεκτροδίων του δεύτερου τύπου διακρίνονται. α) Ένα μέταλλο του οποίου η επιφάνεια είναι επικαλυμμένη με ένα ελάχιστα διαλυτό άλας του ίδιου μετάλλου, βυθισμένο σε διάλυμα που περιέχει τα ανιόντα που συνθέτουν αυτό το ελάχιστα διαλυτό άλας. Ένα παράδειγμα είναι το ηλεκτρόδιο χλωριούχου αργύρου AG | AGCL, KS1 ή το ηλεκτρόδιο Calomel HG | HG2CL2, KS1. Ένα ηλεκτρόδιο χλωριούχου αργύρου αποτελείται από ένα σύρμα αργύρου επικαλυμμένο με ένα ελαφρώς υδατοδιαλυτό άλας, AgCI, βυθισμένο σε ένα υδατικό διάλυμα χλωριούχου καλίου. Μια αναστρέψιμη αντίδραση εμφανίζεται στο ηλεκτρόδιο χλωριούχου αργύρου Το ηλεκτρόδιο καλομέλας αποτελείται από μεταλλικό υδράργυρο επικαλυμμένο με πάστα κακώς διαλυτού υδραργύρου(1) χλωριούχου Hg2Cl2 - καλομέλας, σε επαφή με υδατικό διάλυμα χλωριούχου καλίου. Μια αναστρέψιμη αντίδραση εμφανίζεται στο ηλεκτρόδιο Calomel: Cl2 + 2e = 2Hg + 2SG. Το πραγματικό δυναμικό των ηλεκτροδίων του δεύτερου είδους εξαρτάται από τη δραστηριότητα των ανιόντων και για ένα αναστρέψιμο ηλεκτρόδιο στο οποίο λαμβάνει χώρα η αντίδραση: Ne = M + An- περιγράφεται από τις εξισώσεις Nernst (9)-(12). Γενικά, σε οποιαδήποτε αποδεκτή θερμοκρασία T: ꞊E˚- RTnFln a(An-) Για θερμοκρασία δωματίου: ꞊E˚- 0,059nln a(An-) Για συνθήκες στις οποίες η δραστηριότητα των ανιόντων είναι περίπου ίση με τη συγκέντρωσή τους C (a "~): E꞊E˚- RTnFln c(An-) Για θερμοκρασία δωματίου: ꞊E˚- 0,059nln c(An-) Για παράδειγμα, τα πραγματικά δυναμικά Ε1 και Ε2 των ηλεκτροδίων χλωριούχου αργύρου και καλομέλης, αντίστοιχα, σε θερμοκρασία δωματίου μπορούν να αναπαρασταθούν ως: ꞊E1˚- 0,0591g a(Cl-),꞊E2˚- 0,0591g a(Cl-). Τα ηλεκτρόδια του δεύτερου τύπου είναι εξαιρετικά αναστρέψιμα και σταθερά στη λειτουργία τους, επομένως χρησιμοποιούνται συχνά ως ηλεκτρόδια αναφοράς ικανά να διατηρούν σταθερά μια σταθερή τιμή δυναμικού. β) Ηλεκτρόδια αερίου του δεύτερου τύπου, για παράδειγμα, ηλεκτρόδιο χλωρίου Pt, Cl2 KS1. Τα ηλεκτρόδια αερίου του δεύτερου τύπου χρησιμοποιούνται σπάνια στην ποσοτική ποτενσιομετρική ανάλυση. Τα ηλεκτρόδια οξειδοαναγωγής αποτελούνται από ένα αδρανές υλικό (πλατίνα, χρυσός, βολφράμιο, τιτάνιο, γραφίτης κ.λπ.) βυθισμένο σε διάλυμα που περιέχει οξειδωμένο Ox και ανηγμένες Ερυθρές μορφές αυτής της ουσίας. Υπάρχουν δύο τύποι ηλεκτροδίων οξειδοαναγωγής: α) ηλεκτρόδια των οποίων το δυναμικό δεν εξαρτάται από τη δραστηριότητα ιόντων υδρογόνου, για παράδειγμα, Pt | FeCl3, FeCI2, Pt | Κ3, Κ4, κ.λπ. β) ηλεκτρόδια των οποίων το δυναμικό εξαρτάται από τη δραστηριότητα ιόντων υδρογόνου, για παράδειγμα, ηλεκτρόδιο κινυδρόνης. Στο ηλεκτρόδιο οξειδοαναγωγής, το δυναμικό του οποίου δεν εξαρτάται από τη δραστηριότητα των ιόντων υδρογόνου, εμφανίζεται μια αναστρέψιμη αντίδραση: Ox + ne = Κόκκινο Το πραγματικό δυναμικό ενός τέτοιου ηλεκτροδίου οξειδοαναγωγής εξαρτάται από τη δραστηριότητα των οξειδωμένων και ανηγμένων μορφών μιας δεδομένης ουσίας και για ένα αναστρέψιμα λειτουργικό ηλεκτρόδιο περιγράφεται, ανάλογα με τις συνθήκες (κατ' αναλογία με τα δυναμικά που αναφέρθηκαν παραπάνω), από τις εξισώσεις Nernst ( 13)-(16): ꞊E˚+ RTnFln a (Ox)a (Κόκκινο)꞊E˚+ 0,059nlg a (Ox)a (Κόκκινο)꞊E˚+ RTnFln c(Ox)c (Κόκκινο)꞊E˚+ 0,059nlg c (Ox) γ(Κόκκινο) Εάν τα ιόντα υδρογόνου συμμετέχουν στην αντίδραση του ηλεκτροδίου, τότε η δραστηριότητά τους (συγκέντρωση) λαμβάνεται υπόψη στις αντίστοιχες εξισώσεις Nernst για κάθε συγκεκριμένη περίπτωση. Τα ηλεκτρόδια μεμβράνης ή ιοντοεκλεκτικά είναι ηλεκτρόδια που είναι αναστρέψιμα για ορισμένα ιόντα (κατιόντα ή ανιόντα) που απορροφώνται από μια στερεή ή υγρή μεμβράνη. Το πραγματικό δυναμικό τέτοιων ηλεκτροδίων εξαρτάται από τη δραστηριότητα εκείνων των ιόντων στο διάλυμα που απορροφώνται από τη μεμβράνη. Τα ηλεκτρόδια στερεάς μεμβράνης περιέχουν μια πολύ λεπτή μεμβράνη, στις δύο πλευρές της οποίας υπάρχουν διαφορετικά διαλύματα που περιέχουν τα ίδια ιόντα προς προσδιορισμό, αλλά με διαφορετικές συγκεντρώσεις: ένα διάλυμα (πρότυπο) με μια επακριβώς γνωστή συγκέντρωση των προς προσδιορισμό ιόντων και διάλυμα που θα αναλυθεί με άγνωστη συγκέντρωση των ιόντων που θα προσδιοριστούν. Λόγω των διαφορετικών συγκεντρώσεων ιόντων και στα δύο διαλύματα, τα ιόντα σε διαφορετικές πλευρές της μεμβράνης απορροφώνται σε άνισες ποσότητες και το ηλεκτρικό φορτίο που προκύπτει από την ρόφηση ιόντων σε διαφορετικές πλευρές της μεμβράνης είναι επίσης διαφορετικό. Ως αποτέλεσμα, προκύπτει μια διαφορά δυναμικού μεμβράνης. Ο προσδιορισμός των ιόντων με τη χρήση ηλεκτροδίων επιλεκτικών ιόντων μεμβράνης ονομάζεται ιονομετρία. Όπως αναφέρθηκε παραπάνω, στις ποτενσιομετρικές μετρήσεις, το ηλεκτροχημικό στοιχείο περιλαμβάνει δύο ηλεκτρόδια - ένα ηλεκτρόδιο δείκτη και ένα ηλεκτρόδιο αναφοράς. Το μέγεθος του EMF που δημιουργείται στο στοιχείο είναι ίσο με τη διαφορά δυναμικού μεταξύ αυτών των δύο ηλεκτροδίων. Δεδομένου ότι το δυναμικό του ηλεκτροδίου αναφοράς παραμένει σταθερό υπό τις συνθήκες ποτενσιομετρικού προσδιορισμού, το EMF εξαρτάται μόνο από το δυναμικό του ηλεκτροδίου δείκτη, δηλ. σχετικά με τις δραστηριότητες (συγκεντρώσεις) ορισμένων ιόντων σε διάλυμα. Αυτή είναι η βάση για τον ποτενσιομετρικό προσδιορισμό της συγκέντρωσης μιας δεδομένης ουσίας στο αναλυόμενο διάλυμα. Για τον ποτενσιομετρικό προσδιορισμό της συγκέντρωσης μιας ουσίας σε ένα διάλυμα, χρησιμοποιούνται τόσο η άμεση ποτενσιομετρία όσο και η ποτενσιομετρική τιτλοδότηση, αν και η δεύτερη μέθοδος χρησιμοποιείται πολύ πιο συχνά από την πρώτη. Ο προσδιορισμός της συγκέντρωσης μιας ουσίας στην άμεση ποτενσιομετρία πραγματοποιείται συνήθως χρησιμοποιώντας τη μέθοδο της καμπύλης βαθμονόμησης ή την τυπική μέθοδο προσθήκης. α) Μέθοδος γραφήματος βαθμονόμησης. Παρασκευάστε μια σειρά 5-7 τυπικών διαλυμάτων με γνωστή περιεκτικότητα της αναλυόμενης ουσίας. Η συγκέντρωση της αναλυόμενης ουσίας και η ιοντική ισχύς στα πρότυπα διαλύματα δεν πρέπει να διαφέρουν πολύ από τη συγκέντρωση και την ιοντική ισχύ του αναλυόμενου διαλύματος: υπό αυτές τις συνθήκες, τα σφάλματα προσδιορισμού μειώνονται. Η ιοντική ισχύς όλων των διαλυμάτων διατηρείται σταθερή με την εισαγωγή ενός αδιάφορου ηλεκτρολύτη. Τα τυπικά διαλύματα εισάγονται διαδοχικά σε ένα ηλεκτροχημικό (ποτενσιομετρικό) στοιχείο. Συνήθως αυτό το στοιχείο είναι ένα γυάλινο ποτήρι ζέσεως στο οποίο τοποθετούνται ένα ηλεκτρόδιο δείκτη και ένα ηλεκτρόδιο αναφοράς. Το EMF των τυποποιημένων διαλυμάτων μετράται πλένοντας σχολαστικά τα ηλεκτρόδια και το γυαλί με απεσταγμένο νερό πριν γεμίσει το στοιχείο με κάθε πρότυπο διάλυμα. Με βάση τα δεδομένα που ελήφθησαν, κατασκευάζεται ένα γράφημα βαθμονόμησης σε συντεταγμένες EMF-log c, όπου c είναι η συγκέντρωση της αναλυόμενης ουσίας στο πρότυπο διάλυμα. Συνήθως αυτό το γράφημα είναι μια ευθεία γραμμή. Στη συνέχεια το αναλυόμενο διάλυμα προστίθεται στην ηλεκτροχημική κυψέλη (μετά το πλύσιμο της κυψέλης με απεσταγμένο νερό) και μετράται το emf του στοιχείου. Χρησιμοποιώντας το γράφημα βαθμονόμησης, βρίσκεται το log c(X), όπου c(X) είναι η συγκέντρωση της αναλυόμενης ουσίας στο αναλυόμενο διάλυμα. β) Τυπική μέθοδος προσθήκης. Ένας γνωστός όγκος V(X) του αναλυόμενου διαλύματος με συγκέντρωση c(X) προστίθεται στο ηλεκτροχημικό στοιχείο και μετράται το emf του στοιχείου. Στη συνέχεια, ένας επακριβώς μετρημένος μικρός όγκος ενός τυπικού διαλύματος V(st) με γνωστή, επαρκώς μεγάλη συγκέντρωση c(st) της αναλυόμενης ουσίας προστίθεται στο ίδιο διάλυμα και προσδιορίζεται ξανά το emf του κυττάρου. Υπολογίστε τη συγκέντρωση c(X) της αναλυόμενης ουσίας στο αναλυόμενο διάλυμα χρησιμοποιώντας τον τύπο (10.17): c(X)= c(st) V (st)V X+ V (st) Οπου △ E είναι η διαφορά μεταξύ δύο μετρούμενων τιμών EMF, n είναι ο αριθμός των ηλεκτρονίων που συμμετέχουν στην αντίδραση του ηλεκτροδίου. Εφαρμογή άμεσης ποτενσιομετρίας. Η μέθοδος χρησιμοποιείται για τον προσδιορισμό της συγκέντρωσης των ιόντων υδρογόνου (pH των διαλυμάτων), των ανιόντων και των ιόντων μετάλλων (ιονομετρία). Όταν χρησιμοποιείται άμεση ποτενσιομετρία, η επιλογή ενός κατάλληλου ηλεκτροδίου δείκτη και η ακριβής μέτρηση του δυναμικού ισορροπίας διαδραματίζουν σημαντικό ρόλο. Κατά τον προσδιορισμό του pH των διαλυμάτων, χρησιμοποιούνται ηλεκτρόδια ως ηλεκτρόδια δείκτη, το δυναμικό των οποίων εξαρτάται από τη συγκέντρωση ιόντων υδρογόνου: γυαλί, υδρογόνο, κινυδρόνη και μερικά άλλα. Συχνότερα χρησιμοποιείται ένα γυάλινο ηλεκτρόδιο μεμβράνης που είναι αναστρέψιμο σε ιόντα υδρογόνου. Το δυναμικό ενός τέτοιου ηλεκτροδίου γυαλιού προσδιορίζεται από τη συγκέντρωση ιόντων υδρογόνου, επομένως το EMF ενός κυκλώματος που περιλαμβάνει ένα γυάλινο ηλεκτρόδιο ως δείκτη περιγράφεται σε θερμοκρασία δωματίου από την εξίσωση: K + 0,059rN, όπου η σταθερά Κ εξαρτάται από το υλικό της μεμβράνης και τη φύση του ηλεκτροδίου αναφοράς. Το γυάλινο ηλεκτρόδιο σας επιτρέπει να προσδιορίσετε το pH στην περιοχή pH = 0-10 (πιο συχνά στην περιοχή pH = 2-10) και είναι εξαιρετικά αναστρέψιμο και σταθερό στη λειτουργία. Το ηλεκτρόδιο κινυδρόνης, που χρησιμοποιείται συχνά στο παρελθόν, είναι ένα ηλεκτρόδιο οξειδοαναγωγής του οποίου το δυναμικό εξαρτάται από τη συγκέντρωση ιόντων υδρογόνου. Αποτελείται από ένα σύρμα πλατίνας βυθισμένο σε διάλυμα οξέος (συνήθως HC1) κορεσμένο με κινυδρόνη, μια ισομοριακή ένωση κινόνης και υδροκινόνης με τη σύνθεση C6H402 C6H4(OH)2 (σκούρα πράσινη σκόνη, ελαφρώς διαλυτή στο νερό). Σχηματικός χαρακτηρισμός ηλεκτροδίου κινυδρόνης: Pt | κινυδρόνη, HC1. Μια αντίδραση οξειδοαναγωγής εμφανίζεται στο ηλεκτρόδιο κινυδρόνης: C6H402 + 2H+ + 2e = C6H4(OH)2 Το δυναμικό του ηλεκτροδίου κινυδρόνης σε θερμοκρασία δωματίου περιγράφεται από τον τύπο E°-0,059ρΝ. Το ηλεκτρόδιο κινυδρόνης σάς επιτρέπει να μετράτε το pH των διαλυμάτων στην περιοχή pH = 0-8,5. Σε pH< 0 хингидрон гидролитически расщепляется: при рН >8.5 Η υδροκινόνη, η οποία είναι ασθενές οξύ, υφίσταται αντίδραση εξουδετέρωσης.Το ηλεκτρόδιο κινυδρόνης δεν μπορεί να χρησιμοποιηθεί παρουσία ισχυρών οξειδωτικών και αναγωγικών παραγόντων. Τα επιλεκτικά ηλεκτρόδια μεμβράνης χρησιμοποιούνται, όπως σημειώθηκε παραπάνω, στην ιονομετρία ως δείκτες για τον προσδιορισμό διαφόρων κατιόντων (Li+, Na+, K+ Mg2t, Ca2+, Cd2+, Fe2+, Ni2+, κ.λπ.) ιόντων (F-, Cl-, Br-, I-, S2-, κ.λπ.). Τα πλεονεκτήματα της άμεσης ποτενσιομετρίας περιλαμβάνουν την απλότητα και την ταχύτητα των μετρήσεων· οι μετρήσεις απαιτούν μικρούς όγκους διαλυμάτων. 3 Ποτενιομετρική ογκομέτρηση Η ποτενσιομετρική τιτλοδότηση είναι μια μέθοδος προσδιορισμού του όγκου του τιτλοδοτητή που δαπανάται για την ογκομέτρηση της αναλυόμενης ουσίας στο αναλυόμενο διάλυμα με μέτρηση του EMF (κατά τη διαδικασία τιτλοδότησης) χρησιμοποιώντας ένα γαλβανικό κύκλωμα που αποτελείται από ένα ηλεκτρόδιο δείκτη και ένα ηλεκτρόδιο αναφοράς. Στην ποτενσιομετρική τιτλοδότηση, το αναλυόμενο διάλυμα που βρίσκεται σε μια ηλεκτροχημική κυψέλη τιτλοδοτείται ένας κατάλληλος τιτλοδοτητής, που καθορίζει το τέλος της ογκομέτρησης με μια απότομη αλλαγή στο EMF του μετρούμενου κυκλώματος - το δυναμικό του ηλεκτροδίου δείκτη, το οποίο εξαρτάται από τη συγκέντρωση των αντίστοιχων ιόντων και αλλάζει απότομα στο σημείο ισοδυναμίας. Η μεταβολή του δυναμικού του ηλεκτροδίου δείκτη κατά τη διάρκεια της διαδικασίας τιτλοδότησης μετράται ανάλογα με τον όγκο του προστιθέμενου τιτλοδοτητή. Με βάση τα δεδομένα που ελήφθησαν, κατασκευάζεται μια ποτενσιομετρική καμπύλη τιτλοδότησης και ο όγκος του τιτλοδοτούμενου που καταναλώνεται στην κυψέλη καυσίμου προσδιορίζεται από αυτήν την καμπύλη. Η ποτενσιομετρική ογκομέτρηση δεν απαιτεί τη χρήση ενδείξεων που αλλάζουν χρώμα κοντά στο στοιχείο καυσίμου. Εφαρμογή ποτενσιομετρικής ογκομέτρησης. Η μέθοδος είναι καθολική· μπορεί να χρησιμοποιηθεί για να δείξει το τέλος της τιτλοδότησης σε όλους τους τύπους τιτλοδότησης: οξεοβασική, οξειδοαναγωγική, πολυπλοκομετρική, καθίζηση και κατά την τιτλοδότηση σε μη υδατικά μέσα. Ως ηλεκτρόδια δείκτη χρησιμοποιούνται ηλεκτρόδια γυαλιού, υδραργύρου, επιλεκτικών ιόντων, πλατίνας και αργύρου και ως ηλεκτρόδια αναφοράς χρησιμοποιούνται ηλεκτρόδια καλομέλας, χλωριούχου αργύρου και γυαλιού. Η μέθοδος έχει υψηλή ακρίβεια και μεγάλη ευαισθησία: επιτρέπει την τιτλοδότηση σε θολά, έγχρωμα, μη υδατικά μέσα και τον χωριστό προσδιορισμό των συστατικών του μείγματος σε ένα αναλυόμενο διάλυμα, για παράδειγμα, τον ξεχωριστό προσδιορισμό ιόντων χλωρίου και ιωδίου κατά την αργεντομετρική τιτλοδότηση. Οι μέθοδοι ποτενσιομετρικής τιτλοδότησης χρησιμοποιούνται για την ανάλυση πολλών φαρμακευτικών ουσιών, για παράδειγμα, ασκορβικό οξύ, θειικά φάρμακα, βαρβιτουρικά, αλκαλοειδή κ.λπ. Ιδρυτής της αγωγιμότητας ανάλυσης θεωρείται ο Γερμανός φυσικός και φυσικοχημικός F.V.G. Kohlrausch (1840-1910), ο οποίος για πρώτη φορά το 1885 πρότεινε μια εξίσωση που καθιερώνει μια σχέση μεταξύ της ηλεκτρικής αγωγιμότητας των διαλυμάτων ισχυρών ηλεκτρολυτών και της συγκέντρωσής τους. ΣΕ μέσα της δεκαετίας του '40 ΧΧ αιώνα αναπτύχθηκε μια μέθοδος τιτλοδότησης αγωγιμότητας υψηλής συχνότητας. Από τις αρχές της δεκαετίας του '60. ΧΧ αιώνα Οι αγωγομετρικοί ανιχνευτές άρχισαν να χρησιμοποιούνται στην υγρή χρωματογραφία. 1 Αρχή της μεθόδου. ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Η αγωγομετρική ανάλυση (αγωγιμότητα) βασίζεται στη χρήση της σχέσης μεταξύ της ηλεκτρικής αγωγιμότητας (ηλεκτρικής αγωγιμότητας) των διαλυμάτων ηλεκτρολυτών και της συγκέντρωσής τους. Η ηλεκτρική αγωγιμότητα των διαλυμάτων ηλεκτρολυτών - αγωγών του δεύτερου τύπου - κρίνεται με βάση τη μέτρηση της ηλεκτρικής τους αντίστασης σε ένα ηλεκτροχημικό στοιχείο, το οποίο είναι ένα γυάλινο δοχείο (γυαλί) με δύο ηλεκτρόδια κολλημένα μέσα σε αυτό, μεταξύ των οποίων βρίσκεται το διάλυμα του δοκιμαστικού ηλεκτρολύτη. που βρίσκεται. Ένα εναλλασσόμενο ηλεκτρικό ρεύμα περνά μέσα από το στοιχείο. Τα ηλεκτρόδια κατασκευάζονται συχνότερα από μεταλλική πλατίνα, η οποία, για να αυξηθεί η επιφάνεια των ηλεκτροδίων, επικαλύπτεται με ένα στρώμα σπογγώδους πλατίνας με ηλεκτροχημική εναπόθεση ενώσεων πλατίνας από διαλύματα (πλατινοποιημένα ηλεκτρόδια πλατίνας). Για να αποφευχθούν επιπλοκές που σχετίζονται με τις διαδικασίες ηλεκτρόλυσης και πόλωσης, πραγματοποιούνται αγωγομετρικές μετρήσεις σε εναλλασσόμενο ηλεκτρικό πεδίο. Η ηλεκτρική αντίσταση R του στρώματος του διαλύματος ηλεκτρολύτη μεταξύ των ηλεκτροδίων, όπως η ηλεκτρική αντίσταση των αγωγών του πρώτου είδους, είναι ευθέως ανάλογη με το μήκος (πάχος) l αυτού του στρώματος και αντιστρόφως ανάλογη με την επιφάνεια S των ηλεκτροδίων: R= ρ lS lkS όπου ο συντελεστής αναλογικότητας p ονομάζεται ειδική ηλεκτρική αντίσταση, και η αντίστροφη τιμή k = 1/p ονομάζεται ειδική ηλεκτρική αγωγιμότητα (ηλεκτρική αγωγιμότητα). Δεδομένου ότι η ηλεκτρική αντίσταση R μετριέται σε ohms, το πάχος l του στρώματος διαλύματος ηλεκτρολύτη είναι σε cm και η επιφάνεια S των ηλεκτροδίων είναι σε cm2, η ειδική ηλεκτρική αγωγιμότητα k μετριέται σε μονάδες Ohm-1 cm-1, ή, αφού το Ohm-1 είναι Siemens (Sm), τότε - σε μονάδες Sm cm-1. Στη φυσική της έννοια, ειδική ηλεκτρική αγωγιμότητα είναι η ηλεκτρική αγωγιμότητα ενός στρώματος ηλεκτρολύτη που βρίσκεται μεταξύ των πλευρών ενός κύβου με μήκος πλευράς 1 cm, αριθμητικά ίσο με το ρεύμα που διέρχεται από ένα στρώμα διαλύματος ηλεκτρολύτη με εμβαδόν διατομής 1 cm2 με εφαρμοσμένη κλίση ηλεκτρικής δυναμικής 1 V/cm. Η ειδική ηλεκτρική αγωγιμότητα εξαρτάται από τη φύση του ηλεκτρολύτη και του διαλύτη, τη συγκέντρωση του διαλύματος και τη θερμοκρασία. Με την αύξηση της συγκέντρωσης του διαλύματος ηλεκτρολύτη, η ειδική ηλεκτρική αγωγιμότητά του πρώτα αυξάνεται, μετά περνά από ένα μέγιστο και στη συνέχεια μειώνεται. Αυτή η φύση της αλλαγής της ηλεκτρικής αγωγιμότητας οφείλεται στους ακόλουθους λόγους. Αρχικά, με την αύξηση της συγκέντρωσης του ηλεκτρολύτη, ο αριθμός των ιόντων - σωματιδίων που φέρουν ρεύμα - αυξάνεται τόσο για ισχυρούς όσο και για ασθενείς ηλεκτρολύτες. Επομένως, η ηλεκτρική αγωγιμότητα του διαλύματος (ηλεκτρικό ρεύμα που το διέρχεται) αυξάνεται. Στη συνέχεια, καθώς αυξάνεται η συγκέντρωση του διαλύματος, το ιξώδες του (μειώνοντας την ταχύτητα κίνησης των ιόντων) και οι ηλεκτροστατικές αλληλεπιδράσεις μεταξύ των ιόντων αυξάνονται, γεγονός που εμποδίζει την αύξηση του ηλεκτρικού ρεύματος και, σε αρκετά υψηλές συγκεντρώσεις, βοηθά στη μείωσή του. Σε διαλύματα αδύναμων ηλεκτρολυτών, καθώς αυξάνεται η συγκέντρωση, ο βαθμός διάστασης των μορίων του ηλεκτρολύτη μειώνεται, γεγονός που οδηγεί σε μείωση του αριθμού των ιόντων - αγώγιμων σωματιδίων - και σε μείωση της ειδικής ηλεκτρικής αγωγιμότητας. Σε διαλύματα ισχυρών ηλεκτρολυτών σε υψηλές συγκεντρώσεις, είναι δυνατός ο σχηματισμός ιοντικών συσχετισμών (ιονικά δίδυμα, μπλουζάκια κ.λπ.), γεγονός που ευνοεί επίσης τη μείωση της ηλεκτρικής αγωγιμότητας. Η ειδική ηλεκτρική αγωγιμότητα των διαλυμάτων ηλεκτρολυτών αυξάνεται με την αύξηση της θερμοκρασίας λόγω μείωσης του ιξώδους των διαλυμάτων, η οποία οδηγεί σε αύξηση της ταχύτητας κίνησης των ιόντων και για ασθενείς ηλεκτρολύτες, επίσης σε αύξηση του βαθμού ιονισμού τους (διάσπαση σε ιόντα). Επομένως, οι ποσοτικές αγωγομετρικές μετρήσεις πρέπει να πραγματοποιούνται σε σταθερή θερμοκρασία, θερμοστατώντας το αγωγομετρικό στοιχείο. Εκτός από την ειδική ηλεκτρική αγωγιμότητα, η αγωγιμότητα χρησιμοποιεί ισοδύναμη ηλεκτρική αγωγιμότητα X και μοριακή ηλεκτρική αγωγιμότητα p. Από φυσική άποψη, η ισοδύναμη ηλεκτρική αγωγιμότητα X είναι η ηλεκτρική αγωγιμότητα ενός στρώματος διαλύματος ηλεκτρολύτη πάχους 1 cm που βρίσκεται μεταξύ πανομοιότυπων ηλεκτροδίων με τέτοια επιφάνεια ώστε ο όγκος του διαλύματος ηλεκτρολύτη που περικλείεται μεταξύ τους να περιέχει 1 g-ισοδύναμο της διαλυμένης ουσίας. Στην περίπτωση αυτή, η μοριακή μάζα του ισοδύναμου λαμβάνεται ως η μοριακή μάζα πανομοιότυπων σωματιδίων με μοναδιαίο αριθμό φορτίου («φόρτιση»), για παράδειγμα, H+, Br -, 12Ca2+, 13Fe3+, κ.λπ. Η ισοδύναμη ηλεκτρική αγωγιμότητα αυξάνεται με τη μείωση της συγκέντρωσης του διαλύματος ηλεκτρολύτη. Η μέγιστη τιμή ισοδύναμης ηλεκτρικής αγωγιμότητας επιτυγχάνεται με άπειρη αραίωση του διαλύματος. Η ισοδύναμη ηλεκτρική αγωγιμότητα, όπως και η ειδική αγωγιμότητα, αυξάνεται με την αύξηση της θερμοκρασίας. Η ισοδύναμη ηλεκτρική αγωγιμότητα X σχετίζεται με την ειδική ηλεκτρική αγωγιμότητα k από τη σχέση (20): λ= 1000 kc Στην άμεση αγωγιμότητα, η συγκέντρωση μιας ουσίας στο αναλυόμενο διάλυμα προσδιορίζεται από τα αποτελέσματα των μετρήσεων της ειδικής ηλεκτρικής αγωγιμότητας αυτού του διαλύματος. Κατά την επεξεργασία δεδομένων μετρήσεων, χρησιμοποιούνται δύο μέθοδοι: η μέθοδος υπολογισμού και η μέθοδος γραφήματος βαθμονόμησης. Μέθοδος υπολογισμού. Σύμφωνα με την εξίσωση (10.20), η μοριακή συγκέντρωση του ισοδύναμου c του ηλεκτρολύτη στο διάλυμα μπορεί να υπολογιστεί εάν η ειδική ηλεκτρική αγωγιμότητα k και η ισοδύναμη ηλεκτρική αγωγιμότητα είναι γνωστές : c = 1000 kλ Η ειδική ηλεκτρική αγωγιμότητα προσδιορίζεται πειραματικά με βάση τη μέτρηση της ηλεκτρικής αντίστασης ενός θερμοστατημένου αγωγομετρικού στοιχείου. Ισοδύναμη ηλεκτρική αγωγιμότητα του διαλύματος λ ίσο με το άθροισμα των κινητικότητας κατιόντων λ+ και ανιόν Χ λ -:
λ = λ + + λ-
Εάν η κινητικότητα του κατιόντος και του ανιόντος είναι γνωστές, τότε η συγκέντρωση μπορεί να υπολογιστεί χρησιμοποιώντας τον τύπο (24): c = 1000 kλ · + + λ- Αυτό γίνεται όταν προσδιορίζεται με άμεση αγωγιμότητα η συγκέντρωση ενός ελάχιστα διαλυτού ηλεκτρολύτη στο κορεσμένο διάλυμά του (ασβέστιο, θειικά βάριο, αλογονίδια αργύρου κ.λπ.). Μέθοδος γραφήματος βαθμονόμησης. Παρασκευάζεται μια σειρά τυποποιημένων διαλυμάτων, καθένα από τα οποία περιέχει μια επακριβώς γνωστή συγκέντρωση της αναλυόμενης ουσίας και η ηλεκτρική τους αγωγιμότητα μετράται σε σταθερή θερμοκρασία σε ένα θερμοστατημένο αγωγόμετρο στοιχείο. Με βάση τα δεδομένα που ελήφθησαν, κατασκευάζεται ένα γράφημα βαθμονόμησης, όπου απεικονίζεται η συγκέντρωση των τυπικών διαλυμάτων στον άξονα της τετμημένης και οι τιμές της ειδικής ηλεκτρικής αγωγιμότητας κατά μήκος του άξονα τεταγμένων. Σύμφωνα με την εξίσωση (24), η γραφική παράσταση αντιπροσωπεύει συνήθως μια ευθεία γραμμή σε ένα σχετικά μικρό εύρος μεταβολών συγκέντρωσης. Σε ένα ευρύ φάσμα συγκεντρώσεων, όταν η κινητικότητα του κατιόντος και του ανιόντος που περιλαμβάνονται στην εξίσωση (24) μπορεί να αλλάξει αισθητά, παρατηρούνται αποκλίσεις από τη γραμμική εξάρτηση. Στη συνέχεια, αυστηρά υπό τις ίδιες συνθήκες, μετράται η ειδική ηλεκτρική αγωγιμότητα k(X) του ηλεκτρολύτη που προσδιορίζεται στο αναλυόμενο διάλυμα με άγνωστη συγκέντρωση c(X) και βρίσκεται η επιθυμητή τιμή c(X) από το γράφημα. Έτσι προσδιορίζεται, για παράδειγμα, η περιεκτικότητα σε βάριο στο νερό βαρίτη - ένα κορεσμένο διάλυμα υδροξειδίου του βαρίου. Εφαρμογή άμεσης αγωγιμότητας. Η μέθοδος της άμεσης αγωγιμότητας χαρακτηρίζεται από απλότητα και υψηλή ευαισθησία. Ωστόσο, η μέθοδος δεν είναι πολύ επιλεκτική. Η άμεση αγωγιμότητα έχει περιορισμένη χρήση στην ανάλυση. Χρησιμοποιείται για τον προσδιορισμό της διαλυτότητας των ελάχιστα διαλυτών ηλεκτρολυτών, για τον έλεγχο της ποιότητας του απεσταγμένου νερού και των υγρών προϊόντων διατροφής (γάλα, ποτά, κ.λπ.), για τον προσδιορισμό της συνολικής περιεκτικότητας σε αλάτι σε μεταλλικά, θαλάσσια, ποτάμια και σε ορισμένες άλλες περιπτώσεις. . 3 Αγωγομετρική ογκομέτρηση Στην αγωγομετρική ογκομέτρηση, η πρόοδος της ογκομέτρησης παρακολουθείται με αλλαγές στην ηλεκτρική αγωγιμότητα του αναλυόμενου διαλύματος που βρίσκεται σε ένα αγωγομετρικό στοιχείο μεταξύ δύο αδρανών ηλεκτροδίων (συνήθως κατασκευασμένα από επιπλατινοποιημένη πλατίνα). Με βάση τα δεδομένα που ελήφθησαν, σχεδιάζεται μια αγωγομετρική καμπύλη τιτλοδότησης, η οποία αντικατοπτρίζει την εξάρτηση της ηλεκτρικής αγωγιμότητας του τιτλοδοτημένου διαλύματος από τον όγκο του προστιθέμενου τιτλοδοτητή. Το τελικό σημείο της ογκομέτρησης εντοπίζεται συχνότερα με παρέκταση τμημάτων της καμπύλης ογκομέτρησης στην περιοχή όπου αλλάζει η κλίση της.Σε αυτή την περίπτωση δεν απαιτείται η χρήση δεικτών που αλλάζουν χρώμα κοντά στο ΤΕ. Στην αγωγομετρική τιτλοδότηση, χρησιμοποιούνται διάφοροι τύποι αντιδράσεων: διεργασίες οξέος-βάσης, οξειδοαναγωγής, καθίζησης, συμπλοκοποίησης. Εφαρμογή αγωγιμότητας ογκομέτρησης. Η μέθοδος αγωγιμότητας ογκομέτρησης έχει μια σειρά από πλεονεκτήματα. Η ογκομέτρηση μπορεί να πραγματοποιηθεί σε θολά, έγχρωμα, αδιαφανή μέσα. Η ευαισθησία της μεθόδου είναι αρκετά υψηλή - έως ~10~* mol/l. το σφάλμα προσδιορισμού κυμαίνεται από 0,1 έως 2%. Η ανάλυση μπορεί να αυτοματοποιηθεί. Τα μειονεκτήματα της μεθόδου περιλαμβάνουν χαμηλή επιλεκτικότητα. Η έννοια της αγωγομετρικής τιτλοδότησης υψηλής συχνότητας (ραδιοσυχνότητας). Η πρόοδος της ογκομέτρησης παρακολουθείται χρησιμοποιώντας μια τροποποιημένη αγωγομετρική τεχνική εναλλασσόμενου ρεύματος, στην οποία η συχνότητα εναλλασσόμενου ρεύματος μπορεί να φτάσει της τάξης του ενός εκατομμυρίου ταλαντώσεων ανά δευτερόλεπτο. Τυπικά, τα ηλεκτρόδια τοποθετούνται (εφαρμόζονται) στο εξωτερικό του δοχείου τιτλοδότησης (στοιχείο αγωγιμότητας) έτσι ώστε να μην έρχονται σε επαφή με το διάλυμα που τιτλοδοτείται. Με βάση τα αποτελέσματα των μετρήσεων, σχεδιάζεται μια αγωγομετρική καμπύλη ογκομέτρησης. Το τελικό σημείο της ογκομέτρησης βρίσκεται με παρέκταση τμημάτων της καμπύλης ογκομέτρησης στην περιοχή όπου αλλάζει η κλίση της. ΚΕΦΑΛΑΙΟ 4. ΑΓΩΓΟΜΕΤΡΙΚΗ ΑΝΑΛΥΣΗ (ΑΓΩΓΟΜΕΤΡΙΑ) 4.1 Η ουσία της μεθόδου Η πολαρογραφική ανάλυση (πολαρογραφία) βασίζεται στη χρήση των ακόλουθων σχέσεων μεταξύ των ηλεκτρικών παραμέτρων ενός ηλεκτροχημικού (σε αυτήν την περίπτωση, πολογραφικού) στοιχείου, στο οποίο εφαρμόζεται εξωτερικό δυναμικό, και των ιδιοτήτων του αναλυόμενου διαλύματος που περιέχεται σε αυτό. α) Η ποιοτική πολογραφική ανάλυση χρησιμοποιεί τη σχέση μεταξύ του μεγέθους του εξωτερικού ηλεκτρικού δυναμικού που εφαρμόζεται στο μικροηλεκτρόδιο, στο οποίο παρατηρείται μείωση (ή οξείδωση) της αναλυόμενης ουσίας στο μικροηλεκτρόδιο υπό δεδομένες συνθήκες, και της φύσης της ουσίας που μειώνεται (ή οξειδωμένο). β) Στην ποσοτική πολογραφική ανάλυση χρησιμοποιείται η σχέση μεταξύ του μεγέθους του ηλεκτρικού ρεύματος διάχυσης και της συγκέντρωσης της ουσίας που προσδιορίζεται (αναγωγική ή οξειδωτική) στο αναλυόμενο διάλυμα. Οι ηλεκτρικές παράμετροι - το μέγεθος του εφαρμοζόμενου ηλεκτρικού δυναμικού και το μέγεθος του ρεύματος διάχυσης - προσδιορίζονται αναλύοντας τις προκύπτουσες καμπύλες πόλωσης ή ρεύματος-τάσης, οι οποίες αντικατοπτρίζουν γραφικά την εξάρτηση του ηλεκτρικού ρεύματος στο πολογραφικό στοιχείο από το μέγεθος του το εφαρμοζόμενο δυναμικό του μικροηλεκτροδίου. Ως εκ τούτου, η πολογραφία μερικές φορές ονομάζεται άμεση βολταμετρία. Η κλασική πολογραφική μέθοδος ανάλυσης με χρήση ηλεκτροδίου πτώσης υδραργύρου αναπτύχθηκε και προτάθηκε το 1922 από τον Τσέχο επιστήμονα Jaroslav Heyrovsky (1890-1967), αν και το ίδιο το ηλεκτρόδιο πτώσης υδραργύρου χρησιμοποιήθηκε από τον Τσέχο φυσικό B. Kucera το 1903. Το 1925 Οι J. Heyrovsky και M. Shikata σχεδίασαν τον πρώτο πολαρογράφο, ο οποίος κατέστησε δυνατή την αυτόματη καταγραφή των καμπυλών πόλωσης. Στη συνέχεια, αναπτύχθηκαν διάφορες τροποποιήσεις της πολαρογραφικής μεθόδου. Η τιμή του μέσου iD ρεύματος διάχυσης προσδιορίζεται από την εξίσωση Ilkovich (25): όπου K είναι ο συντελεστής αναλογικότητας, c είναι η συγκέντρωση (mmol/l) της πολογραφικά δραστικής ουσίας εκπόλωσης. Το iD μετράται σε μικροαμπέρ ως η διαφορά μεταξύ του περιοριστικού ρεύματος και του υπολειπόμενου ρεύματος. Ο συντελεστής αναλογικότητας K στην εξίσωση Ilkovich εξαρτάται από έναν αριθμό παραμέτρων και είναι ίσος με Κ=607nD12m23τ16 όπου n είναι ο αριθμός των ηλεκτρονίων που συμμετέχουν στην αντίδραση οξειδοαναγωγής του ηλεκτροδίου. D είναι ο συντελεστής διάχυσης της αναγωγικής ουσίας (cm2/s). t είναι η μάζα του υδραργύρου που ρέει από το τριχοειδές ανά δευτερόλεπτο (mg). t είναι ο χρόνος σχηματισμού (σε δευτερόλεπτα) μιας σταγόνας υδραργύρου σε δυναμικό μισού κύματος (συνήθως είναι 3-5 δευτερόλεπτα). Δεδομένου ότι ο συντελεστής διάχυσης D εξαρτάται από τη θερμοκρασία, ο συντελεστής αναλογικότητας K στην εξίσωση Ilkovich αλλάζει με τη θερμοκρασία. Για υδατικά διαλύματα στην περιοχή θερμοκρασιών 20-50 °C, ο συντελεστής διάχυσης των πολογραφικά ενεργών αποπολωτικών ουσιών αυξάνεται κατά περίπου 3% με αύξηση της θερμοκρασίας κατά ένα βαθμό, γεγονός που οδηγεί σε αύξηση του μέσου όρου του ρεύματος διάχυσης iD κατά ~1 -2%. Ως εκ τούτου, η πολαρογραφία πραγματοποιείται σε σταθερή θερμοκρασία, θερμοστατώντας το πολογραφικό στοιχείο συνήθως στους 25 ± 0,5 ° C. Η μάζα του υδραργύρου t και ο χρόνος σχηματισμού σταγόνας t εξαρτώνται από τα χαρακτηριστικά του ηλεκτροδίου πτώσης υδραργύρου και το ύψος της στήλης υδραργύρου στο τριχοειδές και στη δεξαμενή που συνδέεται με το τριχοειδές. Το γυάλινο τριχοειδές ενός μικροηλεκτροδίου που στάζει υδράργυρο έχει συνήθως εξωτερική διάμετρο 3-7 mm, εσωτερική διάμετρο 0,03 έως 0,05 mm και μήκος 6-15 cm. Το ύψος της στήλης υδραργύρου από το κάτω άκρο του τριχοειδούς στο ανώτερο επίπεδο της επιφάνειας υδραργύρου στη δεξαμενή είναι 40-80 cm. Η περιεκτικότητα του αδιάφορου ηλεκτρολύτη στο αναλυόμενο πολωγραφημένο διάλυμα θα πρέπει να είναι περίπου 100 φορές υψηλότερη από την περιεκτικότητα της ουσίας εκπόλωσης που προσδιορίζεται και τα ιόντα του ηλεκτρολύτη υποβάθρου δεν πρέπει να εκκενώνονται υπό πολογραφικές συνθήκες έως ότου εκφορτιστεί η πολογραφικά δραστική ουσία. Η πολαρογραφία πραγματοποιείται με τη χρήση νερού, οργανικών μιγμάτων νερού (νερό - αιθανόλη, νερό - ακετόνη, νερό - διμεθυλοφορμαμίδιο κ.λπ.) και μη υδατικά μέσα (αιθανόλη, ακετόνη, διμεθυλοφορμαμίδιο, διμεθυλοσουλφοξείδιο κ.λπ.) ως διαλύτη. Πριν ξεκινήσει η πολογραφία, ένα ρεύμα αδρανούς αερίου (άζωτο, αργό, κ.λπ.) διέρχεται από το αναλυόμενο διάλυμα για την απομάκρυνση του διαλυμένου οξυγόνου, το οποίο επίσης παράγει ένα πολογραφικό κύμα λόγω μείωσης σύμφωνα με το ακόλουθο σχήμα: 2Н+ + 2е = Н202 Н202 + 2Н+ + 2е = 2Н20 Μερικές φορές - στην περίπτωση των αλκαλικών διαλυμάτων - αντί να περάσει ένα ρεύμα αδρανούς αερίου, προστίθεται στο αναλυόμενο διάλυμα μια μικρή ποσότητα ενεργού αναγωγικού παράγοντα - θειώδες νάτριο, μετόλη, που δεσμεύει το διαλυμένο οξυγόνο αντιδρώντας με αυτό. 4.2 Ποσοτική πολογραφική ανάλυση Από τα παραπάνω προκύπτει ότι η ποσοτική πολογραφική ανάλυση βασίζεται στη μέτρηση του ρεύματος διάχυσης iD ως συνάρτηση της συγκέντρωσης της πολογραφικά δραστικής ουσίας αποπόλωσης που προσδιορίζεται στο πολωγραφημένο διάλυμα. Κατά την ανάλυση των πολωρογραμμάτων που προκύπτουν, η συγκέντρωση της αναλυόμενης ουσίας προσδιορίζεται χρησιμοποιώντας τις μεθόδους μιας καμπύλης βαθμονόμησης, τυπικών προσθηκών και τυπικών διαλυμάτων. α) Η μέθοδος της καμπύλης βαθμονόμησης χρησιμοποιείται συχνότερα. Χρησιμοποιώντας αυτή τη μέθοδο, παρασκευάζεται μια σειρά τυπικών διαλυμάτων, καθένα από τα οποία περιέχει μια επακριβώς γνωστή συγκέντρωση της αναλυόμενης ουσίας. Κάθε διάλυμα πολογραφείται (αφού διοχετεύεται ρεύμα αδρανούς αερίου μέσα από αυτό) υπό τις ίδιες συνθήκες, λαμβάνονται πολωρογράμματα και βρίσκονται οι τιμές του E12 (το ίδιο για όλα τα διαλύματα) και του ρεύματος διάχυσης iD (διαφορετικό για όλα τα διαλύματα). . Με βάση τα δεδομένα που ελήφθησαν, κατασκευάζεται ένα γράφημα βαθμονόμησης σε συντεταγμένες iD-c, το οποίο είναι συνήθως μια ευθεία γραμμή σύμφωνα με την εξίσωση Ilkovich. Στη συνέχεια, πραγματοποιείται πολαρογραφία στο αναλυόμενο διάλυμα με άγνωστη συγκέντρωση c(X) της αναλυόμενης ουσίας, λαμβάνεται πολρογράφημα, μετράται το ρεύμα διάχυσης iD(X) και η συγκέντρωση c(X) βρίσκεται από το γράφημα βαθμονόμησης . β) Τυπική μέθοδος προσθήκης. Λαμβάνεται πολορόγραμμα του αναλυόμενου διαλύματος με άγνωστη συγκέντρωση c(X) της αναλυόμενης ουσίας και βρίσκεται η τιμή του ρεύματος διάχυσης, δηλ. ύψος h του πολαρογράμματος. Στη συνέχεια, μια επακριβώς γνωστή ποσότητα της αναλυόμενης ουσίας προστίθεται στο αναλυόμενο διάλυμα, αυξάνοντας τη συγκέντρωσή του κατά τιμή c(st), πραγματοποιείται ξανά πολαρογραφία και βρέθηκε μια νέα τιμή του ρεύματος διάχυσης - το ύψος του πολωρογράμματος h + △ η. Σύμφωνα με την εξίσωση Ilkovich (25), μπορούμε να γράψουμε: h = Kc(X), △ h = Kc(st), που η △ h = c(X)c(st) και c(X) = h △ hc(st) γ) Πρότυπη μέθοδος λύσης. Υπό ίδιες συνθήκες, η πολαρογραφία πραγματοποιείται σε δύο διαλύματα: ένα αναλυόμενο διάλυμα με άγνωστη συγκέντρωση c(X) και ένα πρότυπο διάλυμα με επακριβώς γνωστή συγκέντρωση c(st) της ουσίας που προσδιορίζεται. Από τα πολρογράμματα που προκύπτουν, βρίσκονται τα ύψη των πολογραφικών κυμάτων h(X) και h(st), που αντιστοιχούν στο ρεύμα διάχυσης στις συγκεντρώσεις c(X) και c(st), αντίστοιχα. Σύμφωνα με την εξίσωση Ilkovich (25) έχουμε: (X) = Kc(X), h(st) = Kc(st), Το πρότυπο διάλυμα παρασκευάζεται έτσι ώστε η συγκέντρωσή του να είναι όσο το δυνατόν πιο κοντά στη συγκέντρωση του διαλύματος που προσδιορίζεται. Υπό αυτή την προϋπόθεση, το σφάλμα προσδιορισμού ελαχιστοποιείται. 3 Εφαρμογές πολαρογραφίας Εφαρμογή της μεθόδου. Η πολαρογραφία χρησιμοποιείται για τον προσδιορισμό μικρών ποσοτήτων ανόργανων και οργανικών ουσιών. Έχουν αναπτυχθεί χιλιάδες τεχνικές ποσοτικής πολωγραφικής ανάλυσης. Έχουν προταθεί μέθοδοι για τον πολογραφικό προσδιορισμό σχεδόν όλων των μεταλλικών κατιόντων, ενός αριθμού ανιόντων (βρωμικά, ιωδικά, νιτρικά, υπερμαγγανικά ιόντα), οργανικές ενώσεις διαφόρων κατηγοριών που περιέχουν διαζωομάδες, καρβονύλιο, υπεροξείδιο, εποξειδικές ομάδες, διπλούς δεσμούς άνθρακα-άνθρακα. , καθώς και δεσμεύει άνθρακα-αλογόνο, άζωτο-οξυγόνο, θείο-θείο. Η μέθοδος της φαρμακοποιίας χρησιμοποιείται για τον προσδιορισμό σαλικυλικού οξέος, νορσουλφαζόλης, αλκαλοειδών βιταμίνης Β, φολικού οξέος, κελλίνης σε σκόνη και δισκίων, νικοτιναμίδης, υδροχλωρικής πυριδοξίνης, παρασκευασμάτων αρσενικού, καρδιακών γλυκοσιδών, καθώς και οξυγόνου και διαφόρων ακαθαρσιών στη φαρμακευτική βιομηχανία. Η μέθοδος έχει υψηλή ευαισθησία (έως 10"5-10T6 mol/l), επιλεκτικότητα, σχετικά καλή αναπαραγωγιμότητα των αποτελεσμάτων (έως ~2%), ευρύ φάσμα εφαρμογών, σας επιτρέπει να αναλύετε μείγματα ουσιών χωρίς διαχωρισμό, έγχρωμα διαλύματα, μικροί όγκοι διαλυμάτων (ο όγκος των πολαρογραφικών κυττάρων μπορεί να είναι μικρός έως και 1 ml), πραγματοποιήστε ανάλυση σε μια ροή διαλύματος, αυτοματοποιήστε την ανάλυση." Τα μειονεκτήματα της μεθόδου περιλαμβάνουν την τοξικότητα του υδραργύρου, την αρκετά εύκολη οξείδωσή του παρουσία οξειδωτικών ουσιών και τη σχετική πολυπλοκότητα του χρησιμοποιούμενου εξοπλισμού. Άλλες παραλλαγές της πολαρογραφικής μεθόδου. Εκτός από την κλασική πολαρογραφία που περιγράφεται παραπάνω, η οποία χρησιμοποιεί ένα μικροηλεκτρόδιο υδραργύρου που στάζει με ηλεκτρικό δυναμικό ομοιόμορφα αυξανόμενο σε σταθερό ηλεκτρικό ρεύμα, έχουν αναπτυχθεί άλλες παραλλαγές της πολαρογραφικής μεθόδου - παράγωγη, διαφορική, παλμική, παλμική πολαρογραφία. Πολαρογραφία εναλλασσόμενου ρεύματος - επίσης σε διαφορετικές εκδόσεις. ΚΕΦΑΛΑΙΟ 5. ΑΜΠΕΡΟΜΕΤΡΙΚΗ ΤΙΤΛΟΠΟΙΗΣΗ Η ουσία της μεθόδου. Η αμπερομετρική ογκομέτρηση (potentiostatic polarization titration) είναι ένας τύπος βολταμετρικής μεθόδου (μαζί με την πολαρογραφία). Βασίζεται στη μέτρηση του ρεύματος μεταξύ των ηλεκτροδίων ενός ηλεκτροχημικού στοιχείου, στο οποίο εφαρμόζεται μια ορισμένη τάση, ως συνάρτηση του όγκου του προστιθέμενου τιτλοδοτητή. Σύμφωνα με την εξίσωση Ilkovich (25): Το iD ρεύματος διάχυσης στο πολωγραφικό στοιχείο είναι μεγαλύτερο, όσο υψηλότερη είναι η συγκέντρωση c της πολογραφικά δραστικής ουσίας. Εάν, κατά την προσθήκη ενός τιτλοδοτητή στο αναλυόμενο τιτλοδοτημένο διάλυμα που βρίσκεται σε μια πολογραφική κυψέλη, η συγκέντρωση μιας τέτοιας ουσίας μειώνεται ή αυξάνεται, τότε το ρεύμα διάχυσης επίσης μειώνεται ή αυξάνεται ανάλογα. Το σημείο ισοδυναμίας καθορίζεται από μια απότομη αλλαγή στη μείωση ή αύξηση του ρεύματος διάχυσης, που αντιστοιχεί στο τέλος της αντίδρασης της τιτλοδοτημένης ουσίας με τον τιτλοδοτητή. Γίνεται διάκριση μεταξύ της αμπερομετρικής ογκομέτρησης με ένα πολωτικό ηλεκτρόδιο, που ονομάζεται επίσης τιτλοδότηση με περιοριστικό ρεύμα, πολογραφική ή πολωμετρική ογκομέτρηση, και αμπερομετρική τιτλοδότηση με δύο πανομοιότυπα πολωμένα ηλεκτρόδια ή τιτλοδότηση «μέχρι να σταματήσει τελείως το ρεύμα», διαμπερομετρική ογκομέτρηση. Αμπερομετρική ογκομέτρηση με ένα πολώσιμο ηλεκτρόδιο. Βασίζεται στη μέτρηση του ρεύματος σε ένα πολογραφικό στοιχείο ανάλογα με την ποσότητα του προστιθέμενου τιτλοδοτητή σε σταθερό εξωτερικό δυναμικό στο μικροηλεκτρόδιο, ελαφρώς υψηλότερο από το δυναμικό μισού κύματος στην καμπύλη ρεύματος-τάσης της τιτλοδοτημένης ουσίας X ή του τιτλοδοτητή Τ. Τυπικά, το επιλεγμένο εξωτερικό δυναμικό αντιστοιχεί στην περιοχή περιορισμού ρεύματος στο πολωρόγραμμα X ή Τ Η ογκομέτρηση πραγματοποιείται σε εγκατάσταση αποτελούμενη από πηγή συνεχούς ρεύματος με ρυθμιζόμενη τάση, στην οποία συνδέονται σε σειρά ένα γαλβανόμετρο και ένα πολαρογραφικό στοιχείο ογκομέτρησης. Το λειτουργικό (ενδεικτικό) ηλεκτρόδιο του στοιχείου μπορεί να είναι ένα ηλεκτρόδιο πτώσης υδραργύρου, ένα σταθερό ή περιστρεφόμενο ηλεκτρόδιο πλατίνας ή γραφίτη. Όταν χρησιμοποιούνται στερεά ηλεκτρόδια, είναι απαραίτητο να αναδεύεται το διάλυμα κατά τη διάρκεια της τιτλοδότησης. Ως ηλεκτρόδιο αναφοράς χρησιμοποιούνται ηλεκτρόδια χλωριούχου αργύρου ή καλομέλας. Το υπόβαθρο είναι, ανάλογα με τις συνθήκες, διάφοροι πολογραφικά ανενεργοί ηλεκτρολύτες σε δεδομένο δυναμικό (HN03, H2S04, NH4NO3 κ.λπ.). Πρώτον, οι καμπύλες ρεύματος-τάσης (πολαρογράμματα) λαμβάνονται για τα Χ και Τ υπό τις ίδιες συνθήκες υπό τις οποίες υποτίθεται ότι θα πραγματοποιηθεί η αμπερομετρική ογκομέτρηση. Με βάση αυτές τις καμπύλες, επιλέγεται μια τιμή δυναμικού στην οποία επιτυγχάνεται η οριακή τιμή ρεύματος του πολογραφικά ενεργού Χ ή Τ. Η επιλεγμένη τιμή δυναμικού διατηρείται σταθερή καθ' όλη τη διάρκεια της διαδικασίας τιτλοδότησης. Η συγκέντρωση του τιτλοδοτητή T που χρησιμοποιείται για την αμπερομετρική ογκομέτρηση πρέπει να είναι περίπου 10 φορές υψηλότερη από τη συγκέντρωση Χ. Στην περίπτωση αυτή, δεν υπάρχει πρακτικά ανάγκη να εισαχθεί διόρθωση για την αραίωση του διαλύματος κατά τη διάρκεια της τιτλοδότησης. Σε αντίθετη περίπτωση, πληρούνται όλες οι προϋποθέσεις που απαιτούνται για τη λήψη πολωρογραμμάτων. Οι απαιτήσεις για τη θερμοστάτη είναι λιγότερο αυστηρές από ό,τι για την άμεση πολογραφία, καθώς το τέλος της τιτλοδότησης δεν καθορίζεται από την απόλυτη τιμή του ρεύματος διάχυσης, αλλά από μια απότομη αλλαγή στην τιμή του. Το αναλυόμενο διάλυμα που περιέχει Χ προστίθεται στην πολογραφική κυψέλη και ο τιτλοδοτητής Τ προστίθεται σε μικρές δόσεις, μετρώντας το ρεύμα i κάθε φορά. Το μέγεθος του ρεύματος i εξαρτάται από τη συγκέντρωση της πολογραφικά δραστικής ουσίας. Στο σημείο ισοδυναμίας, η τιμή του i αλλάζει απότομα. Με βάση τα αποτελέσματα της αμπερομετρικής ογκομέτρησης, κατασκευάζονται καμπύλες ογκομέτρησης. Μια αμπερομετρική καμπύλη τιτλοδότησης είναι μια γραφική αναπαράσταση της μεταβολής του ρεύματος / ως συνάρτηση του όγκου V του προστιθέμενου τιτλοδοτητή. Η καμπύλη ογκομέτρησης απεικονίζεται στις συντεταγμένες ρεύμα i - όγκος V του προστιθέμενου τιτλοδοτητή Τ (ή βαθμός ογκομέτρησης). Ανάλογα με τη φύση της τιτλοδοτημένης ουσίας Χ και του τιτλοδοτητή Τ, οι αμπερομετρικές καμπύλες τιτλοδότησης μπορούν να είναι διαφορετικών τύπων. Η διαμπερομετρική ογκομέτρηση πραγματοποιείται με έντονη ανάδευση του διαλύματος σε διάταξη που αποτελείται από μια πηγή συνεχούς ρεύματος με ένα ποτενσιόμετρο, από το οποίο μια ρυθμιζόμενη διαφορά δυναμικού (0,05-0,25 V) παρέχεται μέσω ενός ευαίσθητου μικροαμπερόμετρου στα ηλεκτρόδια του ηλεκτροχημικού στοιχείου. Πριν από την τιτλοδότηση, το προς τιτλοδότηση διάλυμα προστίθεται στο τελευταίο και ο τιτλοδοτητής προστίθεται τμηματικά μέχρι να σταματήσει ή να εμφανιστεί απότομα το ρεύμα, όπως κρίνεται από την ένδειξη ενός μικροαμπερόμετρου. Τα ηλεκτρόδια πλατίνας που χρησιμοποιούνται στην ηλεκτροχημική κυψέλη καθαρίζονται περιοδικά βυθίζοντάς τα για ~ 30 λεπτά σε βραστό συμπυκνωμένο νιτρικό οξύ που περιέχει πρόσθετα χλωριούχου σιδήρου και ακολουθεί πλύση των ηλεκτροδίων με νερό. Η διαμπερομετρική τιτλοδότηση είναι μέθοδος φαρμακοποιίας. χρησιμοποιείται στην ιωδομετρία, τη νιτριτομετρία, την υδατομετρία και για ογκομέτρηση σε μη υδατικά μέσα. ΚΕΦΑΛΑΙΟ 6. ΚΟΥΛΟΜΕΤΡΙΚΗ ΑΝΑΛΥΣΗ (ΚΟΥΛΟΜΕΤΡΙΑ) 1 Αρχές της μεθόδου ηλεκτροχημική αγωγιμότητα κουλομετρία τιτλοδότησης Η κουλομετρική ανάλυση (κουλομετρία) βασίζεται στη χρήση της σχέσης μεταξύ της μάζας m μιας ουσίας που αντέδρασε κατά την ηλεκτρόλυση σε ένα ηλεκτροχημικό στοιχείο και της ποσότητας ηλεκτρικής ενέργειας Q που διέρχεται από το ηλεκτροχημικό στοιχείο κατά την ηλεκτρόλυση μόνο αυτής της ουσίας. Σύμφωνα με τον ενοποιημένο νόμο της ηλεκτρόλυσης του Faraday, η μάζα m (σε γραμμάρια) σχετίζεται με την ποσότητα ηλεκτρικής ενέργειας Q (σε κουλόμπ) από τη σχέση (27) όπου M είναι η μοριακή μάζα της ουσίας που αντέδρασε κατά την ηλεκτρόλυση, g/mol. n είναι ο αριθμός των ηλεκτρονίων που συμμετέχουν στην αντίδραση του ηλεκτροδίου. 96487 C/mol είναι ο αριθμός Faraday. Η ποσότητα ηλεκτρικής ενέργειας Q (σε C) που διέρχεται από ένα ηλεκτροχημικό στοιχείο κατά τη διάρκεια της ηλεκτρόλυσης είναι ίση με το γινόμενο του ηλεκτρικού ρεύματος i (σε A) και του χρόνου ηλεκτρόλυσης τ ( στο γ): Εάν μετρηθεί η ποσότητα ηλεκτρικής ενέργειας Q, τότε σύμφωνα με το (27) μπορεί να υπολογιστεί η μάζα m. Αυτό ισχύει στην περίπτωση που ολόκληρη η ποσότητα ηλεκτρικής ενέργειας Q που διέρχεται από το ηλεκτροχημικό στοιχείο κατά την ηλεκτρόλυση δαπανάται μόνο για την ηλεκτρόλυση ενός δεδομένη ουσία· παράπλευρες διαδικασίες πρέπει να αποκλειστούν. Με άλλα λόγια, η τρέχουσα έξοδος (απόδοση) πρέπει να είναι 100%. Δεδομένου ότι, σύμφωνα με τον ενοποιημένο νόμο της ηλεκτρόλυσης του M. Faraday, για να προσδιοριστεί η μάζα t (g) μιας ουσίας που αντιδρά κατά την ηλεκτρόλυση, είναι απαραίτητο να μετρηθεί η ποσότητα ηλεκτρικής ενέργειας Q που δαπανήθηκε για τον ηλεκτροχημικό μετασχηματισμό της ουσίας που προσδιορίζεται , σε κουλόμπ, η μέθοδος ονομάζεται κουλομετρία. Το κύριο καθήκον των κουλομετρικών μετρήσεων είναι να προσδιορίσουν την ποσότητα ηλεκτρικής ενέργειας Q όσο το δυνατόν ακριβέστερα. Η κουλομετρική ανάλυση πραγματοποιείται είτε σε αμπεροστατική (γαλβανοστατική) λειτουργία, δηλ. με σταθερό ηλεκτρικό ρεύμα i=const, ή με ελεγχόμενο σταθερό δυναμικό του ηλεκτροδίου εργασίας (ποτενσιοστατική κουλομετρία), όταν το ηλεκτρικό ρεύμα αλλάζει (μειώνεται) κατά τη διαδικασία της ηλεκτρόλυσης. Στην πρώτη περίπτωση, για να προσδιορίσετε την ποσότητα ηλεκτρικής ενέργειας Q, αρκεί να μετρήσετε τον χρόνο ηλεκτρόλυσης t(s), συνεχές ρεύμα /(A) όσο το δυνατόν ακριβέστερα και να υπολογίσετε την τιμή του Q χρησιμοποιώντας τον τύπο (10.28). Στη δεύτερη περίπτωση, η τιμή του Q προσδιορίζεται είτε με υπολογισμό είτε με χρήση χημικών κουλομέτρων. Υπάρχουν η άμεση κουλομετρία και η έμμεση κουλομετρία (κουλομετρική τιτλοδότηση). Η ουσία της μεθόδου. Η άμεση κουλομετρία σε σταθερό ρεύμα χρησιμοποιείται σπάνια. Συχνότερα, η κουλομετρία χρησιμοποιείται με ελεγχόμενο σταθερό δυναμικό του ηλεκτροδίου εργασίας ή με άμεση ποτενσιοστατική κουλομετρία. Στην άμεση ποτενσιοστατική κουλομετρία, η ουσία που προσδιορίζεται ηλεκτρολύεται απευθείας. Μετράται η ποσότητα ηλεκτρικής ενέργειας που δαπανάται για την ηλεκτρόλυση αυτής της ουσίας και η μάζα m της ουσίας που προσδιορίζεται υπολογίζεται χρησιμοποιώντας την εξίσωση. Κατά τη διαδικασία της ηλεκτρόλυσης, το δυναμικό του ηλεκτροδίου εργασίας διατηρείται σταθερό, E = const, για το οποίο χρησιμοποιούνται συνήθως συσκευές - ποτενσιοστάτες. Η σταθερή τιμή του δυναμικού Ε επιλέγεται εκ των προτέρων με βάση την καμπύλη ρεύματος-τάσης (πόλωση) που κατασκευάζεται στις συντεταγμένες ρεύμα i - δυναμικό Ε (όπως γίνεται στην πολαρογραφία), που λαμβάνεται υπό τις ίδιες συνθήκες στις οποίες θα γίνει η ηλεκτρόλυση διεξήχθη. Τυπικά, επιλέγεται μια τιμή δυναμικού Ε που αντιστοιχεί στην περιοχή περιορισμού του ρεύματος για την ουσία που αναλύεται και είναι ελαφρώς υψηλότερη από το δυναμικό μισού κύματος E12 (κατά -0,05-0,2 V). Σε αυτή τη δυναμική τιμή, όπως στην πολαρογραφία, ο ηλεκτρολύτης υποβάθρου δεν πρέπει να υποβάλλεται σε ηλεκτρόλυση. Καθώς η διαδικασία ηλεκτρόλυσης προχωρά με σταθερό δυναμικό, το ηλεκτρικό ρεύμα στο στοιχείο μειώνεται, καθώς μειώνεται η συγκέντρωση της ηλεκτρενεργής ουσίας που συμμετέχει στην αντίδραση του ηλεκτροδίου. Στην περίπτωση αυτή, το ηλεκτρικό ρεύμα μειώνεται με την πάροδο του χρόνου σύμφωνα με έναν εκθετικό νόμο από την αρχική τιμή i0 τη στιγμή t = O στην τιμή i τη στιγμή t: όπου ο συντελεστής k εξαρτάται από τη φύση της αντίδρασης, τη γεωμετρία του ηλεκτροχημικού στοιχείου, την περιοχή του ηλεκτροδίου εργασίας, τον συντελεστή διάχυσης της ουσίας που προσδιορίζεται, την ταχύτητα ανάδευσης του διαλύματος και τον όγκο του. Μέθοδοι για τον προσδιορισμό της ποσότητας ηλεκτρικής ενέργειας που διέρχεται από ένα διάλυμα σε άμεση ποτενσιοστατική κουλομετρία. Η τιμή του Q μπορεί να προσδιοριστεί με μεθόδους υπολογισμού ή με χρήση χημικού κουλομέτρου. α) Υπολογισμός της ποσότητας Q από το εμβαδόν κάτω από την καμπύλη του i έναντι του m. Για τον προσδιορισμό του Q χωρίς αισθητό σφάλμα, η μέθοδος απαιτεί σχεδόν πλήρη ολοκλήρωση της διαδικασίας ηλεκτρόλυσης, δηλ. για πολύ καιρό. Στην πράξη, όπως σημειώθηκε παραπάνω, το εμβαδόν μετράται σε τιμή m που αντιστοιχεί 0,001i0 (0,1% του i0). β) Υπολογισμός της τιμής του Q με βάση την εξάρτηση του In / στο m. Σύμφωνα, έχουμε: Q = 0∞i0e-k τ ρε τ =i00∞e-k τ ρε τ =i0k Επειδή η ∞i0e-k τ ρε τ = - k-1 e-k∞-e-k0= k-10-1=k-1 Εφαρμογή άμεσης κουλμετρίας. Η μέθοδος έχει υψηλή επιλεκτικότητα, ευαισθησία (έως 10~8-10~9 g ή έως ~10~5 mol/l), αναπαραγωγιμότητα (έως ~1-2%) και επιτρέπει τον προσδιορισμό της περιεκτικότητας σε μικροακαθαρσίες. Τα μειονεκτήματα της μεθόδου περιλαμβάνουν την υψηλή ένταση εργασίας και διάρκεια της ανάλυσης και την ανάγκη για ακριβό εξοπλισμό. Η άμεση κουλομετρία μπορεί να χρησιμοποιηθεί για τον προσδιορισμό - κατά την καθοδική αναγωγή - ιόντων μετάλλων, οργανικών παραγώγων νιτρο- και αλογόνου. κατά την ανοδική οξείδωση - χλωριούχα, βρωμιούχα, ιωδιούχα, θειοκυανικά ανιόντα, μεταλλικά ιόντα σε χαμηλότερες καταστάσεις οξείδωσης κατά τη μετατροπή τους σε υψηλότερες καταστάσεις οξείδωσης, για παράδειγμα: As(IH) -> As(V),Cr(II) - > Cr(III) ), Fe(II) -» Fe(III), T1(I) -> Tl(III), κ.λπ. Στη φαρμακευτική ανάλυση, η άμεση κουλομετρία χρησιμοποιείται για τον προσδιορισμό των ασκορβικών και πικρικών οξέων, της νοβοκαΐνης, της υδροξυκινολίνης και σε ορισμένες άλλες περιπτώσεις. Όπως σημειώθηκε παραπάνω, η άμεση κουλομετρία είναι αρκετά απαιτητική και χρονοβόρα. Επιπλέον, σε ορισμένες περιπτώσεις, οι πλευρικές διεργασίες αρχίζουν να εμφανίζονται αισθητά ακόμη και πριν από την ολοκλήρωση της κύριας ηλεκτροχημικής αντίδρασης, γεγονός που μειώνει την απόδοση ρεύματος και μπορεί να οδηγήσει σε σημαντικά σφάλματα ανάλυσης. Ως εκ τούτου, η έμμεση κουλομετρία - κουλομετρική τιτλοδότηση - χρησιμοποιείται συχνότερα. 3 Κουλομετρική ογκομέτρηση Η ουσία της μεθόδου. Στην κουλομετρική τιτλοδότηση, η αναλυόμενη ουσία Χ, η οποία βρίσκεται σε διάλυμα σε ένα ηλεκτροχημικό στοιχείο, αντιδρά με τον «τιτλοδοτητή» Τ, μια ουσία που σχηματίζεται (παράγεται) συνεχώς στο ηλεκτρόδιο της γεννήτριας κατά την ηλεκτρόλυση μιας βοηθητικής ουσίας που υπάρχει επίσης στο διάλυμα. Το τέλος της τιτλοδότησης - η στιγμή που όλη η αναλυόμενη ουσία Χ έχει πλήρως αντιδράσει με τον παραγόμενο «τιτλοδοτητή» Τ, καταγράφεται είτε οπτικά με τη μέθοδο του δείκτη, εισάγοντας στο διάλυμα έναν κατάλληλο δείκτη που αλλάζει χρώμα κοντά στο ΤΕ, είτε χρησιμοποιώντας μεθόδους οργάνων - ποτενσιομετρικά, αμπερομετρικά, φωτομετρικά. Έτσι, σε μια κουλομετρική τιτλοδότηση, ο τιτλοδοτητής δεν προστίθεται από την προχοΐδα στο διάλυμα που τιτλοδοτείται. Το ρόλο του τιτλοδοτητή παίζει η ουσία Τ, η οποία παράγεται συνεχώς κατά την αντίδραση του ηλεκτροδίου στο ηλεκτρόδιο της γεννήτριας. Προφανώς, υπάρχει μια αναλογία μεταξύ της συμβατικής τιτλοδότησης, όταν ο τιτλοδοτητής εισάγεται από έξω στο τιτλοδοτημένο διάλυμα και, καθώς προστίθεται, αντιδρά με την αναλυόμενη ουσία, και τη δημιουργία της ουσίας Τ, η οποία, καθώς σχηματίζεται, αντιδρά επίσης. με την αναλυόμενη ουσία. Επομένως, η υπό εξέταση μέθοδος ονομάζεται «κουλομετρική ογκομέτρηση». Η κουλομετρική ογκομέτρηση πραγματοποιείται σε αμπεροστατική (γαλβανοστατική) ή ποτενσιοστατική λειτουργία. Συχνότερα, η κουλομετρική ογκομέτρηση πραγματοποιείται σε αμπεροστατική λειτουργία, διατηρώντας σταθερό το ηλεκτρικό ρεύμα καθ' όλη τη διάρκεια του χρόνου ηλεκτρόλυσης. Αντί για τον όγκο του προστιθέμενου τιτλοδοτητή, στην κουλομετρική ογκομέτρηση μετρώνται ο χρόνος t και το ρεύμα i της ηλεκτρόλυσης. Η διαδικασία σχηματισμού της ουσίας Τ σε ένα κουλομετρικό στοιχείο κατά τη διάρκεια της ηλεκτρόλυσης ονομάζεται παραγωγή τιτλοδοτών. Κουλομετρική ογκομέτρηση σε σταθερό ρεύμα. Κατά τη διάρκεια της κουλομετρικής ογκομέτρησης σε αμπεροστατική λειτουργία (σε σταθερό ρεύμα), μετράται ο χρόνος t κατά τον οποίο διεξήχθη η ηλεκτρόλυση και η ποσότητα ηλεκτρικής ενέργειας Q που καταναλώθηκε κατά την ηλεκτρόλυση υπολογίζεται χρησιμοποιώντας τον τύπο, μετά τον οποίο η μάζα της αναλυόμενης ουσίας X βρίσκεται από η αναλογία. Έτσι, για παράδειγμα, η τυποποίηση ενός διαλύματος υδροχλωρικού οξέος HC1 με τη μέθοδο της κουλομετρικής ογκομέτρησης πραγματοποιείται με τιτλοδότηση ιόντων υδρογόνου H30+ του τυποποιημένου διαλύματος που περιέχει HC1, που παράγονται ηλεκτρικά στην κάθοδο της πλατίνας από ιόντα υδροξειδίου OH- κατά την ηλεκτρόλυση του νερό: Н20 + 2е = 20Н- + Н2 Το προκύπτον τιτλοδοτούμενο - ιόντα υδροξειδίου - αντιδρά με ιόντα Η30+ στο διάλυμα: Η30+ + ΟΗ- = 2Η20 Η τιτλοδότηση πραγματοποιείται παρουσία του δείκτη φαινολοφθαλεΐνης και διακόπτεται όταν εμφανιστεί ένα ανοιχτό ροζ χρώμα του διαλύματος. Γνωρίζοντας το μέγεθος του συνεχούς ρεύματος i (σε αμπέρ) και το χρόνο t (σε δευτερόλεπτα) που αφιερώθηκε στην ογκομέτρηση, η ποσότητα ηλεκτρικής ενέργειας Q (σε κουλόμπ) υπολογίζεται χρησιμοποιώντας τον τύπο (28) και τη μάζα (σε γραμμάρια) του αντιδρώντος HC1 που περιέχεται στον τύπο (27), σε ένα κλάσμα του τυποποιημένου διαλύματος HC1 που προστέθηκε στο κουλομετρικό στοιχείο (στο δοχείο γεννήτριας). Συνθήκες για την τιτλοδότηση. Από τα παραπάνω προκύπτει ότι οι συνθήκες για τη διεξαγωγή της κουλομετρικής ογκομέτρησης πρέπει να εξασφαλίζουν 100% απόδοση ρεύματος. Για να γίνει αυτό, πρέπει να πληροίτε τουλάχιστον τις ακόλουθες απαιτήσεις. α) Το βοηθητικό αντιδραστήριο από το οποίο παράγεται ο τιτλοδοτητής στο ηλεκτρόδιο εργασίας πρέπει να υπάρχει στο διάλυμα σε μεγάλη περίσσεια σε σχέση με την ουσία που προσδιορίζεται (~ 1000 φορές περίσσεια). Υπό αυτές τις συνθήκες, οι πλευρικές ηλεκτροχημικές αντιδράσεις συνήθως εξαλείφονται, η κύρια από τις οποίες είναι η οξείδωση ή η αναγωγή του ηλεκτρολύτη υποβάθρου, για παράδειγμα, τα ιόντα υδρογόνου: Н+ + 2е = Н2 β) Η τιμή του συνεχούς ρεύματος i=const κατά την ηλεκτρόλυση πρέπει να είναι μικρότερη από την τιμή του ρεύματος διάχυσης του βοηθητικού αντιδραστηρίου προκειμένου να αποφευχθεί μια αντίδραση που περιλαμβάνει ιόντα του ηλεκτρολύτη υποβάθρου. γ) Είναι απαραίτητο να προσδιοριστεί όσο το δυνατόν ακριβέστερα η ποσότητα ηλεκτρικής ενέργειας που καταναλώνεται κατά την ηλεκτρόλυση, η οποία απαιτεί ακριβή καταγραφή της αρχής και του τέλους της μέτρησης του χρόνου και του μεγέθους του ρεύματος ηλεκτρόλυσης. Κουλομετρική ογκομέτρηση σε σταθερό δυναμικό. Ο ποτενσιοστατικός τρόπος χρησιμοποιείται λιγότερο συχνά σε κουλομετρικές τιτλοδοτήσεις. Η κουλομετρική τιτλοδότηση σε ποτενσιοστατική λειτουργία πραγματοποιείται σε μια σταθερή τιμή δυναμικού που αντιστοιχεί στο δυναμικό της εκκένωσης μιας ουσίας στο ηλεκτρόδιο εργασίας, για παράδειγμα, κατά την καθοδική αναγωγή μεταλλικών κατιόντων M "* σε ένα ηλεκτρόδιο εργασίας πλατίνας. Ως αντίδραση συνεχίζει, το δυναμικό παραμένει σταθερό μέχρι να αντιδράσουν όλα τα μεταλλικά κατιόντα, μετά από την οποία μειώνεται απότομα, καθώς δεν υπάρχουν πλέον κατιόντα μετάλλου που καθορίζουν το δυναμικό στο διάλυμα. Εφαρμογή κουλομετρικής ογκομέτρησης. Στην κουλομετρική τιτλοδότηση, μπορούν να χρησιμοποιηθούν όλοι οι τύποι αντιδράσεων τιτλομετρικής ανάλυσης: αντιδράσεις οξέος-βάσης, οξειδοαναγωγής, καθίζησης, αντιδράσεις συμπλοκοποίησης. Έτσι, μικρές ποσότητες οξέων μπορούν να προσδιοριστούν με κουλομετρική ογκομέτρηση οξέος-βάσης με ηλεκτροπαραγόμενα ιόντα ΟΗ- που σχηματίζονται κατά την ηλεκτρόλυση του νερού στην κάθοδο: Н20 + 2е = 20Н" + Н2 Οι βάσεις μπορούν επίσης να τιτλοποιηθούν με ιόντα υδρογόνου H+ που παράγονται στην άνοδο κατά την ηλεκτρόλυση του νερού: Н20-4е = 4Н+ + 02 Με οξειδοαναγωγική βρωμομετρική κουλομετρική τιτλοδότηση, είναι δυνατός ο προσδιορισμός των ενώσεων του αρσενικού (III), του αντιμονίου (III), των ιωδιδίων, της υδραζίνης, των φαινολών και άλλων οργανικών ουσιών. Το βρώμιο, το οποίο παράγεται ηλεκτρικά στην άνοδο, δρα ως τιτλοδοτητής: VG -2e = Vg2 Η κατακρημνιζόμενη κουλομετρική τιτλοδότηση μπορεί να καθορίσει ιόντα αλογονιδίου και οργανικές ενώσεις που περιέχουν θείο από ηλεκτροπαραγόμενα κατιόντα αργύρου Ag+, κατιόντα ψευδαργύρου Zn2+ από ηλεκτροπαραγόμενα ιόντα σιδηροκυανιούχου κ.λπ. Η συμπλοκομετρική κουλομετρική τιτλοδότηση κατιόντων μετάλλων μπορεί να πραγματοποιηθεί με ανιόντα EDTA που παράγονται ηλεκτροπαραγωγή σε μια κάθοδο συμπλοκοποιημένου υδραργύρου (Ι). Η κουλομετρική ογκομέτρηση έχει υψηλή ακρίβεια, ένα ευρύ φάσμα εφαρμογών στην ποσοτική ανάλυση, σας επιτρέπει να προσδιορίσετε μικρές ποσότητες ουσιών, ενώσεις χαμηλής αντοχής (καθώς αντιδρούν αμέσως μετά τον σχηματισμό τους), για παράδειγμα, χαλκός (1), ασήμι (Η) , κασσίτερος (Ρ), τιτάνιο (III), μαγγάνιο (III), χλώριο, βρώμιο κ.λπ. Τα πλεονεκτήματα της μεθόδου περιλαμβάνουν επίσης το γεγονός ότι δεν απαιτείται προετοιμασία, τυποποίηση και αποθήκευση του τιτλοδοτητή, καθώς σχηματίζεται συνεχώς κατά την ηλεκτρόλυση και καταναλώνεται αμέσως στην αντίδραση με την ουσία που προσδιορίζεται. ΣΥΜΠΕΡΑΣΜΑ Οι ηλεκτροχημικές μέθοδοι ανάλυσης βασίζονται σε διεργασίες που συμβαίνουν στα ηλεκτρόδια ή στον χώρο μεταξύ των ηλεκτροδίων. Οι ηλεκτροχημικές μέθοδοι ανάλυσης είναι από τις παλαιότερες φυσικοχημικές μεθόδους ανάλυσης (μερικές περιγράφηκαν στα τέλη του 19ου αιώνα). Το πλεονέκτημά τους είναι η υψηλή ακρίβεια και η συγκριτική απλότητα τόσο του εξοπλισμού όσο και των τεχνικών ανάλυσης. Η υψηλή ακρίβεια καθορίζεται από πολύ ακριβείς νόμους που χρησιμοποιούνται σε ηλεκτροχημικές μεθόδους ανάλυσης, για παράδειγμα, ο νόμος του Faraday. Μια μεγάλη ευκολία είναι ότι χρησιμοποιούν ηλεκτρικές επιρροές και το γεγονός ότι το αποτέλεσμα αυτής της επιρροής (απόκριση) λαμβάνεται στη συνέχεια με τη μορφή ηλεκτρικού σήματος. Αυτό εξασφαλίζει υψηλή ταχύτητα και ακρίβεια ανάγνωσης και ανοίγει ευρείες δυνατότητες αυτοματισμού. Οι ηλεκτροχημικές μέθοδοι ανάλυσης διακρίνονται από καλή ευαισθησία και επιλεκτικότητα· σε ορισμένες περιπτώσεις μπορούν να ταξινομηθούν ως μικροανάλυση, καθώς μερικές φορές αρκεί λιγότερο από 1 ml διαλύματος για ανάλυση. Το όργανό τους είναι ένα ηλεκτροχημικό στοιχείο, το οποίο είναι ένα δοχείο με διάλυμα ηλεκτρολύτη στο οποίο είναι βυθισμένα τουλάχιστον δύο ηλεκτρόδια. Ανάλογα με το πρόβλημα που επιλύεται, το σχήμα και το υλικό του δοχείου, τον αριθμό και τη φύση των ηλεκτροδίων, τη λύση και τις συνθήκες ανάλυσης (εφαρμοσμένη τάση (ρεύμα) και καταγεγραμμένο αναλυτικό σήμα, θερμοκρασία, ανάδευση, καθαρισμός με αδρανές αέριο κ.λπ. ) μπορεί να ποικίλλει. Η ουσία που προσδιορίζεται μπορεί να είναι μέρος τόσο του ηλεκτρολύτη που γεμίζει το στοιχείο όσο και ενός από τα ηλεκτρόδια. Οι ηλεκτροχημικές μέθοδοι ανάλυσης διαδραματίζουν σημαντικό ρόλο στον σύγχρονο κόσμο. Στην εποχή μας, η φροντίδα του περιβάλλοντος είναι ιδιαίτερα σημαντική. Χρησιμοποιώντας αυτές τις μεθόδους, είναι δυνατό να προσδιοριστεί η περιεκτικότητα σε έναν τεράστιο αριθμό διαφορετικών οργανικών και ανόργανων ουσιών. Είναι πλέον πιο αποτελεσματικά στον εντοπισμό επικίνδυνων ουσιών.
Στείλτε την καλή δουλειά σας στη βάση γνώσεων είναι απλή. Χρησιμοποιήστε την παρακάτω φόρμα
Φοιτητές, μεταπτυχιακοί φοιτητές, νέοι επιστήμονες που χρησιμοποιούν τη βάση γνώσεων στις σπουδές και την εργασία τους θα σας είναι πολύ ευγνώμονες.
Δημοσιεύτηκε στις http://www.allbest.ru
Υπουργείο Παιδείας και Επιστημών της Ρωσικής Ομοσπονδίας
Ομοσπονδιακό κρατικό προϋπολογισμό εκπαιδευτικό ίδρυμα
ανώτερη εκπαίδευση
"Τεχνικό Πανεπιστήμιο Irkutsk Εθνικό Έρευνα"
Τμήμα Μεταλλουργίας Μη Φερικών Μετάλλων
(όνομα τμήματος)
"Μέθοδοι ηλεκτροχημικής έρευνας"
Περίληψη για την πειθαρχία
«Φυσικοχημικές μέθοδοι για τη μελέτη μεταλλουργικών διεργασιών»
Ολοκληρώθηκε από φοιτητή από την ομάδα MCM-16-1
Zakharenkov R.I.
Ελεγμένο από τον καθηγητή του τμήματος MCM
Kuzmina M.Yu.
Ιρκούτσκ 2017
ΕΙΣΑΓΩΓΗ
Η Ηλεκτροχημεία είναι ένας κλάδος της φυσικής χημείας που εξετάζει συστήματα που περιέχουν ιόντα (διαλύματα ή τήγματα ηλεκτρολυτών) και διεργασίες που συμβαίνουν στο όριο δύο φάσεων με τη συμμετοχή φορτισμένων σωματιδίων.
Οι πρώτες ιδέες για τη σχέση μεταξύ χημικών και ηλεκτρικών φαινομένων ήταν γνωστές τον 18ο αιώνα, αφού ένας τεράστιος αριθμός φυσικών και χημικών πειραμάτων διεξήχθη με ηλεκτρικές εκκενώσεις και κεραυνούς, με φορτία που βρίσκονταν σε βάζα Leyden, αλλά όλα ήταν τυχαία σε φύση λόγω της έλλειψης σταθερής ισχυρής πηγής ηλεκτρικής ενέργειας. Η προέλευση της ηλεκτροχημείας συνδέεται με τα ονόματα των L. Galvani και A. Volta. Ενώ μελετούσε τις φυσιολογικές λειτουργίες του βατράχου, ο Galvani δημιούργησε κατά λάθος ένα ηλεκτροχημικό κύκλωμα. Αποτελούνταν από δύο διαφορετικά μέταλλα και ένα έτοιμο βατραχοπόδι. Το πόδι ήταν και ηλεκτρολύτης και δείκτης ηλεκτρικού ρεύματος, αλλά το συμπέρασμα δόθηκε λανθασμένα, δηλαδή, σύμφωνα με τον Galvani, αυτό το ηλεκτρικό ρεύμα που προέκυψε στο κύκλωμα ήταν ζωικής προέλευσης, δηλαδή συσχετίστηκε με τα λειτουργικά χαρακτηριστικά του σώμα βατράχου (θεωρία «ηλεκτρισμός ζώων»).
Η σωστή ερμηνεία των πειραμάτων του Galvani δόθηκε από τον A. Volta. Δημιούργησε την πρώτη μπαταρία γαλβανικών στοιχείων - μια βολταϊκή στήλη. Τα στοιχεία της μπαταρίας αποτελούνταν από δίσκους χαλκού και ψευδαργύρου και ο ηλεκτρολύτης ήταν ένα υλικό σφουγγάρι εμποτισμένο σε αλμυρό νερό ή οξύ. Ήταν αυτή η σύνδεση που κατέστησε δυνατή τη λήψη ηλεκτρικού ρεύματος. Σύντομα, μέσα από τα έργα των μεγάλων επιστημόνων A. Volta, J. Daniel, B. S. Jacobi, P. R. Bagration, G. Plante και άλλων, εμφανίστηκαν ισχυρές γαλβανικές κυψέλες και μπαταρίες, εύχρηστες. Στη συνέχεια ο A. Volta ανέπτυξε μια σειρά μεταλλικών τάσεων. Εάν δύο διαφορετικά μέταλλα έρθουν σε επαφή και στη συνέχεια διαχωριστούν, τότε χρησιμοποιώντας φυσικά μέσα, όπως ένα ηλεκτροσκόπιο, μπορεί να φανεί ότι το ένα μέταλλο έχει αποκτήσει θετικό φορτίο και το άλλο αρνητικό. Αυτή η σειρά μετάλλων, στην οποία κάθε προηγούμενο μέταλλο φορτίζεται θετικά, αλλά μετά από επαφή με οποιοδήποτε επόμενο, δηλαδή τη σειρά Volta, αποδείχθηκε ότι είναι παρόμοια με τη σειρά τάσης.
Περαιτέρω, στις αρχές του 19ου αιώνα, αναπτύχθηκε η ηλεκτρόλυση και ο M. Faraday καθιέρωσε τους ποσοτικούς νόμους της ηλεκτρόλυσης. Οι επιστήμονες συνέβαλαν πολύ στην ανάπτυξη της ηλεκτροχημείας: S. A. Arrhenius, V. F. Ostwald, R. A. Colley, P. Debye, W. Nernst, G. Helmholtz κ.λπ. Τώρα η ηλεκτροχημεία χωρίζεται σε θεωρητική και εφαρμοσμένη. Μέσω της χρήσης ηλεκτροχημικών μεθόδων συνδέεται με άλλους κλάδους της φυσικής χημείας, καθώς και με την αναλυτική χημεία και άλλες επιστήμες.
ηλεκτροχημική ποτενσιομετρία αγωγιμότητα κουλομετρία
1 . ΗΛΕΚΤΡΟΧΗΜΙΚΕΣ ΜΕΘΟΔΟΙ ΕΡΕΥΝΑΣ
Η ανάγκη χρήσης ποικίλων μεθόδων για τη μελέτη ηλεκτροχημικών διεργασιών οφείλεται στο ευρύ φάσμα των διακυμάνσεων του ρυθμού μεταφοράς ηλεκτρονίων στις αντιδράσεις ηλεκτροδίων. Κάθε μία από τις μεθόδους έχει ένα ορισμένο όριο στην καθορισμένη τιμή της πυκνότητας του ρεύματος ανταλλαγής, πάνω από το οποίο δεν μπορούν να προσδιοριστούν οι ηλεκτροχημικές παράμετροι της αντίδρασης του ηλεκτροδίου. Σε σχέση με κάθε συγκεκριμένο αντικείμενο, είναι απαραίτητο να επιλέξετε τη μέθοδο που παρέχει τη μέγιστη ποσότητα αξιόπιστων πληροφοριών. Κατά τη διεξαγωγή ηλεκτροχημικών μελετών, είναι απαραίτητο να γνωρίζουμε τη χημική σύνθεση των αρχικών ουσιών και των προϊόντων αντίδρασης. Για τον προσδιορισμό της σύνθεσης του ηλεκτρολύτη, χρησιμοποιούνται διάφορες φυσικές και χημικές μέθοδοι: φασματοφωτομετρικές, ποτενσιομετρικές, αναλυτικές και άλλες. Κατά τη διεξαγωγή ηλεκτροχημικών μελετών, πρέπει να τηρούνται οι ακόλουθες συνθήκες.
1. Μέγιστη καθαρότητα των χρησιμοποιούμενων αντιδραστηρίων. η σύνθεση των ηλεκτροδίων πρέπει να είναι αυστηρά γνωστή, καθώς και η κατάσταση των επιφανειών τους. Πρέπει να λαμβάνεται μέριμνα ώστε να διασφαλίζεται ότι η επιφάνεια των ηλεκτροδίων δεν υφίσταται αλλαγές κατά τη διαδικασία μέτρησης.
2. Ο σχεδιασμός του ηλεκτροχημικού στοιχείου και των ηλεκτροδίων που βρίσκονται σε αυτό πρέπει να εξασφαλίζουν ομοιόμορφη κατανομή του ρεύματος σε ολόκληρη την επιφάνεια του ηλεκτροδίου εργασίας.
3. Οι μετρήσεις πρέπει να γίνονται σε αυστηρά ελεγχόμενες θερμοκρασίες.
4. Διατηρήστε σταθερή την πίεση και τη σύνθεση της αέριας φάσης πάνω από τον ηλεκτρολύτη. Κατά κανόνα, οι μελέτες πραγματοποιούνται σε περιβάλλον αδρανούς αερίου (N 2, Ar, Ne, He H 2), καθώς το οξυγόνο στην αέρια φάση μπορεί να έχει σημαντική επίδραση στον μηχανισμό της διαδικασίας.
5. Είναι απαραίτητο να εξασφαλιστούν τέτοιες πειραματικές συνθήκες υπό τις οποίες η πτώση δυναμικού στο διάχυτο τμήμα του ηλεκτρικού διπλού στρώματος θα είναι ελάχιστη ή επακριβώς γνωστή. Για τη μείωση αυτού του δυναμικού, κατά κανόνα, χρησιμοποιείται ένας ηλεκτρολύτης υποβάθρου, η συγκέντρωση του οποίου δεν πρέπει να είναι μικρότερη από 20 φορές υψηλότερη από αυτή της κύριας ουσίας. Ωστόσο, πρέπει πρώτα να βεβαιωθείτε ότι ο ηλεκτρολύτης υποβάθρου δεν παραμορφώνει την καμπύλη πόλωσης της αντίδρασης που μελετάται.
6. Ακριβής μέτρηση του δυναμικού του ηλεκτροδίου εργασίας. Για να γίνει αυτό, είναι απαραίτητο να εξαλειφθεί το δυναμικό διάχυσης μεταξύ του υπό μελέτη ηλεκτρολύτη και του ηλεκτρολύτη του ηλεκτροδίου αναφοράς. Αυτό το δυναμικό παίρνει τη μέγιστη τιμή του όταν πλησιάζει το οριακό ρεύμα και μπορεί να παραμορφώσει σημαντικά τα αποτελέσματα της μέτρησης. Για να εξαλειφθεί το δυναμικό διάχυσης μεταξύ του υπό μελέτη ηλεκτρολύτη και του ηλεκτρολύτη του ηλεκτροδίου αναφοράς, είναι επιθυμητό: α) να επιλέξετε ένα ηλεκτρόδιο αναφοράς που έχει την ίδια σύνθεση ηλεκτρολύτη με αυτό που μελετάται. Για παράδειγμα, όταν κάνετε έρευνα σε διαλύματα χλωρίου, είναι βολικό να χρησιμοποιείτε ηλεκτρόδια χλωριούχου αργύρου, καλομέλας και χλωρίου. σε όξινα θειικά διαλύματα - ηλεκτρόδια θειικού υδραργύρου κ.λπ. β) χρησιμοποιήστε ένα ηλεκτρόδιο αναφοράς με έναν ηλεκτρολύτη στο όριο του οποίου με τον υπό μελέτη ηλεκτρολύτη το δυναμικό διάχυσης μπορεί να υπολογιστεί χρησιμοποιώντας γνωστούς τύπους.
Κατά τη μέτρηση σε διαλύματα με σταθερή ιοντική ισχύ και σε υψηλές συγκεντρώσεις υποβάθρου - με σταθερή ιοντική συγκέντρωση, μπορείτε, καταρχήν, να χρησιμοποιήσετε οποιοδήποτε ηλεκτρόδιο αναφοράς. Το δυναμικό διάχυσης σε αυτή την περίπτωση μπορεί να είναι πολύ μεγάλο, αλλά και σταθερό - μπορεί να υπολογιστεί ή να προσδιοριστεί πειραματικά.
Σε όλες τις περιπτώσεις μελέτης της κινητικής των ηλεκτροχημικών διεργασιών, είναι απαραίτητο να μετρηθεί η πυκνότητα ρεύματος. Συνήθως ξεκινούν ανακαλύπτοντας χρησιμοποιώντας αναλυτική χημεία και μεθόδους κουλομετρίας για να προσδιορίσουν εάν συμβαίνει μόνο μία αντίδραση υπό μελέτη στο ηλεκτρόδιο ή εάν περιπλέκεται από παράπλευρες αντιδράσεις. Στην περίπτωση των πλευρικών αντιδράσεων, είναι απαραίτητο να μάθετε ποια αναλογία του ρεύματος οφείλεται μόνο στην υλοποίηση της αντίδρασης που μελετάται (κατασκευάστε το λεγόμενο χαρακτηριστικό μερικής πόλωσης για την αντίδραση που μελετάται).
Ο μηχανισμός της αντίδρασης του ηλεκτροδίου μπορεί να ερμηνευθεί πιο απλά μόνο στην περίπτωση που η αρχική ουσία μετατρέπεται σε ένα προϊόν με απόδοση ρεύματος 100%. Ο έλεγχος της αντίδρασης για συμμόρφωση με το νόμο του Faraday ή η εκτέλεση κουλομετρικών μετρήσεων σάς επιτρέπει να προσδιορίσετε ταυτόχρονα τον αριθμό των ηλεκτρονίων που συμμετέχουν στη συνολική αντίδραση ηλεκτροδίου. Η γνώση της σύνθεσης της αρχικής ουσίας και του προϊόντος της αντίδρασης, καθώς και του συνολικού αριθμού των μεταφερόμενων ηλεκτρονίων, καθιστά δυνατή την καταγραφή της εξίσωσης για τη συνολική αντίδραση ηλεκτροδίου.
Το επόμενο βήμα στη μελέτη του μηχανισμού της αντίδρασης του ηλεκτροδίου είναι να ανακαλύψουμε ποιο στάδιο είναι περιοριστικό.
Εάν το περιοριστικό στάδιο είναι το στάδιο εκφόρτισης-ιονισμού, και όλα τα άλλα προχωρούν αναστρέψιμα, τότε οι κύριες κινητικές παράμετροι της διεργασίας μπορούν να προσδιοριστούν γραφικά ή αναλυτικά εφαρμόζοντας τις εξισώσεις της θεωρίας βραδείας εκφόρτισης στα χαρακτηριστικά πόλωσης.
1.1 Ηλεκτροχημικές μέθοδοι ανάλυσης
Ηλεκτροχημικές μέθοδοιανάλυσηείναι ένα σύνολο μεθόδων ποιοτικής και ποσοτικής ανάλυσης που βασίζεται σε ηλεκτροχημικά φαινόμενα που συμβαίνουν στο υπό μελέτη μέσο ή στη διεπαφή και σχετίζονται με αλλαγές στη δομή, τη χημική σύσταση ή τη συγκέντρωση της αναλυόμενης ουσίας.
Υπάρχουν άμεσες και έμμεσες ηλεκτροχημικές μέθοδοι. Οι άμεσες μέθοδοι χρησιμοποιούν την εξάρτηση της ισχύος ρεύματος (δυναμικό, κ.λπ.) από τη συγκέντρωση του συστατικού που προσδιορίζεται. Σε έμμεσες μεθόδους μετράται η ένταση του ρεύματος (δυναμικό κ.λπ.) προκειμένου να βρεθεί το τελικό σημείο ογκομέτρησης της αναλυόμενης ουσίας με κατάλληλο τιτλοδοτητή, δηλ. Χρησιμοποιείται η εξάρτηση της μετρούμενης παραμέτρου από τον όγκο του τιτλοδοτητή.
Για κάθε είδους ηλεκτροχημικές μετρήσεις απαιτείται ηλεκτροχημικό κύκλωμα ή ηλεκτροχημική κυψέλη, αναπόσπαστο μέρος της οποίας αποτελεί το αναλυόμενο διάλυμα.
Οι ηλεκτροχημικές μέθοδοι ταξινομούνται ανάλογα με τον τύπο των φαινομένων που μετρώνται κατά τη διαδικασία ανάλυσης. Υπάρχουν δύο ομάδες ηλεκτροχημικών μεθόδων:
1. Μέθοδοι χωρίς επιβολή εξωγενούς δυναμικού, που βασίζονται στη μέτρηση της διαφοράς δυναμικού που εμφανίζεται σε ένα ηλεκτροχημικό στοιχείο που αποτελείται από ένα ηλεκτρόδιο και ένα δοχείο με το διάλυμα δοκιμής. Αυτή η ομάδα μεθόδων ονομάζεται ποτενσιομετρική. Οι ποτενσιομετρικές μέθοδοι χρησιμοποιούν την εξάρτηση του δυναμικού ισορροπίας των ηλεκτροδίων από τη συγκέντρωση των ιόντων που συμμετέχουν στην ηλεκτροχημική αντίδραση στα ηλεκτρόδια.
2. Μέθοδοι με την επιβολή εξωγενούς δυναμικού, με βάση τη μέτρηση:
α) Ηλεκτρική αγωγιμότητα διαλυμάτων; αγωγιμότητα;
β) Η ποσότητα ηλεκτρικής ενέργειας που διέρχεται από το διάλυμα; κουλομετρία;
γ) Εξάρτηση του ρεύματος από το εφαρμοζόμενο δυναμικό; βολτ-αμπερομετρία;
δ) Ο χρόνος που απαιτείται για την εμφάνιση της ηλεκτροχημικής αντίδρασης - χρονοηλεκτροχημικές μεθόδους(χρονοβολταμετρία, χρονοαγωγιμότητα).
Στις μεθόδους αυτής της ομάδας, εφαρμόζεται ένα εξωτερικό δυναμικό στα ηλεκτρόδια του ηλεκτροχημικού κυττάρου.
Το κύριο στοιχείο των οργάνων για ηλεκτροχημική ανάλυση είναι το ηλεκτροχημικό κύτταρο. Σε μεθόδους χωρίς να επιβάλλουν εξωτερικές δυνατότητες, είναι γαλβανικό στοιχείο, στην οποία ένα ηλεκτρικό ρεύμα συμβαίνει λόγω χημικών αντιδράσεων οξειδοαναγωγής. Σε ένα στοιχείο όπως ένα γαλβανικό στοιχείο, δύο ηλεκτρόδια βρίσκονται σε επαφή με το αναλυόμενο διάλυμα - ένα ηλεκτρόδιο δείκτη, το δυναμικό του οποίου εξαρτάται από τη συγκέντρωση της ουσίας και ένα ηλεκτρόδιο με σταθερό δυναμικό - ένα ηλεκτρόδιο αναφοράς, έναντι του οποίου Μετρείται το δυναμικό του ηλεκτροδίου δείκτη. Η διαφορά δυναμικού μετράται χρησιμοποιώντας ειδικές συσκευές - ποτενσιόμετρα.
Σε μεθόδους με την επιβολή εξωγενούς δυναμικού, ηλεκτροχημική κυψέλη, ονομάστηκε έτσι επειδή στα ηλεκτρόδια του κυττάρου, υπό την επίδραση ενός εφαρμοζόμενου δυναμικού, συμβαίνει ηλεκτρόλυση - η οξείδωση ή η αναγωγή μιας ουσίας. Σε αγωγιμότητα, χρησιμοποιείται ένα αγωγό αγωγιμότητας στο οποίο μετράται η ηλεκτρική αγωγιμότητα ενός διαλύματος. Σύμφωνα με τη μέθοδο εφαρμογής, οι ηλεκτροχημικές μέθοδοι μπορούν να ταξινομηθούν σε άμεσες, στις οποίες η συγκέντρωση των ουσιών μετράται σύμφωνα με τις μετρήσεις της συσκευής και σε ηλεκτροχημική τιτλοδότηση, όπου η ένδειξη του σημείου ισοδυναμίας καταγράφεται με ηλεκτροχημικές μετρήσεις. Σύμφωνα με αυτή την ταξινόμηση, διακρίνονται η ποτενσιομετρία και η ποτενσιομετρική ογκομέτρηση, η αγωγιμότητα και η αγωγιμότητα κ.λπ.
Τα όργανα για ηλεκτροχημικούς προσδιορισμούς, εκτός από το ηλεκτροχημικό στοιχείο, τον αναδευτήρα και την αντίσταση φορτίου, περιλαμβάνουν συσκευές για τη μέτρηση της διαφοράς δυναμικού, του ρεύματος, της αντίστασης διαλύματος και της ποσότητας ηλεκτρικής ενέργειας. Αυτές οι μετρήσεις μπορούν να πραγματοποιηθούν με όργανα δείκτη (βολτόμετρο ή μικροαμπερόμετρο), παλμογράφους και ποτενσιόμετρα αυτόματης εγγραφής. Εάν το ηλεκτρικό σήμα από την κυψέλη είναι πολύ ασθενές, τότε ενισχύεται χρησιμοποιώντας ραδιοενισχυτές. Σε συσκευές μεθόδων με επιβολή εξωγενούς δυναμικού, σημαντικό μέρος είναι η συσκευή τροφοδοσίας της κυψέλης με το κατάλληλο δυναμικό σταθεροποιημένου συνεχούς ή εναλλασσόμενου ρεύματος (ανάλογα με τον τύπο της μεθόδου). Η μονάδα τροφοδοσίας για συσκευές ηλεκτροχημικής ανάλυσης περιλαμβάνει συνήθως έναν ανορθωτή και έναν σταθεροποιητή τάσης, που διασφαλίζει τη συνεχή λειτουργία της συσκευής.
1.2 Ποτενσιομετρία
Η ποτενσιομετρία βασίζεται στη μέτρηση της διαφοράς στα ηλεκτρικά δυναμικά που προκύπτει μεταξύ ανόμοιων ηλεκτροδίων που βυθίζονται σε διάλυμα με την ουσία να προσδιορίζεται. Το ηλεκτρικό δυναμικό προκύπτει στα ηλεκτρόδια όταν συμβαίνει μια οξειδοαναγωγική (ηλεκτροχημική) αντίδραση σε αυτά. Οι αντιδράσεις οξειδοαναγωγής συμβαίνουν μεταξύ ενός οξειδωτικού και ενός αναγωγικού παράγοντα με το σχηματισμό ζευγών οξειδοαναγωγής, το δυναμικό Ε των οποίων καθορίζεται από την εξίσωση Nernst από τις συγκεντρώσεις των συστατικών του ζεύγους [ok] και [rec]:
Οπου E°- τυπικό δυναμικό ηλεκτροδίου, V;
n- τον αριθμό των ηλεκτρονίων που συμμετέχουν στη διαδικασία.
Οι ποτενσιομετρικές μετρήσεις πραγματοποιούνται χαμηλώνοντας δύο ηλεκτρόδια στο διάλυμα - ένα ηλεκτρόδιο δείκτη, το οποίο αντιδρά στη συγκέντρωση των ιόντων που προσδιορίζεται και ένα πρότυπο ή ηλεκτρόδιο αναφοράς, έναντι του οποίου μετράται το δυναμικό του δείκτη. Χρησιμοποιούνται διάφοροι τύποι δεικτών και τυπικών ηλεκτροδίων.
Ηλεκτρόδια πρώτου είδουςαναστρέψιμη σε σχέση με τα μεταλλικά ιόντα από τα οποία αποτελείται το ηλεκτρόδιο. Όταν ένα τέτοιο ηλεκτρόδιο χαμηλώνεται σε διάλυμα που περιέχει μεταλλικά κατιόντα, σχηματίζεται ένα ζεύγος ηλεκτροδίων: Μ n + /Μ.
Ηλεκτρόδια δεύτερου είδους ευαίσθητα στα ανιόντα και είναι μέταλλο Μ επικαλυμμένο με ένα στρώμα του αδιάλυτου άλατος του ΜΑ με ένα ανιόν ΕΝΑ- στο οποίο είναι ευαίσθητο το ηλεκτρόδιο. Όταν ένα τέτοιο ηλεκτρόδιο έρχεται σε επαφή με διάλυμα που περιέχει το καθορισμένο ανιόν ΕΝΑ-, προκύπτει δυναμικό Ε, η τιμή του οποίου εξαρτάται από το γινόμενο της διαλυτότητας του άλατος
ΚΑΙ ΤΑ ΛΟΙΠΑ Μ.Α. και συγκέντρωση ανιόντων [ ΕΝΑ-] σε διάλυμα.
Τα ηλεκτρόδια του δεύτερου τύπου είναι ο χλωριούχος άργυρος και η καλομέλα. Τα κορεσμένα ηλεκτρόδια χλωριούχου αργύρου και καλομέλας διατηρούν σταθερό δυναμικό και χρησιμοποιούνται ως ηλεκτρόδια αναφοράς έναντι των οποίων μετράται το δυναμικό του ηλεκτροδίου δείκτη.
Αδρανή ηλεκτρόδια- μια πλάκα ή σύρμα κατασκευασμένο από δύσκολα οξειδωτικά μέταλλα - πλατίνα, χρυσός, παλλάδιο. Χρησιμοποιούνται για τη μέτρηση του Ε σε διαλύματα που περιέχουν ένα ζεύγος οξειδοαναγωγής (για παράδειγμα, Fe 3+ /Fe 2+).
Ηλεκτρόδια μεμβράνης διαφορετικοί τύποι έχουν μια μεμβράνη στην οποία προκύπτει το δυναμικό της μεμβράνης Ε. Η τιμή του Ε εξαρτάται από τη διαφορά στις συγκεντρώσεις του ίδιου ιόντος σε διαφορετικές πλευρές της μεμβράνης. Το απλούστερο και πιο συχνά χρησιμοποιούμενο ηλεκτρόδιο μεμβράνης είναι το γυάλινο ηλεκτρόδιο.
Τύπος ανάμειξης αδιάλυτων αλάτων AgBr, AgCl, AgIκαι άλλα με κάποια πλαστικά (λάστιχα, πολυαιθυλένιο, πολυστυρένιο) οδήγησαν στη δημιουργία επιλεκτικά ηλεκτρόδια ιόντωνεπί Br-, Cl-, Εγώ-, προσροφώντας επιλεκτικά τα υποδεικνυόμενα ιόντα από το διάλυμα λόγω του κανόνα Paneth - Faience - Hahn. Δεδομένου ότι η συγκέντρωση των ανιχνεύσιμων ιόντων έξω από το ηλεκτρόδιο διαφέρει από αυτή μέσα στο ηλεκτρόδιο, οι ισορροπίες στις επιφάνειες της μεμβράνης είναι διαφορετικές, γεγονός που οδηγεί στην εμφάνιση ενός δυναμικού μεμβράνης.
Για τη διεξαγωγή ποτενσιομετρικών προσδιορισμών, ένα ηλεκτροχημικό στοιχείο συναρμολογείται από ένα ηλεκτρόδιο αναφοράς δείκτη, το οποίο βυθίζεται στο διάλυμα που αναλύεται και συνδέεται με ένα ποτενσιόμετρο. Τα ηλεκτρόδια που χρησιμοποιούνται στην ποτενσιομετρία έχουν υψηλή εσωτερική αντίσταση (500-1000 MOhm), επομένως υπάρχουν τύποι ποτενσιόμετρων που είναι πολύπλοκα ηλεκτρονικά βολτόμετρα υψηλής αντίστασης. Για τη μέτρηση του EMF του συστήματος ηλεκτροδίων σε ποτενσιόμετρα, χρησιμοποιείται ένα κύκλωμα αντιστάθμισης για τη μείωση του ρεύματος στο κύκλωμα της κυψέλης.
Τις περισσότερες φορές, τα ποτενσιόμετρα χρησιμοποιούνται για άμεσες μετρήσεις του pH, δείκτες των συγκεντρώσεων άλλων ιόντων pNa, pK, pNHa, pClκαι mV. Οι μετρήσεις πραγματοποιούνται χρησιμοποιώντας κατάλληλα ιοντοεκλεκτικά ηλεκτρόδια.
Για τη μέτρηση του pH, χρησιμοποιούνται ένα γυάλινο ηλεκτρόδιο και ένα ηλεκτρόδιο αναφοράς - χλωριούχος άργυρος. Πριν από τη διεξαγωγή αναλύσεων, είναι απαραίτητο να ελέγξετε τη βαθμονόμηση των μετρητών pH χρησιμοποιώντας τυπικά ρυθμιστικά διαλύματα, η στερέωση των οποίων είναι προσαρτημένη στη συσκευή.
pH μετρητές εκτός από τους άμεσους προσδιορισμούς pH, pNa, pK, pNHa, pClκαι άλλα επιτρέπουν την ποτενσιομετρική τιτλοδότηση του ιόντος που προσδιορίζεται.
1.3 Ποτενσιομετρική ογκομέτρηση
Η ποτενσιομετρική τιτλοδότηση πραγματοποιείται σε περιπτώσεις όπου δεν μπορούν να χρησιμοποιηθούν χημικοί δείκτες ή όταν δεν υπάρχει κατάλληλος δείκτης.
Στην ποτενσιομετρική τιτλοδότηση, τα ηλεκτρόδια ποτενσιόμετρου που τοποθετούνται στο τιτλοδοτημένο διάλυμα χρησιμοποιούνται ως δείκτες. Σε αυτή την περίπτωση, χρησιμοποιούνται ηλεκτρόδια που είναι ευαίσθητα σε τιτλοδοτημένα ιόντα. Κατά τη διαδικασία τιτλοδότησης αλλάζει η συγκέντρωση ιόντων, η οποία καταγράφεται στην κλίμακα μέτρησης του ποτενσιόμετρου. Έχοντας καταγράψει τις μετρήσεις του ποτενσιόμετρου σε μονάδες pH ή mV, σχεδιάστε την εξάρτησή τους από τον όγκο του τιτλοδοτητή (καμπύλη τιτλοδότησης), προσδιορίστε το σημείο ισοδυναμίας και τον όγκο του τιτλοδοτητή που καταναλώθηκε για ογκομέτρηση. Με βάση τα δεδομένα που ελήφθησαν, κατασκευάζεται μια ποτενσιομετρική καμπύλη τιτλοδότησης.
Η ποτενσιομετρική καμπύλη τιτλοδότησης έχει μορφή παρόμοια με την καμπύλη τιτλοδότησης στην τιτλοδοτική ανάλυση. Η καμπύλη ογκομέτρησης χρησιμοποιείται για τον προσδιορισμό του σημείου ισοδυναμίας, το οποίο βρίσκεται στη μέση του άλματος ογκομέτρησης. Για να γίνει αυτό, οι εφαπτομένες σχεδιάζονται σε τμήματα της καμπύλης ογκομέτρησης και το σημείο ισοδυναμίας προσδιορίζεται στο μέσο της εφαπτομένης του άλματος ογκομέτρησης. Η μεγαλύτερη τιμή αλλαγής ? pH/?Vαποκτά στο σημείο ισοδυναμίας.
Το σημείο ισοδυναμίας μπορεί να προσδιοριστεί με μεγαλύτερη ακρίβεια με τη μέθοδο του Gran, η οποία χρησιμοποιείται για την κατασκευή της εξάρτησης ? V/?Eαπό τον όγκο τιτλοδότησης. Χρησιμοποιώντας τη μέθοδο Gran, μπορεί να πραγματοποιηθεί ποτενσιομετρική τιτλοδότηση χωρίς να φτάσει στο σημείο ισοδυναμίας.
Η ποτενσιομετρική ογκομέτρηση χρησιμοποιείται σε όλες τις περιπτώσεις τιτλομετρικής ανάλυσης.
Η τιτλοδότηση οξέος-βάσης χρησιμοποιεί ένα ηλεκτρόδιο γυαλιού και ένα ηλεκτρόδιο αναφοράς. Δεδομένου ότι το γυάλινο ηλεκτρόδιο είναι ευαίσθητο στις αλλαγές του pH του μέσου, όταν τιτλοδοτούνται, οι αλλαγές στο pH του μέσου καταγράφονται στο ποτενσιόμετρο. Η ποτενσιομετρική ογκομέτρηση οξέος-βάσης χρησιμοποιείται με επιτυχία στην τιτλοδότηση ασθενών οξέων και βάσεων (ρΚβ8). Κατά την τιτλοδότηση μειγμάτων οξέων, είναι απαραίτητο το pK τους να διαφέρει κατά περισσότερες από 4 μονάδες, διαφορετικά μέρος του ασθενέστερου οξέος τιτλοδοτείται μαζί με το ισχυρό και το άλμα τιτλοδότησης δεν εκφράζεται καθαρά.
Αυτό επιτρέπει τη χρήση της ποτενσιομετρίας για την κατασκευή πειραματικών καμπυλών τιτλοδότησης, την επιλογή δεικτών για ογκομέτρηση και τον προσδιορισμό των σταθερών οξύτητας και βασικότητας.
Στην ποτενσιομετρική τιτλοδότηση καθίζησης, ένα ηλεκτρόδιο κατασκευασμένο από μέταλλο που σχηματίζει ένα ζεύγος ηλεκτροδίων με τα ιόντα που προσδιορίζονται χρησιμοποιείται ως δείκτης.
Όταν χρησιμοποιείται συμπλοκομετρική ογκομέτρηση: α) ένα μεταλλικό ηλεκτρόδιο αναστρέψιμο στο ιόν του μετάλλου που προσδιορίζεται. β) ένα ηλεκτρόδιο πλατίνας παρουσία ενός ζεύγους οξειδοαναγωγής στο διάλυμα. Όταν ένα από τα συστατικά του ζεύγους οξειδοαναγωγής δεσμεύεται από τον τιτλοδοτητή, η συγκέντρωσή του αλλάζει, γεγονός που προκαλεί αλλαγές στο δυναμικό του ηλεκτροδίου πλατίνας δείκτη. Χρησιμοποιείται επίσης οπισθοτιτλοποίηση περίσσειας διαλύματος EDTA που προστίθεται σε άλας μετάλλου με διάλυμα άλατος σιδήρου (III).
Για την τιτλοδότηση οξειδοαναγωγής, χρησιμοποιούνται ένα ηλεκτρόδιο αναφοράς και ένα ηλεκτρόδιο δείκτη πλατίνας, ευαίσθητα σε ζεύγη οξειδοαναγωγής.
Η ποτενσιομετρική ογκομέτρηση είναι μια από τις πιο χρησιμοποιούμενες μεθόδους ενόργανης ανάλυσης λόγω της απλότητας, της προσβασιμότητας, της επιλεκτικότητας και των ευρειών δυνατοτήτων της.
1.4 Αγωγομετρία. Αγωγομετρική ογκομέτρηση
Η αγωγιμότητα βασίζεται στη μέτρηση της ηλεκτρικής αγωγιμότητας ενός διαλύματος. Εάν δύο ηλεκτρόδια τοποθετηθούν σε ένα διάλυμα μιας ουσίας και μια διαφορά δυναμικού εφαρμοστεί στα ηλεκτρόδια, ένα ηλεκτρικό ρεύμα θα διαρρέει το διάλυμα. Όπως κάθε αγωγός ηλεκτρικής ενέργειας, έτσι και τα διαλύματα χαρακτηρίζονται από αντίσταση Rκαι η αντίστροφη ποσότητα του - ηλεκτρική αγωγιμότητα μεγάλο:
Οπου R- αντίσταση, Ohm;
Ειδική αντίσταση, Ohm. εκ;
μικρό - επιφάνεια, cm 2.
Οπου μεγάλο - ηλεκτρική αγωγιμότητα, Ohm-1;
R- αντίσταση, Ohm.
Η αγωγομετρική ανάλυση πραγματοποιείται χρησιμοποιώντας αγωγόμετρα - συσκευές που μετρούν την αντίσταση των διαλυμάτων. Με τιμή αντίστασης Rνα προσδιορίσετε την ηλεκτρική αγωγιμότητα των διαλυμάτων που είναι η αντίστροφη τιμή της μεγάλο.
Η συγκέντρωση των διαλυμάτων προσδιορίζεται με άμεση αγωγιμότητα και αγωγιμότητα ογκομέτρησης. Άμεση αγωγιμότηταχρησιμοποιείται για τον προσδιορισμό της συγκέντρωσης ενός διαλύματος χρησιμοποιώντας ένα γράφημα βαθμονόμησης. Για να δημιουργηθεί ένα γράφημα βαθμονόμησης, μετράται η ηλεκτρική αγωγιμότητα μιας σειράς διαλυμάτων με γνωστή συγκέντρωση και κατασκευάζεται ένα γράφημα βαθμονόμησης της ηλεκτρικής αγωγιμότητας έναντι της συγκέντρωσης. Στη συνέχεια μετράται η ηλεκτρική αγωγιμότητα του αναλυόμενου διαλύματος και προσδιορίζεται η συγκέντρωσή του από το γράφημα.
Πιο συχνά χρησιμοποιείται αγωγομετρική τιτλοδότηση. Σε αυτή την περίπτωση, το αναλυόμενο διάλυμα τοποθετείται σε κυψέλη με ηλεκτρόδια, η κυψέλη τοποθετείται σε μαγνητικό αναδευτήρα και τιτλοδοτείται με τον κατάλληλο τιτλοδοτητή. Ο τιτλοδοτητής προστίθεται σε ίσες ποσότητες. Αφού προσθέσετε κάθε τμήμα του τιτλοδοτητή, μετρήστε την ηλεκτρική αγωγιμότητα του διαλύματος και σχεδιάστε τη σχέση μεταξύ ηλεκτρικής αγωγιμότητας και όγκου τιτλοδοτητή. Όταν προστίθεται ένας τιτλοδοτητής, εμφανίζεται αλλαγή στην ηλεκτρική αγωγιμότητα του διαλύματος. η καμπύλη ογκομέτρησης κλίνει.
Από το ν η κινητικότητα των ιόντων εξαρτάται από την ηλεκτρική αγωγιμότητα του διαλύματος: τόσο μεγαλύτερη είναι η κινητικότητα β ιόντων, τόσο μεγαλύτερο είναι το ηλεκτρικό αγωγιμότητα του διαλύματος.
Η αγωγομετρική ογκομέτρηση έχει πολλά πλεονεκτήματα. Μπορεί να πραγματοποιηθεί σε θολά και έγχρωμα περιβάλλοντα, ελλείψει χημικών δεικτών. Η μέθοδος έχει αυξημένη ευαισθησία και σας επιτρέπει να αναλύετε αραιά διαλύματα ουσιών (έως 10-4 mol/dmі). Τα μείγματα ουσιών αναλύονται με αγωγομετρική τιτλοδότηση, επειδή Οι διαφορές στην κινητικότητα των διαφόρων ιόντων είναι σημαντικές και μπορούν να τιτλοποιηθούν διαφορικά παρουσία του άλλου.
Η αγωγομετρική ανάλυση μπορεί εύκολα να αυτοματοποιηθεί εάν το διάλυμα τιτλοδότησης παρέχεται από προχοΐδα με σταθερή ταχύτητα και η μεταβολή της ηλεκτρικής αγωγιμότητας του διαλύματος καταγράφεται σε συσκευή εγγραφής.
Αυτός ο τύπος αγωγιμότητας ονομάζεται χρονο- αγωγομετρική ανάλυση.
Στην τιτλοδότηση οξέος-βάσης, τα ισχυρά οξέα, τα ασθενή οξέα, τα άλατα των ασθενών βάσεων και τα ισχυρά οξέα μπορούν να προσδιοριστούν με αγωγιμότητα.
ΣΕ κατακρημνιστικό αγωγομετρικήογκομετρική ανάλυσηη ηλεκτρική αγωγιμότητα των τιτλοδοτημένων διαλυμάτων αρχικά μειώνεται ή παραμένει σε ένα ορισμένο σταθερό επίπεδο λόγω της δέσμευσης του τιτλοδοτημένου ηλεκτρολύτη σε ένα ίζημα, αφού δηλ. όταν εμφανιστεί περίσσεια τιτλοδότησης, αυξάνεται ξανά.
ΣΕ συγκρότημαμετρική αγωγομετρική τιτλοδότησηαλλαγές στην ηλεκτρική αγωγιμότητα του διαλύματος συμβαίνουν λόγω της δέσμευσης μεταλλικών κατιόντων σε σύμπλοκο με EDTA.
Οξειδοαναγωγική αγωγιμότητατιτρο- tionμε βάση την αλλαγή της συγκέντρωσης των ιόντων που αντιδρούν και την εμφάνιση νέων ιόντων στο διάλυμα, γεγονός που αλλάζει την ηλεκτρική αγωγιμότητα του διαλύματος.
Τα τελευταία χρόνια υπάρχει ανάπτυξη αγωγιμότητα υψηλών συχνοτήτων, στο οποίο τα ηλεκτρόδια δεν έρχονται σε επαφή με το διάλυμα, κάτι που είναι σημαντικό κατά την ανάλυση επιθετικών μέσων και διαλυμάτων σε κλειστά δοχεία.
Έχουν αναπτυχθεί δύο επιλογές - ευθείααγωγιμότητας υψηλής συχνότητας και τιτλοδότησης υψηλής συχνότητας.
Η άμεση αγωγιμότητα υψηλής συχνότητας χρησιμοποιείται για τον προσδιορισμό της περιεκτικότητας σε υγρασία ουσιών, κόκκων, ξύλου, συγκέντρωσης διαλυμάτων σε κλειστά δοχεία - αμπούλες και κατά την ανάλυση επιθετικών υγρών.
Η τιτλοδότηση υψηλής συχνότητας πραγματοποιείται σε ειδικούς τιτλοδοτητές - TV-6, TV-6L.
Οι αγωγομετρικές τιτλοδοτήσεις υψηλής συχνότητας πραγματοποιούνται ως ογκομετρικές τιτλοδοτήσεις οξέος-βάσης, οξειδοαναγωγής ή κατακρήμνισης σε περιπτώσεις που δεν υπάρχει κατάλληλος δείκτης ή όταν αναλύονται μείγματα ουσιών.
1.5 Κουλομετρία. Κουλομετρική ογκομέτρηση
Στην κουλομετρία, οι ουσίες προσδιορίζονται με τη μέτρηση της ποσότητας ηλεκτρικής ενέργειας που δαπανάται για τον ποσοτικό ηλεκτροχημικό μετασχηματισμό τους. Η κουλομετρική ανάλυση πραγματοποιείται σε ηλεκτρολυτική κυψέλη στην οποία τοποθετείται διάλυμα της ουσίας που προσδιορίζεται. Όταν εφαρμόζεται κατάλληλο δυναμικό στα ηλεκτρόδια του στοιχείου, λαμβάνει χώρα ηλεκτροχημική αναγωγή ή οξείδωση της ουσίας. Σύμφωνα με τους νόμους της ηλεκτρόλυσης, που ανακάλυψε ο Faraday, η ποσότητα της ουσίας που αντιδρά στο ηλεκτρόδιο είναι ανάλογη με την ποσότητα ηλεκτρισμού που διέρχεται από το διάλυμα:
Οπου σολ- μάζα απελευθερούμενης ουσίας, g.
n- τον αριθμό των ηλεκτρονίων που μεταφέρονται στη διεργασία του ηλεκτροδίου.
φά- Αριθμός Faraday (F = 96485 C/mol);
Εγώ- ένταση ρεύματος, A;
t-φορές;
Μ- μοριακή μάζα της απελευθερούμενης ουσίας, g/mol.
Η κουλομετρική ανάλυση καθιστά δυνατό τον προσδιορισμό ουσιών που δεν εναποτίθενται στα ηλεκτρόδια ή διαφεύγουν στην ατμόσφαιρα κατά τη διάρκεια μιας ηλεκτροχημικής αντίδρασης.
Υπάρχουν άμεση κουλομετρία και κουλομετρική ογκομέτρηση.. Η υψηλή ακρίβεια και ευαισθησία των μεθόδων μέτρησης του ηλεκτρικού ρεύματος παρέχει κουλομετρική ανάλυση με μοναδική ακρίβεια 0,1-0,001%, και ευαισθησία έως 1 10 -8; 1 10 -10 g. Επομένως, η κουλομετρική ανάλυση χρησιμοποιείται για τον προσδιορισμό μικροακαθαρσιών και προϊόντων καταστροφής ουσιών, κάτι που είναι σημαντικό κατά την παρακολούθηση της ποιότητάς τους.
Για να υποδείξω δηλ. Κατά την κουλομετρική ογκομέτρηση, μπορούν να χρησιμοποιηθούν χημικές και ενόργανες μέθοδοι - προσθήκη δεικτών, ανίχνευση έγχρωμων ενώσεων φωτομετρικά ή φασματοφωτομετρικά.
Σε αντίθεση με άλλες μεθόδους ανάλυσης, η κουλομετρία μπορεί να είναι πλήρως αυτοματοποιημένη, γεγονός που ελαχιστοποιεί τα τυχαία σφάλματα προσδιορισμού. Αυτή η δυνατότητα χρησιμοποιήθηκε για τη δημιουργία αυτόματων κουλομετρικών τιτλοδοτών - ευαίσθητα όργανα που χρησιμοποιούνται για ιδιαίτερα ακριβείς αναλύσεις όταν άλλες μέθοδοι δεν είναι αρκετά ευαίσθητες. Κατά την ανάλυση ουσιών που είναι ελάχιστα διαλυτές στο νερό, η κουλομετρία μπορεί να πραγματοποιηθεί σε ηλεκτρόδια από μαύρο ασετυλένιο, τα οποία είναι καλό προσροφητικό και αφαιρούν τέτοιες ουσίες από το μέσο αντίδρασης με επαρκή πληρότητα. Η κουλομετρική ογκομέτρηση είναι μια πολλά υποσχόμενη μέθοδος ενόργανης ανάλυσης. Μπορεί να βρει ευρεία εφαρμογή για την επίλυση ορισμένων ειδικών αναλυτικών προβλημάτων - ανάλυση ακαθαρσιών, μικρές ποσότητες φαρμάκων, προσδιορισμός τοξικών ουσιών, ιχνοστοιχείων και άλλων ενώσεων σε βιολογικό υλικό και στο περιβάλλον.
ΣΥΜΠΕΡΑΣΜΑ
Η εργασία παρέχει μια ανασκόπηση των κύριων μεθόδων ηλεκτροχημικής έρευνας, περιγράφοντας λεπτομερώς την αρχή, την εφαρμογή, τα πλεονεκτήματα και τα μειονεκτήματά τους.
Οι ηλεκτροχημικές μέθοδοι ανάλυσης είναι μια ομάδα μεθόδων ποσοτικής χημικής ανάλυσης που βασίζονται στη χρήση ηλεκτρόλυσης.
Οι ποικιλίες της μεθόδου είναι η ηλεκτροβαρυμετρική ανάλυση (ηλεκτροανάλυση), η εσωτερική ηλεκτρόλυση, η ανταλλαγή επαφών μετάλλων (τσιμεντοποίηση), η πολαρογραφική ανάλυση, η κουλομετρία κ.λπ. Ειδικότερα, η ηλεκτροβαρυμετρική ανάλυση βασίζεται στη ζύγιση της ουσίας που απελευθερώνεται σε ένα από τα ηλεκτρόδια. Η μέθοδος επιτρέπει όχι μόνο τη διεξαγωγή ποσοτικών προσδιορισμών χαλκού, νικελίου, μολύβδου κ.λπ., αλλά και διαχωρισμού μιγμάτων ουσιών.
Επιπλέον, οι ηλεκτροχημικές μέθοδοι ανάλυσης περιλαμβάνουν μεθόδους που βασίζονται στη μέτρηση της ηλεκτρικής αγωγιμότητας (αγωγιμότητα) ή του δυναμικού ηλεκτροδίου (ποτενσιομετρία). Ορισμένες ηλεκτροχημικές μέθοδοι χρησιμοποιούνται για την εύρεση του τελικού σημείου μιας ογκομέτρησης (αμπερομετρική ογκομέτρηση, αγωγιμότητα, ποτενσιομετρική ογκομέτρηση, κουλομετρική ογκομέτρηση).
ΚΑΤΑΛΟΓΟΣ ΧΡΗΣΙΜΟΠΟΙΗΜΕΝΩΝ ΑΝΑΦΟΡΩΝ
1. Βασικές αρχές σύγχρονης ηλεκτροχημικής ανάλυσης. Budnikov G.K., Maistrenko V.N., Vyaselev M.R., M., Mir, 2003.
2. J. Plambeck, επιμ. S. G. Mayranovsky Ηλεκτροχημικές μέθοδοι ανάλυσης. Βασικές αρχές θεωρίας και εφαρμογής: μετάφρ. από τα Αγγλικά / Vidannya: Mir, 1985.
3. Damaskin B.B., Petriy O.A., Tsirlina G.A. Ηλεκτροχημεία - Μ.: χημεία, 2001. 624 σελ.
4. ΣΤΟ 005-2015. Σύστημα Διαχείρισης Ποιότητας. Εκπαιδευτικές και μεθοδολογικές δραστηριότητες. Καταχώρηση έργων (έργων) μαθημάτων και οριστικών προκριματικών εργασιών τεχνικών ειδικοτήτων.
Δημοσιεύτηκε στο Allbest.ru
...Παρόμοια έγγραφα
Ταξινόμηση ηλεκτροχημικών μεθόδων ανάλυσης, η ουσία της βολταμετρίας, αγωγιμότητας, ποτενσιομετρίας, αμπερομετρίας, κουλομετρίας, η εφαρμογή τους στην προστασία του περιβάλλοντος. Χαρακτηριστικά χημικού αναλυτικού εξοπλισμού και κύριες εταιρείες πωλήσεων.
εργασία μαθήματος, προστέθηκε 01/08/2010
Οι ηλεκτροχημικές μέθοδοι βασίζονται στη μέτρηση των ηλεκτρικών παραμέτρων των ηλεκτροχημικών φαινομένων που συμβαίνουν στο υπό μελέτη διάλυμα. Ταξινόμηση ηλεκτροχημικών μεθόδων ανάλυσης. Ποτενσιομετρική, αγωγιμότητα, κουλομετρική ογκομέτρηση.
περίληψη, προστέθηκε 01/07/2011
Ταξινόμηση ηλεκτροχημικών μεθόδων ανάλυσης. Ποτενσιομετρικός προσδιορισμός της συγκέντρωσης μιας ουσίας σε ένα διάλυμα. Η αρχή της αγωγιμότητας. Τύποι αντιδράσεων κατά την αγωγομετρική τιτλοδότηση. Ποσοτική πολογραφική ανάλυση. Άμεση κουλομετρία.
εργασία μαθήματος, προστέθηκε 04/04/2013
Η ουσία των ηλεκτροαναλυτικών μεθόδων, η ικανότητα λήψης πειραματικών πληροφοριών σχετικά με την κινητική και τη θερμοδυναμική των χημικών συστημάτων. Πλεονεκτήματα, μειονεκτήματα και καταλληλότητα βολταμετρίας, αγωγιμότητας, ποτενσιομετρίας, αμπερομετρίας και κουλομετρίας.
περίληψη, προστέθηκε 20/11/2009
Γενικά χαρακτηριστικά ποτενσιομετρικής ανάλυσης. Ενδεικτικά ηλεκτρόδια (ανταλλαγή ηλεκτρονίων και επιλεκτικά ιόντων). Τύποι ποτενσιομετρικής μεθόδου ανάλυσης. Άμεση ποτενσιομετρία και ποτενσιομετρική ογκομέτρηση. Μέτρηση EMF ηλεκτροχημικών κυκλωμάτων.
εργασία μαθήματος, προστέθηκε 06/08/2012
Γενικές έννοιες, προϋποθέσεις και ταξινόμηση ηλεκτροχημικών μεθόδων ανάλυσης. Ποτενσιομετρική ανάλυση (ποτενσιομετρία). Αμπερομετρική τιτλοδότηση (potentiometric polarization titration). Ποσοτική πολογραφική ανάλυση.
περίληψη, προστέθηκε 10/01/2012
Μέθοδοι ηλεκτροχημικής έρευνας, ταξινόμηση και ουσία τους, ιστορικό εμφάνισης. Προσδιορισμός της συγκέντρωσης οξέος με αγωγομετρική τιτλοδότηση. δυναμικά ηλεκτροδίων, EMF γαλβανικού στοιχείου, ηλεκτροχημικό ισοδύναμο χαλκού.
εργασία μαθήματος, προστέθηκε 15/12/2014
Μελέτη της μεθόδου ποτενσιομετρικής ανάλυσης. Ανάλυση και αξιολόγηση ερευνητικών αντικειμένων. Μελέτη της τεχνικής της ποτενσιομετρικής ανάλυσης όπως εφαρμόζεται σε αυτό το αντικείμενο. Προσδιορισμός της δυνατότητας χρήσης μεθόδων ποτενσιομετρικής ανάλυσης προϊόντων κρέατος.
εργασία μαθήματος, προστέθηκε 16/09/2017
Βασικές ηλεκτροχημικές μέθοδοι ανάλυσης. Γενικά χαρακτηριστικά ποτενσιομετρικής ανάλυσης. Τύποι ποτενσιομετρικής μεθόδου ανάλυσης. Η χρήση ενός γαλβανικού στοιχείου που αποτελείται από δύο ηλεκτρόδια. Η διαδικασία για τη μέτρηση του δυναμικού του ηλεκτροδίου δείκτη.
εργασία μαθήματος, προστέθηκε 08/11/2014
Ταξινόμηση των οργάνων μεθόδων ανάλυσης σύμφωνα με την παράμετρο που προσδιορίζεται και τη μέθοδο μέτρησης. Η ουσία της ποτενσιομετρικής, αμπερομετρικής, χρωματογραφικής και φωτομετρικής ογκομέτρησης. Ποιοτικός και ποσοτικός προσδιορισμός χλωριούχου ψευδαργύρου.
Οι ηλεκτροχημικές μέθοδοι ανάλυσης είναι ένα σύνολο μεθόδων ποιοτικής και ποσοτικής ανάλυσης που βασίζονται σε ηλεκτροχημικά φαινόμενα που συμβαίνουν στο υπό μελέτη μέσο ή στη διεπιφάνεια και σχετίζονται με αλλαγές στη δομή, τη χημική σύνθεση ή τη συγκέντρωση της αναλυόμενης ουσίας.
Οι ηλεκτροχημικές μέθοδοι ανάλυσης (ECMA) βασίζονται σε διεργασίες που συμβαίνουν στα ηλεκτρόδια ή στον χώρο μεταξύ των ηλεκτροδίων. Το πλεονέκτημά τους είναι η υψηλή ακρίβεια και η συγκριτική απλότητα τόσο του εξοπλισμού όσο και των μεθόδων ανάλυσης. Η υψηλή ακρίβεια καθορίζεται από πολύ ακριβή μοτίβα που χρησιμοποιούνται στο ECMA. Μια μεγάλη ευκολία είναι ότι αυτή η μέθοδος χρησιμοποιεί ηλεκτρικές επιρροές και το γεγονός ότι το αποτέλεσμα αυτής της επιρροής (απόκριση) λαμβάνεται επίσης με τη μορφή ηλεκτρικού σήματος. Αυτό εξασφαλίζει υψηλή ταχύτητα και ακρίβεια ανάγνωσης και ανοίγει ευρείες δυνατότητες αυτοματισμού. Τα ECMA διακρίνονται από καλή ευαισθησία και επιλεκτικότητα· σε ορισμένες περιπτώσεις μπορούν να ταξινομηθούν ως μικροανάλυση, καθώς μερικές φορές αρκεί λιγότερο από 1 ml διαλύματος για ανάλυση.
Ανάλογα με τους τύπους του αναλυτικού σήματος, χωρίζονται σε:
1) αγωγιμότητα - μέτρηση της ηλεκτρικής αγωγιμότητας του διαλύματος δοκιμής.
2) ποτενσιομετρία - μέτρηση του δυναμικού ισορροπίας χωρίς ρεύμα του ηλεκτροδίου δείκτη, για το οποίο η υπό δοκιμή ουσία προσδιορίζει το δυναμικό.
3) κουλομετρία - μέτρηση της ποσότητας ηλεκτρικής ενέργειας που απαιτείται για τον πλήρη μετασχηματισμό (οξείδωση ή αναγωγή) της υπό μελέτη ουσίας.
4) βολταμετρία - μέτρηση στατικών ή μη στατικών χαρακτηριστικών πόλωσης των ηλεκτροδίων σε αντιδράσεις που περιλαμβάνουν τη δοκιμαστική ουσία.
5) ηλεκτροβαρυμετρία - μέτρηση της μάζας μιας ουσίας που απελευθερώνεται από ένα διάλυμα κατά την ηλεκτρόλυση.
27. Ποτενσιομετρική μέθοδος.
ποτενσιομετρία - μέτρηση του δυναμικού ισορροπίας ελεύθερου ρεύματος του ηλεκτροδίου δείκτη, για το οποίο η υπό δοκιμή ουσία προσδιορίζει την ενίσχυση.
Α) πρότυπο (ηλεκτρόδιο αναφοράς) - έχει σταθερό δυναμικό, ανεξάρτητο από εξωτερικές επιρροές. Οροι
Β) μεμονωμένο ηλεκτρόδιο - το δυναμικό του εξαρτάται από τη συγκέντρωση της ουσίας.
Το δυναμικό εξαρτάται από τη συγκέντρωση: E = f(c)
Εξίσωση Nerist E= E° + lna κατ
μι° - στάνταρ. Ηλεκτρόνιο. Δυνητικός (συνθ)
R- Πανεπιστήμιο. Σταθερά αερίουσυνθ)
T – απόλυτη θερμοκρασία (t)- +273 °
.п – αριθμός εμπλεκόμενων ηλεκτρονίων. Σε οξείδωση/αναγωγή Αντιδράσεις
. α – ενεργή συγκέντρωση
Μέθοδος ποτενσιομετρίας
Ιονομετρική ποτενσιομετρία (μικρό διάλυμα προστίθεται στο ερευνητικό διάλυμα. Πρότυπο διάλυμα (τιτράνη) προστίθεται τμηματικά, μετά από κάθε προσθήκη μετράται το δυναμικό. - E)
Σημείο ισοδυναμίας
μιСх Vх = μεγάλο t *Vt
28. Αγωγομετρική μέθοδος.
αγωγιμότητα - μέτρηση της ηλεκτρικής αγωγιμότητας του διαλύματος δοκιμής.
Αγωγομετρική ογκομέτρηση
Αγωγόμετρο (συσκευή)
Η αγωγομετρική ανάλυση (αγωγιμότητα) βασίζεται στη χρήση της σχέσης μεταξύ της ηλεκτρικής αγωγιμότητας (ηλεκτρικής αγωγιμότητας) των διαλυμάτων ηλεκτρολυτών και της συγκέντρωσής τους.
Η ηλεκτρική αγωγιμότητα των διαλυμάτων ηλεκτρολυτών - αγωγών του δεύτερου τύπου - κρίνεται με βάση τη μέτρηση της ηλεκτρικής τους αντίστασης σε ένα ηλεκτροχημικό στοιχείο, το οποίο είναι ένα γυάλινο δοχείο (γυαλί) με δύο ηλεκτρόδια κολλημένα μέσα σε αυτό, μεταξύ των οποίων βρίσκεται το διάλυμα του δοκιμαστικού ηλεκτρολύτη. που βρίσκεται. Ένα εναλλασσόμενο ηλεκτρικό ρεύμα περνά μέσα από το στοιχείο. Τα ηλεκτρόδια κατασκευάζονται συχνότερα από μεταλλική πλατίνα, η οποία, για να αυξηθεί η επιφάνεια των ηλεκτροδίων, επικαλύπτεται με ένα στρώμα σπογγώδους πλατίνας με ηλεκτροχημική εναπόθεση ενώσεων πλατίνας από διαλύματα (πλατινοποιημένα ηλεκτρόδια πλατίνας).
29.Πολαρογραφία.
Η πολαρογραφία είναι μια μέθοδος ποιοτικής και ποσοτικής χημικής ανάλυσης που βασίζεται στη λήψη καμπυλών ρεύματος έναντι τάσης σε ένα κύκλωμα που αποτελείται από το υπό μελέτη διάλυμα και ηλεκτρόδια βυθισμένα σε αυτό, εκ των οποίων το ένα είναι εξαιρετικά πολωτικό και το άλλο πρακτικά μη πολωτικό. Τέτοιες καμπύλες - πολαρογράμματα - λαμβάνονται με χρήση πολαρογράφων.
Η πολογραφική μέθοδος χαρακτηρίζεται από υψηλή ευαισθησία. Για να πραγματοποιηθεί η ανάλυση, συνήθως αρκούν 3-5 ml του διαλύματος δοκιμής. Η ανάλυση με χρήση πολαρογράφου αυτόματης εγγραφής διαρκεί μόνο περίπου 10 λεπτά. Η πολαρογραφία χρησιμοποιείται για τον προσδιορισμό της περιεκτικότητας σε τοξικές ουσίες σε αντικείμενα βιολογικής προέλευσης (για παράδειγμα, ενώσεις υδραργύρου, μολύβδου, θαλλίου κ.λπ.), για τον προσδιορισμό του βαθμού κορεσμού του αίματος με οξυγόνο, για τη μελέτη της σύνθεσης του εκπνεόμενου αέρα, και επιβλαβών ουσιών στον αέρα των βιομηχανικών επιχειρήσεων Η πολαρογραφική μέθοδος ανάλυσης είναι ιδιαίτερα ευαίσθητη και καθιστά δυνατό τον προσδιορισμό ουσιών σε πολύ χαμηλές (έως 0,0001%) συγκεντρώσεις σε διάλυμα.
30. Ταξινόμηση μεθόδων φασματικής ανάλυσης. Η έννοια του φάσματος.
Η φασματική ανάλυση είναι ένα σύνολο μεθόδων για τον προσδιορισμό της ποιότητας και της ποσότητας. Σύνθεση, καθώς και δομή της ύλης (με βάση την αλληλεπίδραση του ερευνητικού αντικειμένου με διάφορους τύπους ακτινοβολίας.)
Όλες οι φασματοσκοπικές μέθοδοι βασίζονται στην αλληλεπίδραση ατόμων, μορίων ή ιόντων που συνθέτουν την ουσία που αναλύεται με ηλεκτρομαγνητική ακτινοβολία. Αυτή η αλληλεπίδραση εκδηλώνεται με την απορρόφηση ή την εκπομπή φωτονίων (κβάντα). Ανάλογα με τη φύση της αλληλεπίδρασης του δείγματος με την ηλεκτρομαγνητική ακτινοβολία, διακρίνονται δύο ομάδες μεθόδων:
Εκπομπή και απορρόφηση. Ανάλογα με το ποια σωματίδια σχηματίζουν το αναλυτικό σήμα, γίνεται διάκριση μεταξύ των μεθόδων ατομικής φασματοσκοπίας και των μεθόδων μοριακής φασματοσκοπίας
Εκπομπή
Στις μεθόδους εκπομπής, το αναλυόμενο δείγμα εκπέμπει φωτόνια ως αποτέλεσμα της διέγερσής του.
απορρόφηση
Στις μεθόδους απορρόφησης, η ακτινοβολία από μια εξωτερική πηγή περνά μέσα από το δείγμα και μερικά από τα κβάντα απορροφώνται επιλεκτικά από άτομα ή μόρια
Εύρος- κατανομή των τιμών μιας φυσικής ποσότητας (συνήθως ενέργειας, συχνότητας ή μάζας). Μια γραφική αναπαράσταση μιας τέτοιας κατανομής ονομάζεται φασματικό διάγραμμα. Συνήθως, το φάσμα αναφέρεται στο ηλεκτρομαγνητικό φάσμα - το φάσμα των συχνοτήτων (ή το ίδιο πράγμα με τις κβαντικές ενέργειες) της ηλεκτρομαγνητικής ακτινοβολίας.
1.αντανάκλαση φωτός
2. περιστροφή της δέσμης φωτός (διάσπαση)
3.σκέδαση φωτός: νεφελομετρία, θολότητα
4.απορρόφηση φωτός
5 επανεκπομπή
Α) φωσφορισμός (διαρκεί πολύ)
Β) φθορισμός (πολύ σύντομος)
Ανάλογα με τη φύση της κατανομής των τιμών φυσικών μεγεθών, τα φάσματα μπορεί να είναι διακριτά (γραμμή), συνεχή (συμπαγή) και επίσης να αντιπροσωπεύουν έναν συνδυασμό (υπέρθεση) διακριτών και συνεχών φασμάτων.
Παραδείγματα φασμάτων γραμμής περιλαμβάνουν φάσματα μάζας και φάσματα ηλεκτρονικών μεταπτώσεων ενός ατόμου με δεσμούς-δεσμούς. Παραδείγματα συνεχών φάσματος είναι το φάσμα της ηλεκτρομαγνητικής ακτινοβολίας ενός θερμαινόμενου στερεού και του φάσματος των ελεύθερων ηλεκτρονικών μεταβάσεων ενός ατόμου. Παραδείγματα συνδυασμένων φάσματος είναι τα φάσματα εκπομπής των αστεριών, όπου οι γραμμές απορρόφησης χρωμοσφαιρικών ή τα περισσότερα φάσματα ήχου επικαλύπτονται στο συνεχές φάσμα της φωτοσφαίρας.
31. Φωτομετρία: αρχή της μεθόδου, εφαρμογή στην εγκληματολογική έρευνα.
Φωτομετρία - Μια φασματική μέθοδος που βασίζεται στην απορρόφηση της ηλεκτρομαγνητικής ακτινοβολίας στην ορατή και κοντά στο υπεριώδες εύρος (η μέθοδος βασίζεται στην απορρόφηση του φωτός)
Μοριακή Ατομική
Φασματοσκοπία φασματοσκοπίας (Σε ανάλυση ηλεκτρονίων)
Κουβέτα - το φως περνά μέσα από αυτό
μεγάλο
I (ένταση φωτός εξόδου)
I° είναι η ένταση του προσπίπτοντος φωτός.
Η φωτομετρία είναι ένα τμήμα της τεχνολογίας φυσικής οπτικής και μέτρησης που αφιερώνεται σε μεθόδους για τη μελέτη των ενεργειακών χαρακτηριστικών της οπτικής ακτινοβολίας στη διαδικασία της εκπομπής, της διάδοσης σε διάφορα μέσα και της αλληλεπίδρασης με τα σώματα. Η φωτομετρία διεξάγεται στις περιοχές υπέρυθρων (μήκη κύματος -10 -3 ... 7 10 -7 μ.), Ορατό (7 10 -7 ... 4 10 -7 μ.) Και υπεριώδη (4 10-7 ... 10 -8 m) οπτική ακτινοβολία. Όταν η ηλεκτρομαγνητική ακτινοβολία του οπτικού εύρους μεταδίδεται σε ένα βιολογικό περιβάλλον, παρατηρούνται ορισμένα κύρια αποτελέσματα: απορρόφηση και σκέδαση της ακτινοβολίας με άτομα και μόρια του μέσου, διασκορπισμό των ανομοιογένειας του μέσου με σωματίδια, αποπόλωση της ακτινοβολίας. Με την καταγραφή δεδομένων σχετικά με την αλληλεπίδραση της οπτικής ακτινοβολίας με το μέσο, είναι δυνατόν να προσδιοριστούν ποσοτικές παραμέτρους που σχετίζονται με τα ιατρικά και βιολογικά χαρακτηριστικά του υπό μελέτη αντικειμένου. Για τη μέτρηση φωτομετρικών μεγεθών χρησιμοποιούνται όργανα που ονομάζονται φωτόμετρα. Με φωτομετρικούς όρους, το φως είναι ακτινοβολία ικανή να παράγει μια αίσθηση φωτεινότητας όταν εκτίθεται στο ανθρώπινο μάτι. Η βάση της φωτομετρίας ως επιστήμης είναι η θεωρία του φωτεινού πεδίου που αναπτύχθηκε από τον A. Gershun.
Υπάρχουν δύο γενικές μέθοδοι φωτομετρίας: 1) οπτική φωτομετρία, η οποία χρησιμοποιεί την ικανότητα του ανθρώπινου οφθαλμού να αντιλαμβάνεται τις διαφορές στη φωτεινότητα εξισώνοντας τη φωτεινότητα δύο πεδίων σύγκρισης με μηχανικά ή οπτικά μέσα. 2) Φυσική φωτομετρία, στην οποία χρησιμοποιούνται διάφοροι δείκτες φωτός διαφορετικού είδους για να συγκριθούν δύο πηγές φωτός - φωτοκύτταρα κενού, φωτοδιόδους ημιαγωγών κ.λπ.
32. Νόμος Bouguer-Lambert-Beer, η χρήση του στην ποσοτική ανάλυση.
Ένας φυσικός νόμος που καθορίζει την εξασθένηση μιας παράλληλης μονοχρωματικής δέσμης φωτός καθώς διαδίδεται σε ένα απορροφητικό μέσο.
Ο νόμος εκφράζεται με τον ακόλουθο τύπο:
![]() ,
,

όπου είναι η ένταση της εισερχόμενης δέσμης, είναι το πάχος του στρώματος της ουσίας από το οποίο διέρχεται το φως, είναι ο δείκτης απορρόφησης (δεν πρέπει να συγχέεται με τον αδιάστατο δείκτη απορρόφησης, που σχετίζεται με τον τύπο όπου είναι το μήκος κύματος) .
Ο δείκτης απορρόφησης χαρακτηρίζει τις ιδιότητες μιας ουσίας και εξαρτάται από το μήκος κύματος λ του απορροφούμενου φωτός. Αυτή η εξάρτηση ονομάζεται φάσμα απορρόφησης της ουσίας.
Για διαλύματα απορροφητικών ουσιών σε διαλύτες που δεν απορροφούν το φως, ο δείκτης απορρόφησης μπορεί να γραφεί ως
όπου ο συντελεστής που χαρακτηρίζει την αλληλεπίδραση ενός μορίου μιας απορροφητικής διαλυμένης ουσίας με το φως με μήκος κύματος λ, είναι η συγκέντρωση της διαλυμένης ουσίας, mol/l.
Η δήλωση που δεν εξαρτάται από ονομάζεται νόμος του Beer (δεν πρέπει να συγχέεται με τον νόμο του Beer). Αυτός ο νόμος υποθέτει ότι η ικανότητα ενός μορίου να απορροφά φως δεν επηρεάζεται από άλλα περιβάλλοντα μόρια της ίδιας ουσίας σε διάλυμα. Ωστόσο, παρατηρούνται πολλές αποκλίσεις από αυτόν τον νόμο, ιδιαίτερα σε μεγάλο βαθμό.
Εάν μια φωτεινή ροή έντασης I διέρχεται από ένα ορισμένο στρώμα διαλύματος ή αερίου πάχους I, τότε σύμφωνα με το νόμο Lambert-Beer, η ποσότητα του απορροφούμενου φωτός θα είναι ανάλογη με την ένταση /, τη συγκέντρωση c της ουσίας που απορροφά φως, και το πάχος του στρώματος) ο νόμος BMB, ο οποίος συσχετίζει την ένταση του φωτός που προσπίπτει στην ουσία και την ουσία που πέρασε μέσα από αυτήν, με τη συγκέντρωση της ουσίας και το πάχος του στρώματος απορρόφησης. Λοιπόν, αυτό είναι το ίδια με τη διάθλαση, μόνο εξασθένηση στην ουσία. Το οποίο απορροφά το φως σε ένα ορισμένο ποσοστό. Δηλαδή, το υπόλοιπο της εξόδου φωτός είναι
33.Φασματοσκοπία IR.
Αυτή η μέθοδος ανάλυσης βασίζεται στην καταγραφή των φασμάτων υπέρυθρης απορρόφησης μιας ουσίας. Η απορρόφηση από την ύλη στην υπέρυθρη περιοχή συμβαίνει λόγω των δονήσεων των ατόμων στα μόρια. Οι δονήσεις χωρίζονται σε τέντωμα (όταν οι αποστάσεις μεταξύ των ατόμων αλλάζουν κατά τη διάρκεια της δόνησης) και δονήσεις (όταν οι γωνίες μεταξύ των δεσμών αλλάζουν κατά τη διάρκεια της δόνησης). Οι μεταβάσεις μεταξύ διαφορετικών καταστάσεων δόνησης σε μόρια κβαντίζονται, λόγω των οποίων η απορρόφηση στην περιοχή IR έχει τη μορφή φάσματος, όπου κάθε δόνηση έχει το δικό της μήκος κύματος. Είναι σαφές ότι το μήκος κύματος για κάθε δόνηση εξαρτάται από το ποια άτομα συμμετέχουν σε αυτήν, και επιπλέον, εξαρτάται ελάχιστα από το περιβάλλον τους.
Η μέθοδος φασματοσκοπίας IR δεν είναι μέθοδος διαχωρισμού, δηλαδή κατά τη μελέτη οποιασδήποτε ουσίας, μπορεί να αποδειχθεί ότι αυτό που πραγματικά μελετήθηκε ήταν ένα μείγμα πολλών ουσιών, το οποίο φυσικά θα παραμορφώσει πολύ τα αποτελέσματα της αποκρυπτογράφησης του φάσματος. Λοιπόν, δεν είναι απολύτως σωστό να μιλάμε για τη σαφή ταυτοποίηση μιας ουσίας χρησιμοποιώντας τη μέθοδο φασματοσκοπίας IR, καθώς η μέθοδος επιτρέπει μάλλον τον εντοπισμό ορισμένων λειτουργικών ομάδων, παρά την ποσότητα τους σε μια ένωση και τη μέθοδο επικοινωνίας μεταξύ τους.
Η μέθοδος φασματοσκοπίας IR χρησιμοποιείται για τη διεξαγωγή έρευνας σε πολυμερή υλικά, ίνες, επιστρώσεις χρωμάτων και ναρκωτικά φάρμακα (κατά την αναγνώριση του πληρωτικού, υδατάνθρακες, συμπεριλαμβανομένων των πολυσακχαριτών, χρησιμοποιούνται συχνά). Η μέθοδος είναι ιδιαίτερα απαραίτητη στη μελέτη λιπαντικών, καθώς καθιστά δυνατό τον ταυτόχρονο προσδιορισμό της φύσης τόσο της βάσης του λιπαντικού όσο και πιθανών προσθέτων (πρόσθετων) σε αυτή τη βάση.
34. Ανάλυση φθορισμού ακτίνων Χ.
(XRF) είναι μία από τις σύγχρονες φασματοσκοπικές μεθόδους για τη μελέτη μιας ουσίας προκειμένου να ληφθεί η στοιχειακή του σύνθεση, δηλαδή η στοιχειώδη ανάλυση της. Μπορεί να χρησιμοποιηθεί για την ανάλυση διαφόρων στοιχείων από το βηρύλλιο (Be) έως το ουράνιο (U). Η μέθοδος XRF βασίζεται στη συλλογή και την επακόλουθη ανάλυση ενός φάσματος που λαμβάνεται με την έκθεση του υλικού υπό μελέτη σε ακτινοβολία ακτίνων Χ. Όταν ακτινοβοληθεί, το άτομο περνά σε μια διεγερμένη κατάσταση, η οποία συνίσταται στη μετάβαση των ηλεκτρονίων σε υψηλότερα επίπεδα ενέργειας. Το άτομο παραμένει σε διεγερμένη κατάσταση για εξαιρετικά σύντομο χρονικό διάστημα, με τη σειρά ενός μικροδευτερόλεπτου, μετά την οποία επιστρέφει σε μια ήσυχη θέση (κατάσταση εδάφους). Σε αυτή την περίπτωση, τα ηλεκτρόνια από τα εξωτερικά κελύφη είτε γεμίζουν τις κενές θέσεις, και η υπερβολική ενέργεια εκπέμπεται με τη μορφή φωτονίου, είτε η ενέργεια μεταφέρεται σε άλλο ηλεκτρόνιο από τα εξωτερικά κελύφη (Auger Electron)
Οικολογία και προστασία του περιβάλλοντος: προσδιορισμός βαρέων μετάλλων σε εδάφη, ιζήματα, νερό, αερολύματα κ.λπ.
Γεωλογία και ορυκτολογία: ποιοτική και ποσοτική ανάλυση εδαφών, ορυκτών, πετρωμάτων κ.λπ.
Μεταλλουργία και χημική βιομηχανία: ποιοτικός έλεγχος πρώτων υλών, διαδικασία παραγωγής και τελικών προϊόντων
Βιομηχανία χρωμάτων και βερνικιών: ανάλυση χρωμάτων μολύβδου
35. Φασματοσκοπία ατομικής εκπομπής.
Η φασματική ανάλυση ατομικής εκπομπής είναι ένα σύνολο μεθόδων στοιχειακής ανάλυσης που βασίζονται στη μελέτη των φασμάτων εκπομπής ελεύθερων ατόμων και ιόντων στην αέρια φάση. Τυπικά, τα φάσματα εκπομπής καταγράφονται στην πιο βολική περιοχή οπτικού μήκους κύματος από 200 έως 1000 nm.
Το AES (φασματομετρία ατομικής εκπομπής) είναι μια μέθοδος προσδιορισμού της στοιχειακής σύστασης μιας ουσίας από τα φάσματα οπτικής εκπομπής ατόμων και ιόντων του αναλυόμενου δείγματος, που διεγείρονται σε πηγές φωτός. Ως πηγές φωτός για την ανάλυση ατομικών εκπομπών, χρησιμοποιείται φλόγα καυστήρα ή διάφοροι τύποι πλάσματος, συμπεριλαμβανομένου πλάσματος ηλεκτρικού σπινθήρα ή τόξου, πλάσματος σπινθήρα λέιζερ, επαγωγικά συζευγμένου πλάσματος, εκκένωσης λάμψης κ.λπ. ταυτοποίηση και ποσοτικοποίηση ακαθαρσιών στοιχείων σε αέριες, υγρές και στερεές ουσίες, συμπεριλαμβανομένων εκείνων υψηλής καθαρότητας.
Τομείς χρήσης:
Μεταλλουργία: ανάλυση της σύστασης μετάλλων και κραμάτων,
Μεταλλευτική βιομηχανία: μελέτη γεωλογικών δειγμάτων και ορυκτών πρώτων υλών,
Οικολογία: ανάλυση νερού και εδάφους,
Εξοπλισμός: ανάλυση λιπαντικών κινητήρα και άλλων τεχνικών ρευστών για ακαθαρσίες μετάλλων,
Βιολογική και ιατρική έρευνα.
Λειτουργική αρχή.
Η αρχή λειτουργίας ενός φασματόμετρου ατομικής εκπομπής είναι αρκετά απλή. Βασίζεται στο γεγονός ότι τα άτομα κάθε στοιχείου μπορούν να εκπέμπουν φως ορισμένων μηκών κύματος - φασματικές γραμμές, και αυτά τα μήκη κύματος είναι διαφορετικά για διαφορετικά στοιχεία. Για να αρχίσουν τα άτομα να εκπέμπουν φως, πρέπει να διεγείρονται - με θερμότητα, ηλεκτρική εκκένωση, λέιζερ ή κάποιο άλλο μέσο. Όσο περισσότερα άτομα ενός δεδομένου στοιχείου υπάρχουν στο αναλυόμενο δείγμα, τόσο πιο φωτεινή θα είναι η ακτινοβολία του αντίστοιχου μήκους κύματος.
Η ένταση της φασματικής γραμμής του αναλυόμενου στοιχείου, εκτός από τη συγκέντρωση του αναλυόμενου στοιχείου, εξαρτάται από μεγάλο αριθμό διαφορετικών παραγόντων. Για το λόγο αυτό, είναι αδύνατο να υπολογιστεί θεωρητικά η σχέση μεταξύ της έντασης της γραμμής και της συγκέντρωσης του αντίστοιχου στοιχείου. Αυτός είναι ο λόγος για τον οποίο απαιτούνται για την ανάλυση τυπικά δείγματα που έχουν παρόμοια σύνθεση με το δείγμα που αναλύεται. Αυτά τα τυπικά δείγματα αρχικά εκτίθενται (καίγονται) στη συσκευή. Με βάση τα αποτελέσματα αυτών των εγκαυμάτων, κατασκευάζεται ένα γράφημα βαθμονόμησης για κάθε αναλυόμενο στοιχείο, δηλ. εξάρτηση της έντασης της φασματικής γραμμής ενός στοιχείου από τη συγκέντρωσή του. Στη συνέχεια, κατά την ανάλυση δειγμάτων, αυτά τα γραφήματα βαθμονόμησης χρησιμοποιούνται για τον εκ νέου υπολογισμό των μετρούμενων εντάσεων σε συγκεντρώσεις.
Προετοιμασία δειγμάτων για ανάλυση.
Θα πρέπει να ληφθεί υπόψη ότι στην πραγματικότητα αναλύονται αρκετά χιλιοστόγραμμα δείγματος από την επιφάνειά του. Επομένως, για να ληφθούν σωστά αποτελέσματα, το δείγμα πρέπει να είναι ομοιογενές ως προς τη σύνθεση και τη δομή και η σύνθεση του δείγματος πρέπει να είναι ίδια με τη σύνθεση του μετάλλου που αναλύεται. Κατά την ανάλυση μετάλλου σε χυτήριο ή χυτήριο, συνιστάται η χρήση ειδικών καλουπιών για τη χύτευση δειγμάτων. Σε αυτήν την περίπτωση, το σχήμα του δείγματος μπορεί να είναι αυθαίρετο. Είναι απαραίτητο μόνο το δείγμα που αναλύεται να έχει επαρκή επιφάνεια και να μπορεί να συσφιχθεί σε βάση. Μπορούν να χρησιμοποιηθούν ειδικοί προσαρμογείς για την ανάλυση μικρών δειγμάτων όπως ράβδοι ή σύρματα.
Πλεονεκτήματα της μεθόδου:
Μη επαφή,
Δυνατότητα ταυτόχρονου ποσοτικού προσδιορισμού μεγάλου αριθμού στοιχείων,
Υψηλή ακρίβεια,
Χαμηλά όρια ανίχνευσης,
Ευκολία στην προετοιμασία του δείγματος,
Χαμηλό κόστος.
36. Φασματοσκοπία ατομικής απορρόφησης.
μια μέθοδος για τον ποσοτικό προσδιορισμό της στοιχειακής σύστασης μιας υπό μελέτη ουσίας χρησιμοποιώντας φάσματα ατομικής απορρόφησης, με βάση την ικανότητα των ατόμων να απορροφούν επιλεκτικά την ηλεκτρομαγνητική ακτινοβολία σε αποσύνθεση. μέρη του φάσματος. Α.-α.α. πραγματοποιούνται σε ειδικές συσκευές - απορρόφηση φασματοφωτόμετρα. Ένα δείγμα του αναλυόμενου υλικού διαλύεται (συνήθως με το σχηματισμό αλάτων). το διάλυμα με τη μορφή αερολύματος τροφοδοτείται στη φλόγα του καυστήρα. Υπό την επίδραση μιας φλόγας (3000°C), τα μόρια άλατος διασπώνται σε άτομα, τα οποία μπορούν να απορροφήσουν το φως. Στη συνέχεια, μια δέσμη φωτός διέρχεται από τη φλόγα του καυστήρα, στο φάσμα της οποίας υπάρχουν φασματικές γραμμές που αντιστοιχούν σε ένα ή άλλο στοιχείο. Οι υπό μελέτη φασματικές γραμμές απομονώνονται από τη συνολική ακτινοβολία χρησιμοποιώντας μονοχρωμάτορα και η έντασή τους καταγράφεται από μια μονάδα καταγραφής. Μαθηματικά. Η επεξεργασία πραγματοποιείται σύμφωνα με τον τύπο: J = J0 * e-kvI,
όπου J και J0 είναι οι εντάσεις του εκπεμπόμενου και προσπίπτοντος φωτός. kv – συντελεστής απορρόφηση, ανάλογα με τη συχνότητά της. I - πάχος του απορροφητικού στρώματος
πιο ευαίσθητα από τα πυρηνικά εργοστάσια
37. Νεφελομετρία και θολότητα.
S = log (I°/I) ένταση πτώσης. Στο διάλυμα (I°) διαιρείται με την ένταση αφήνοντας διάλυμα (I) =
k-const θολότητα
β – μήκος διαδρομής δέσμης φωτός
N είναι ο αριθμός των σωματιδίων ανά μονάδα. λύση
Η νεφελομετρική και θολόμετρη ανάλυση χρησιμοποιεί το φαινόμενο της σκέδασης φωτός από στερεά σωματίδια που αιωρούνται σε διάλυμα.
Η νεφελομετρία είναι μια μέθοδος για τον προσδιορισμό της διασποράς και της συγκέντρωσης των κολλοειδών συστημάτων με βάση την ένταση του φωτός που διασκορπίζεται από αυτά. Νεφελομετρία, οι μετρήσεις γίνονται σε μια ειδική συσκευή, ένα νεφελόμετρο, η δράση του οποίου βασίζεται στη σύγκριση της έντασης του φωτός που σκεδάζεται από το υπό μελέτη μέσο με την ένταση του φωτός που σκεδάζεται από άλλο μέσο, το οποίο λειτουργεί ως πρότυπο. Η θεωρία της σκέδασης φωτός από κολλοειδή συστήματα στα οποία τα μεγέθη των σωματιδίων δεν υπερβαίνουν το μισό μήκος κύματος του προσπίπτοντος φωτός αναπτύχθηκε από τον Άγγλο φυσικό J. Rayleigh το 1871. Σύμφωνα με το νόμο του Rayleigh, η ένταση του φωτός που σκέδασα σε διεύθυνση κάθετη προς η προσπίπτουσα δέσμη εκφράζεται με τον τύπο I = QNvlk - όπου q είναι η ένταση του προσπίπτοντος φωτός, N είναι ο συνολικός αριθμός σωματιδίων ανά μονάδα όγκου ή μερική συγκέντρωση, v είναι ο όγκος ενός σωματιδίου, \ είναι το μήκος κύματος του το προσπίπτον φως, k είναι μια σταθερά ανάλογα με τους δείκτες διάθλασης των κολλοειδών σωματιδίων και το μέσο διασποράς που τα περιβάλλει, την απόσταση από την πηγή φωτός, καθώς και από τις αποδεκτές μονάδες μέτρησης
Η θολερότητα είναι μια μέθοδος για την ανάλυση των θολωμένων μέσων που βασίζεται στη μέτρηση της έντασης του φωτός που απορροφάται από αυτά. Οι θολωσιμετρικές μετρήσεις πραγματοποιούνται στο εκπεμπόμενο φως χρησιμοποιώντας οπτικά θολόμετρα ή φωτοηλεκτρικά χρωματόμετρα. Η τεχνική μέτρησης είναι παρόμοια με τη χρωματομετρική και βασίζεται στην εφαρμογή του νόμου Bouguer-Lambert στα θολά μέσα, που στην περίπτωση των εναιωρημάτων ισχύει μόνο για πολύ λεπτές στρώσεις ή σε σημαντικές αραιώσεις. Η θολότητα απαιτεί προσεκτική τήρηση των συνθηκών για το σχηματισμό της διεσπαρμένης φάσης, παρόμοιες με τις συνθήκες που παρατηρούνται για τη νεφελομετρία. Μια σημαντική βελτίωση στη θολότητα είναι η χρήση της ογκομέτρησης της θολότητας με τη χρήση φωτοηλεκτρικών χρωμόμετρων. Η θολερότητα χρησιμοποιείται με επιτυχία για τον αναλυτικό προσδιορισμό θειικών, φωσφορικών, χλωριδίων, κυανιδίων, μολύβδου, ψευδαργύρου κ.λπ.
Το κύριο πλεονέκτημα των νεφελομετρικών και θολωσιμετρικών μεθόδων είναι η υψηλή ευαισθησία τους, η οποία είναι ιδιαίτερα πολύτιμη σε σχέση με στοιχεία ή ιόντα για τα οποία δεν υπάρχουν χρωματικές αντιδράσεις. Στην πράξη, για παράδειγμα, χρησιμοποιείται ευρέως ο νεφελομετρικός προσδιορισμός χλωρίου και θειικού σε φυσικά νερά και παρόμοια αντικείμενα. Όσον αφορά την ακρίβεια, η θολότητα και η νεφελομετρία είναι κατώτερα από τις φωτομετρικές μεθόδους, γεγονός που οφείλεται κυρίως στις δυσκολίες λήψης αιωρημάτων με τα ίδια μεγέθη σωματιδίων, σταθερότητα στο χρόνο κ.λπ. Εκτός από τα συνηθισμένα σχετικά μικρά σφάλματα στον φωτομετρικό προσδιορισμό, τα σφάλματα που σχετίζονται με την ανεπαρκή αναπαραγωγιμότητα των μεθόδων χημικής ανάλυσης προστίθενται ιδιότητες των εναιωρημάτων.
Η νεφελομετρία και η θολερότητα χρησιμοποιούνται, για παράδειγμα, για τον προσδιορισμό του SO4 με τη μορφή εναιωρήματος BaSO4, Cl- με τη μορφή εναιωρήματος AgCl, S2- με τη μορφή εναιωρήματος CuS από τον πυθμένα. τα όρια ανιχνεύσιμων περιεχομένων είναι ~ 0,1 μg/ml. Για να τυποποιηθούν οι συνθήκες ανάλυσης στα πειράματα, είναι απαραίτητος ο αυστηρός έλεγχος της θερμοκρασίας, του όγκου του εναιωρήματος, της συγκέντρωσης των αντιδραστηρίων, της ταχύτητας ανάδευσης και του χρόνου των μετρήσεων. Η καθίζηση πρέπει να προχωρήσει γρήγορα και τα κατακρημνισμένα σωματίδια πρέπει να είναι μικρού μεγέθους και να έχουν χαμηλό pH. Για να αποφευχθεί η πήξη μεγάλων σωματιδίων, συχνά προστίθεται σταθεροποιητής στο διάλυμα, για παράδειγμα. ζελατίνη, γλυκερίνη.
38. Χρωματογραφία: ιστορικό προέλευσης, αρχή της μεθόδου, εφαρμογή στο δικαστήριο. Ερευνα.
Η χρωματογραφία είναι μια μέθοδος δυναμικής προσρόφησης για τον διαχωρισμό και την ανάλυση των μιγμάτων των ουσιών, καθώς και τη μελέτη των φυσικοχημικών ιδιοτήτων των ουσιών. Βασίζεται στην κατανομή των ουσιών μεταξύ δύο φάσεων - στατικής (στερεάς φάσης ή υγρού που δεσμεύεται σε έναν αδρανές φορέα) και κινητό (αέριο ή υγρή φάση, έκλουσες). Το όνομα της μεθόδου σχετίζεται με τα πρώτα πειράματα της χρωματογραφίας, κατά τη διάρκεια της οποίας ο προγραμματιστής της μεθόδου, Mikhail Tsvet, διαχωρίστηκε έντονα χρωματισμένες φυτικές χρωστικές.
Η μέθοδος της χρωματογραφίας χρησιμοποιήθηκε για πρώτη φορά από τον Ρώσο βοτανολόγο Mikhail Semenovich Tsvet το 1900. Χρησιμοποίησε μια στήλη γεμάτη με ανθρακικό ασβέστιο για να διαχωρίσει τις φυτικές χρωστικές. Η πρώτη αναφορά για την ανάπτυξη της μεθόδου χρωματογραφίας έγινε από τον Tsvet στις 30 Δεκεμβρίου 1901 στο XI Συνέδριο Φυσικολόγων και Ιατρώνστην Αγία Πετρούπολη. Η πρώτη έντυπη εργασία για τη χρωματογραφία δημοσιεύτηκε το 1903, στο περιοδικό Πρακτικά της Εταιρείας Φυσικολόγων της Βαρσοβίας. Πρώτη θητεία χρωματογραφίαεμφανίστηκε σε δύο έντυπα έργα του Color το 1906, που δημοσιεύτηκαν σε γερμανικό περιοδικό Berichte der Deutschen Botanischen Gesellschaft. Το 1907, ο Τσβετ επιδεικνύει τη μέθοδό του Γερμανική Βοτανική Εταιρεία.
Το 1910-1930, η μέθοδος ξεχάστηκε αδικαιολόγητα και ουσιαστικά δεν αναπτύχθηκε.
Το 1931, ο R. Kuhn, ο Α. Winterstein και ο Ε. Lederer, χρησιμοποιώντας χρωματογραφία, απομονωμένα α και β κλάσματα σε κρυσταλλική μορφή από ακατέργαστο καροτένιο, αποδεικνύοντας έτσι την παρασκευαστική τιμή της μεθόδου.
Το 1941, ο Α. J. Ρ. Martin και ο R. L. M. Singh ανέπτυξαν έναν νέο τύπο χρωματογραφίας, ο οποίος βασίστηκε στη διαφορά στους συντελεστές διανομής των χωριστών ουσιών μεταξύ δύο μη αναμίξιμων υγρών. Η μέθοδος ονομάστηκε " χρωματογραφία κατάτμησης».
Το 1947, οι T. B. Gapon, E. N. Gapon και F. M. Shemyakin ανέπτυξαν τη μέθοδο της «ιοντοανταλλακτικής χρωματογραφίας».
Το 1952, ο J. Martin και ο R. Singh τιμήθηκαν με το Νόμπελ Χημείας για τη δημιουργία της μεθόδου της χρωματογραφίας κατάτμησης.
Από τα μέσα του 20ου αιώνα μέχρι σήμερα, η χρωματογραφία έχει αναπτυχθεί εντατικά και έχει γίνει μια από τις πιο ευρέως χρησιμοποιούμενες αναλυτικές μεθόδους.
Ταξινόμηση: Αέριο, Υγρό
Βασικές αρχές της χρωματογραφίας επεξεργάζομαι, διαδικασία.Για τη διεξαγωγή χρωματογραφίας διαχωρισμός ουσιών ή προσδιορισμός του φυσικοχημικού τους. χαρακτηριστικά χρησιμοποιούνται συνήθως ειδικά. συσκευές - χρωματογράφοι. Βασικός χρωματογραφικές μονάδες - χρωματογραφικές. στήλη, ανιχνευτή και συσκευή έγχυσης δείγματος. Η στήλη που περιέχει το σορβόμενο εκτελεί τη λειτουργία του διαχωρισμού του αναλυμένου μίγματος στα συστατικά του συστατικά του και ο ανιχνευτής εκτελεί τη λειτουργία του διαχωρισμού των ποσοτήτων τους. ορισμοί. Ο ανιχνευτής που βρίσκεται στην έξοδο της στήλης καθορίζει αυτόματα συνεχώς τη συγκέντρωση των διαχωρισμένων ενώσεων. στη ροή της κινητής φάσης Μετά την εισαγωγή του αναλυόμενου μείγματος με τη ροή της κινητής φάσης στη στήλη, οι ζώνες όλων των ουσιών βρίσκονται στην αρχή της χρωματογραφίας. στήλες (Εικ. 1). Υπό την επίδραση της ροής της κινητής φάσης, τα συστατικά του μείγματος αρχίζουν να κινούνται κατά μήκος της στήλης με αποσύνθεση. ταχύτητες, οι τιμές των οποίων είναι αντιστρόφως ανάλογες με τους συντελεστές κατανομής K των χρωματογραφημένων συστατικών. Οι καλά απορροφούμενες ουσίες, για τις οποίες οι σταθερές τιμές κατανομής είναι μεγάλες, κινούνται κατά μήκος του απορροφητικού στρώματος κατά μήκος της στήλης πιο αργά από τις ουσίες που απορροφώνται ελάχιστα. Επομένως, το συστατικό Α φεύγει από τη στήλη γρηγορότερα, μετά το στοιχείο Β και το τελευταίο που φεύγει από τη στήλη είναι το συστατικό Γ (K A<К Б <К В). Сигнал детектора, величина к-рого пропорциональна концентрации определяемого в-ва в потоке элюента, автоматически непрерывно записывается и регистрируется (напр., на диаграммной ленте). Полученная хроматограмма отражает расположение хроматографич. зон на слое сорбента или в потоке подвижной фазы во времени.

Ρύζι. 1.Διαχωρισμός μείγματος τριών συστατικών (Α, Β και Γ) σε χρωματογραφική στήλη Κ με ανιχνευτή D: α - θέση των χρωματογραφικών ζωνών των διαχωρισμένων συστατικών στη στήλη σε ορισμένα χρονικά διαστήματα. b - χρωματογράφημα (C - σήμα, t - χρόνος) .
Με χρωματογραφία επίπεδης στιβάδας Κατά τον διαχωρισμό, τοποθετείται σε χρωματογραφία ένα φύλλο χαρτιού ή μια πλάκα με στρώμα ροφητή με εφαρμοσμένα δείγματα της υπό μελέτη ουσίας. ΦΩΤΟΓΡΑΦΙΚΗ ΜΗΧΑΝΗ. Μετά τον διαχωρισμό, τα συστατικά προσδιορίζονται με οποιαδήποτε κατάλληλη μέθοδο.
39. Ταξινόμηση χρωματογραφικών μεθόδων.
Η χρωματογραφία είναι μια μέθοδος διαχωρισμού και ανάλυσης ουσιών που βασίζεται στην κατανομή της αναλυόμενης ουσίας. Η διαφορά μεταξύ 2 φάσεων: κινητής και σταθερής
Διάλυμα μείγματος προς διαχωρισμό ουσιών διέρχεται από γυάλινο σωλήνα (στήλη προσρόφησης) γεμάτο με προσροφητικό. Ως αποτέλεσμα, τα συστατικά του μείγματος διατηρούνται σε διαφορετικά ύψη της προσροφητικής στήλης με τη μορφή ξεχωριστών ζωνών (στρώσεων). Το υλικό είναι καλύτερο από το adsorbir. Βρίσκονται στην κορυφή της στήλης και χειρότερα απορροφώνται στο κάτω μέρος της στήλης. Ουσίες που δεν μπορούν να προσροφηθούν περνούν από τη στήλη χωρίς διακοπή και συλλέγονται στο φίλτρο.
Ταξινομήσεις:
1. Σύμφωνα με την κατάσταση συνάθροισης των φάσεων.
1) Κινητό
Α) αέριο (αδρανή αέρια: ήλιο, αργό, αζόνη)
Β) υγρό
2. σύμφωνα με τον τρόπο υλοποίησης
1) σε ένα επίπεδο (επίπεδο). χαρτί λεπτής στρώσης
2) κιονοειδής
Α) συσκευασμένο (συσκευασμένη στήλη γεμάτη με ροφητικό)
Β) τριχοειδές (λεπτό τριχοειδές γυαλί/χαλαζία στην εσωτερική επιφάνεια του οποίου εφαρμόζεται στατική φάση)
Μπορείτε να ορίσετε. Αντικείμενα σε μικρές ποσότητες.
Οι πτητικές ουσίες διαχωρίζονται.
40. Χρωματόγραμμα. Βασικές παράμετροι της κορυφής χρωματογραφίας.
Ένα χρωματογράφημα είναι το αποτέλεσμα της καταγραφής της εξάρτησης της συγκέντρωσης των συστατικών στην έξοδο της στήλης από το χρόνο.
H μικρό
Κάθε κορυφή στο χρωματογράφημα χαρακτηρίζεται από δύο κύριες παραμέτρους
1. Χρόνος διατήρησης ( t R) είναι ο χρόνος από τη στιγμή που εισάγεται το αναλυόμενο δείγμα μέχρι να καταγραφεί το μέγιστο της χρωματογραφικής κορυφής. Εξαρτάται από τη φύση της ουσίας και είναι ποιοτικό χαρακτηριστικό.
2. Ύψος ( η) ή περιοχή ( μικρό) κορυφή
μικρό = ½ ω × η. (4)
Το ύψος και το εμβαδόν της κορυφής εξαρτώνται από την ποσότητα της ουσίας και είναι ποσοτικά χαρακτηριστικά.
Ο χρόνος κατακράτησης αποτελείται από δύο στοιχεία - τον χρόνο παραμονής των ουσιών στην κινητή φάση ( t Μ) και ο χρόνος παραμονής στη στατική φάση ( t μικρό):
Η αναγνώριση των κορυφών άγνωστων συστατικών του αναλυόμενου μίγματος πραγματοποιείται με σύγκριση (σύγκριση). Τιμές που προσδιορίζονται απευθείας από το χρωματογράφημα, με τα αντίστοιχα πινακοποιημένα δεδομένα για γνωστές ενώσεις. Κατά την ταυτοποίηση στη χρωματογραφία, μόνο το αρνητικό είναι αξιόπιστο. απάντηση; για παράδειγμα, η κορυφή i δεν είναι το στοιχείο Α εάν οι χρόνοι διατήρησης της κορυφής i και του στοιχείου Α δεν συμπίπτουν. Η σύμπτωση των χρόνων κατακράτησης της κορυφής i και της ουσίας Α είναι απαραίτητη αλλά όχι επαρκής προϋπόθεση για να συμπεράνουμε ότι η κορυφή i είναι η ουσία Α.
Στην πρακτική εργασία, η επιλογή μιας ή άλλης παραμέτρου για την ποσοτική ερμηνεία των χρωματογραφημάτων καθορίζεται από τη συνδυασμένη επίδραση πολλών παραγόντων: την ταχύτητα και την ευκολία υπολογισμού, το σχήμα (ευρύ, στενό) και τον βαθμό ασυμμετρίας της χρωματογραφικής κορυφής, την αποτελεσματικότητα της στήλης που χρησιμοποιείται, την πληρότητα του διαχωρισμού των συστατικών του μείγματος, την παρουσία των απαραίτητων αυτοματοποιημένων συσκευών (ολοκληρωτές, συστήματα υπολογιστών για την επεξεργασία χρωματογραφικών δεδομένων).
Η καθορισμένη παράμετρος της χρωματογραφικής κορυφής μετράται χειροκίνητα από τον χειριστή στο χρωματογράφημα στο τέλος του κύκλου διαχωρισμού των συστατικών του αναλυόμενου μείγματος
Η καθορισμένη παράμετρος της χρωματογραφικής κορυφής μετριέται αυτόματα χρησιμοποιώντας ψηφιακά βολτόμετρα, ολοκληρωτές ή εξειδικευμένους υπολογιστές ταυτόχρονα με τον διαχωρισμό των συστατικών του αναλυόμενου μείγματος στη στήλη και την καταγραφή του χρωματογράμματος
Εφόσον η τεχνική της αποκωδικοποίησης των χρωματογραφημάτων καταλήγει στη μέτρηση των παραμέτρων των χρωματογραφικών κορυφών της ένωσης ενδιαφέροντος και της τυπικής ένωσης, οι συνθήκες χρωματογραφίας θα πρέπει να διασφαλίζουν τον πλήρη διαχωρισμό τους· όλα τα άλλα συστατικά του αρχικού δείγματος υπό τις αποδεκτές συνθήκες ανάλυσης μπορούν να μην είναι διαχωρισμένα μεταξύ τους ή ακόμη και να μην εμφανίζονται καθόλου στο χρωματογράφημα (αυτό είναι το πλεονέκτημα της μεθόδου εσωτερικού προτύπου έναντι της μεθόδου εσωτερικής κανονικοποίησης)
41. -Qualitative χρωματογραφική ανάλυση.
Με επαρκές μήκος στήλης, μπορεί να επιτευχθεί πλήρης διαχωρισμός των συστατικών οποιουδήποτε μείγματος. Και μετά την έκλουση των διαχωρισμένων συστατικών σε ξεχωριστά κλάσματα (εκλούσεις), προσδιορίστε τον αριθμό των συστατικών του μείγματος (αντιστοιχεί στον αριθμό των εκλούσματος), καθορίστε την ποιοτική τους σύνθεση, προσδιορίστε την ποσότητα καθενός από αυτά, χρησιμοποιώντας κατάλληλες μεθόδους ποσοτικής ανάλυσης .
Ποιοτική χρωματογραφική ανάλυση, δηλ. Η αναγνώριση μιας ουσίας σύμφωνα με το χρωματογράφημά της μπορεί να πραγματοποιηθεί συγκρίνοντας τα χρωματογραφικά χαρακτηριστικά, τις περισσότερες φορές τον όγκο που διατηρείται (δηλαδή ο όγκος της κινητής φάσης που διέρχεται από τη στήλη από την αρχή της εισαγωγής του μείγματος μέχρι την εμφάνιση αυτού του συστατικού στην έξοδο της στήλης), που βρέθηκαν υπό ορισμένες συνθήκες για τα συστατικά των αναλυόμενων μειγμάτων ουσιών και για το πρότυπο.
42. -Κοινοτική ανάλυση χρωματογραφίας.
Η ποσοτική χρωματογραφική ανάλυση πραγματοποιείται συνήθως σε χρωματογράφο. Η μέθοδος βασίζεται στη μέτρηση διαφόρων παραμέτρων της χρωματογραφικής κορυφής, ανάλογα με τη συγκέντρωση των χρωματογραφημένων ουσιών - ύψος, πλάτος, εμβαδόν και κατακρατούμενος όγκος ή το γινόμενο του συγκρατούμενου όγκου και του ύψους κορυφής.
Στην ποσοτική αέρια χρωματογραφία χρησιμοποιούνται οι μέθοδοι της απόλυτης βαθμονόμησης και της εσωτερικής κανονικοποίησης ή κανονικοποίησης. Χρησιμοποιείται επίσης η εσωτερική πρότυπη μέθοδος. Με την απόλυτη βαθμονόμηση, προσδιορίζεται πειραματικά η εξάρτηση του ύψους ή της επιφάνειας κορυφής από τη συγκέντρωση της ουσίας και κατασκευάζονται γραφήματα βαθμονόμησης ή υπολογίζονται οι αντίστοιχοι συντελεστές. Στη συνέχεια, προσδιορίζονται τα ίδια χαρακτηριστικά των κορυφών στο αναλυόμενο μείγμα και η συγκέντρωση της αναλυόμενης ουσίας βρίσκεται από το γράφημα βαθμονόμησης. Αυτή η απλή και ακριβής μέθοδος είναι η κύρια για τον προσδιορισμό των ιχνών ακαθαρσιών.
Όταν χρησιμοποιείται η μέθοδος εσωτερικής κανονικοποίησης, το άθροισμα οποιωνδήποτε παραμέτρων κορυφής, για παράδειγμα, το άθροισμα των υψών όλων των κορυφών ή το άθροισμα των επιφανειών τους, λαμβάνεται ως 100%. Στη συνέχεια, ο λόγος του ύψους μιας μεμονωμένης κορυφής προς το άθροισμα των υψών ή ο λόγος του εμβαδού μιας κορυφής προς το άθροισμα των εμβαδών όταν πολλαπλασιάζεται επί 100 θα χαρακτηρίζει το κλάσμα μάζας (%) της συνιστώσας στο μίγμα. Με αυτήν την προσέγγιση, είναι απαραίτητο η εξάρτηση της τιμής της μετρούμενης παραμέτρου από τη συγκέντρωση να είναι ίδια για όλα τα συστατικά του μείγματος.
43.πλανική χρωματογραφία. Χρήση χρωματογραφίας λεπτής στιβάδας για ανάλυση μελανιού.
Η πρώτη μορφή χρήσης της κυτταρίνης στη χρωματογραφία λεπτής στοιβάδας ήταν η χρωματογραφία χαρτιού. Οι διαθέσιμες πλάκες TLC και υψηλής απόδοσης TLC επιτρέπουν τον διαχωρισμό μειγμάτων πολικών ουσιών, χρησιμοποιώντας τουλάχιστον τριμερή μείγματα νερού, έναν μη αναμίξιμο οργανικό διαλύτη και έναν υδατοδιαλυτό διαλύτη που προάγει το σχηματισμό μιας φάσης ως διαλύτες έκλουσης)