Електрохимични методи– най-динамично развиващите се по отношение на приложението им в мониторинга на околната среда. Най-често използваните методи в MOS системите са волтаметрия (включително полярография), потенциометрия (включително йонометрия), кулометрия и кондуктометрия.
Електрохимичните методи за анализ използват зависимостта на различни електрически свойства на средата от количественото съдържание и качествения състав на анализираните в нея вещества:
· промяна потенциалелектрод в зависимост от физическите и химичните процеси, протичащи в веществото ( потенциометричниметод), вкл. селективни реакции на йон-селективни електроди, индивидуално чувствителни към голям брой катиони и аниони ( йонометриченметод);
· промяна електрическа проводимост (ток)и диелектрична константа на вещество в зависимост от естеството на средата и концентрацията на нейните компоненти ( кондуктометриченИ амперометриченметоди);
· промени количество електроенергиякогато аналитът попадне в електрохимичната клетка ( кулонометриченметод);
· възстановяване на анализираното съединение върху живачен капещ или въртящ се електрод, като правило, когато се анализират следи от вещества в различни агрегатни състояния ( полярографскиили волтаметриченметод).
Полярографите от всички устройства в тази група имат най-висока чувствителност, равна на 0,005–1 μg/ml проба.
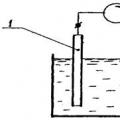
Волтаметриявключва група електрохимични методи за анализ, базирани на изследване на поляризационни криви. Тези методи са полярографияИ амперометрично титруване – имат много разновидности и модификации. Най-често постоянен токполярография.
Полярографската инсталация се състои от източник на постоянен ток, делител на напрежение, падащ (обикновено живачен) или въртящ се електрод и спомагателен (обикновено също живачен или друг) електрод. За измерване на тока към системата е свързан микроамперметър. Електродите се поставят заедно с тестовия разтвор в електролизатор (клетка).
Напрежението, приложено към електролитна клетка, причинява поляризация на анода и катода д= f а– е к +iR, Където i– сила на тока; ДА СЕ -устойчивост на разтвора; f аи f к– потенциали на анода и катода.
Ако намалите съпротивлението на разтвора чрез добавяне на силен електролит (фон), тогава стойността iR(потенциален спад в разтвора) може да се пренебрегне.
Анодният потенциал остава практически постоянен по време на работа на клетката, тъй като плътността на тока е ниска и относително голямата повърхност на анода не е поляризирана. Тогава потенциалът на капещ поляризиращ катод с малка повърхност ще бъде равен на: д= -f к. Често при полярографски измервания вместо слой живак на дъното на съда се използва неполяризиращ наситен каломелов електрод, чийто потенциал се приема равен на нула.
Полярографските данни се получават чрез измерване на тока, преминаващ през електролитна клетка като функция на потенциала, приложен към електродите. Графичната зависимост на тока от потенциала се нарича полярографска вълна ( ориз. 2).
В началото на електролизата, при ниски стойности на наложената ЕМП, силата на тока ще бъде почти постоянна и ще се увеличава само много бавно. Това е така нареченият остатъчен ток, който остава през цялата електролиза.
Ориз. 2. Полярограма на 10–3 М разтвор на цинков хлорид и 1 М разтвор на калиев хлорид (крива 1) и 1 М разтвор на калиев хлорид (крива 2)
Веднага след достигане на потенциала за редукция на йони (например за определените цинкови йони той е равен на -1,0 V), тяхното разреждане започва върху капка живак:
Zn 2+ + 2 +Hg ® Zn (Hg).
На катода се образува разредена цинкова амалгама Zn (Hg), която се разлага на своите съставки веднага щом падащата капка влезе в контакт с анода:
Zn (Hg) – 2 ® Zn 2+ +Hg.
При редукционния потенциал на цинковите йони силата на тока рязко нараства ( ориз. 2), но след достигане на определена стойност, въпреки нарастването на приложената ЕМП, тя остава почти постоянна. Този ток се нарича ограничаващ или дифузионен, неговата стойност обикновено е пропорционална на концентрацията на определяното вещество.
При вземане на полярограми към изследвания електролит се добавя индиферентен електролит с катиони, които се редуцират много по-трудно от анализирания катион, например KCl, KNO 3, NH 4 Cl; в концентрация 100–1000 пъти по-висока от концентрацията на определяното вещество. Този електролит се нарича "фон". Създава се в тестовия разтвор, за да увеличи електрическата проводимост и да екранира електрическото поле на индикаторния електрод (катод). Следователно катионите на аналита не се привличат от електрическото поле на катода, а се придвижват към него поради дифузия.
Най-важната характеристика на полярограмата е потенциалът на полувълната д 1/2 и полярографска височина на вълната ч(граничен дифузионен ток). Полувълновият потенциал се използва в качествополярографски анализ. Потенциалите на полувълните на различни вещества, подредени в ред на нарастване на отрицателната стойност, съставляват така наречения "полярографски спектър". Тъй като потенциалът на полувълната значително зависи от състава на разтвора (анализираната среда), фонът винаги се посочва в полярографските таблици.
IN количественПри полярографския анализ за измерване на концентрацията се използват методите на калибровъчна графика, добавки, сравнения и изчислителни методи.
Сред различните варианти за полярография, методът диференциална импулсна полярография (DIP) ) е най-ефективен за решаване на проблеми с мониторинга на околната среда, главно поради високата си чувствителност. Методът DIP ви позволява да оцените съдържанието на всички вещества, определени чрез класическа полярография. Сред другите полярографски методи, той е особено удобен за анализ на следи квадратна вълнаполярография, който осигурява граница на откриване, близка до тази на DIP, но само в случай на обратими електродни процеси и следователно този метод често се използва за определяне на следи от тежки метали. Методът DIP може да се използва и за определяне на повърхностноактивни вещества, които променят капацитета на двойния електрически слой на електрода.
Могат да се използват методи за определяне на микросъдържанието на йони на тежки метали инверсионен електрохимичен анализ (IEA) или по друг начин, стрипинг волтаметричен анализ (IVA ), при който металите, които трябва да се определят, се отлагат предварително върху електрода и след това се разтварят по време на полярографския контрол. Тази опция, в комбинация с DIP, е един от най-чувствителните методи за електрохимичен анализ. Хардуерният дизайн на IEA (IVA) е сравнително прост, което дава възможност за извършване на анализи на място, а на този принцип могат да работят и автоматизирани станции за непрекъснат контрол (мониторинг).
Методите IEA (IVA) осигуряват определянето на Cu, Pb, Bi, Sb, As, Sn In, Ga, Ag, Tl, Cd, Zn, Hg, Au, Ge, Te, Ni, Co йони и много аниони. Важно предимство на методите IEA (IEA) е (за разлика от други методи, например като атомно-абсорбционна спектрометрия) способност за разграничаване на свободните йони от техните свързани химични форми, което също е важно за оценка на физикохимичните свойства на анализираните вещества от гледна точка на аналитичния контрол на околната среда (например при оценка на качеството на водата). Много органични вещества могат също да бъдат определени чрез методите на IEA (IEA) след тяхното адсорбционно натрупване върху повърхността на електрода.
Полярографските методи могат да се използват и за определяне на аерозоли от различни метали в атмосферата и въздуха на промишлени помещения след тяхното улавяне на подходящи филтри, последвано от прехвърляне на концентратите в разтвор. Органичните съединения, намиращи се под формата на газове и пари в атмосферата, могат да бъдат определени полярографски, след като се абсорбират от специално подбрани разтвори. Металите и различните съединения в биологичните материали обикновено се определят полярографски след тяхното извличане. Всички полярографски измервания, включително IEA (IVA), могат да бъдат напълно автоматизирани, което е от съществено значение при извършване на серийни анализи.
Една от най-важните области на приложение на полярографията е определянето на кислород във вода. За целта се използват амперометрични детектори, генериращи ток, пропорционален на концентрацията на кислород в разтвора.
Чрез прилагане на ензим върху повърхността на мембраната на детектора е възможно да се получат различни ензимни амперометрични сензори, удобни за биохимични и клинични анализи. Такива сензори се използват и в системи за мониторинг на околната среда.
Електродите, работещи на електрокаталитичен принцип, са подходящи за наблюдение на различни газове (SO 2, H 2 S, CO, NO x) във въздуха на промишлени помещения. Електрохимичните реакции на тези газове (играещи ролята на катализатор), протичащи на повърхността на електрода, генерират ток в електродната система, който е функционално свързан с концентрацията на газовете във въздуха.
Използването на полярографията не се ограничава до анализ на дискретни проби и методът постепенно преминава към принципите на непрекъснат анализ на газове и течности.
Волтаметричните полярографски детектори се използват успешно във високоефективната течна хроматография (HPLC). В този случай комбинацията от високоселективен метод за разделяне с чувствителен метод за откриване води до забележимо разширяване на обхвата на веществата, определени чрез хроматографския метод (следи от силно токсични вещества, хербициди, лекарства, стимуланти на растежа и др.).
Подробности за метода могат да бъдат изяснени в специализираната литература.
Потенциометрия– метод за определяне на концентрацията на вещества, базиран на измерване на ЕДС на обратими галванични елементи.
На практика се използват два аналитични метода: директенпотенциометрияза определяне на активността на частиците, която може да се изчисли с помощта на уравнението на Нернст от ЕДС на галваничния елемент, и потенциометрично титруване , при който промяната в активността на химичните вещества по време на процеса на титруване води до промяна в ЕДС на галваничния елемент.
Оборудването за извършване на потенциометрично титруване и за директна потенциометрия е едно и също. Потенциометричната измервателна верига включва индикаторен електрод и референтен електрод със стабилен постоянен потенциал, както и вторично устройство. Принципната диаграма на метода е показана в ориз. 3.

1 – индикаторен електрод; 2 - референтен електрод
Ориз. 3. Потенциометрична клетка
Потенциалът на чифт електроди е постоянен. Промяната на концентрацията на аналита в разтвора променя ЕМП на веригата. Индикаторните електроди обикновено се предлагат по четири видове, в зависимост от използваната мембрана, която разделя електродния разтвор от тестовия разтвор: 1) електроди с хомогенна мембрана от прахообразен или кристален материал; 2) електроди с хетерогенна мембрана, в която активното вещество на електрода е разпределено, например, в силиконова гума; 3) електроди с течна мембрана, в която мембраната е разтвор, нанесен върху неутрално вещество, например поресто стъкло; 4) стъклени електроди с различен химичен състав на стъклото.
Индикаторните електроди придобиват потенциала на разтвора, в който са поставени. Има два Типиндикаторни електроди:
1) индиферентни електроди (неразрушими по време на електролиза);
2) електроди, които се променят (окисляват или редуцират) по време на измерванията.
Роля индиферентни електроди(те понякога се наричат електроди третивид) е да отдадете или да получите електрони, т.е. да бъдат проводници на електричество. Такива електроди могат да бъдат направени от злато, полирана платина, графит и други материали. Примери за променливи електроди (понякога наричани електроди) първивид) могат да бъдат пластини от мед, цинк и други метали, както и хинхидронови и водородни индикаторни електроди. Освен това могат да бъдат индикаторни електроди йон селективни мембранни електроди за определяне на множество катиони: Li +, Pb +, Cs +, Tl +, NH +, Na +, K +, Ag + и др. Като референтни електроди ( стандартенелектроди), чийто потенциал остава постоянен по време на измерването, най-често използваните са например нормални и децинормални каломелови (каломелови) електроди с потенциали съответно +0,282 V и +0,334 V, както и електрод от наситен сребърен хлорид с потенциал +0,201 V.
В идеалния случай директното потенциометрично измерване на ЕМП на галванична клетка може да бъде свързано чрез уравнението на Нернст с активността на определяната частица или с концентрацията, ако са известни съответните коефициенти на активност:
![]()
Където д 0 – стандартен електроден потенциал, V; Р– газова константа; T– абсолютна температура; F –число на Фарадей; н– брой загубени или получени електрони; , [редуциран] – равновесни концентрации съответно на окислени и редуцирани форми, mol/dm 3 .
Ако заместим референтните стойности на константите и преминем от натурален логаритъм към десетичен, тогава за температура от 25 ° C получаваме:

Най-важният показател за характеризиране на състоянието на околната среда е стойността на pH на тази среда, чието определяне ( pH-метрия ) понастоящем обикновено се извършва с помощта на стъклени индикаторни (измервателни) електроди. За дългосрочни измервания са разработени специални конструкции на стъклени електроди с допълнителни устройства, които осигуряват почистване на стъклената мембрана. Стъклените електроди, покрити с полупропусклива мембрана с електролитен филм, също служат като основа за различни видове сонди ( сензори ), използвани при анализа на вода и въздух при производствени условия за редица замърсители (NH 3, CO 2, NO x, SO 2, H 2 S и др.).
Процесът в областта на създаването на йонселективни електроди (ISE) позволява наблюдение на йони F – , I – , Br – , Cl – , CN – , SCN – , NO 3 – , NO 2 – , ClO 4 – , S 2 – , Na + , K + Ca 2+ , Ag + , Cu 2+ , Cd 2+ , Pb 2+ в граници на концентрация от 10 –2 до 10 –7 mol/l (приблизително 1–10 –5 mg/ml). Мониторингът чрез ISE се характеризира с бързина, простота и по-големи възможности за извършване на непрекъснати измервания. Разработени са ISE, които са селективни към широк клас органични вещества, както и изомери в тяхната маса, повърхностноактивни вещества и детергенти, намиращи се във въздуха на производствената зона и режима за управление на водите на промишлените предприятия.
Потенциометрията се използва и при измерване на редокс потенциалите на различни редокс (O/R) системи във водата. По правило резултатите от измерването съответстват на смесен потенциал, тъй като няколко O/W системи обикновено съществуват едновременно във вода.
Трябва да се отбележи, че използването на сензори, базирани на полупроводникови металооксидни химически селективни и йон-селективни транзистори с полеви ефекти (HSFT, ISFT), е обещаващо. Селективността в тези системи се постига чрез избор на състава на мембраната и слоя, нанесен върху портата на транзистора. Системата е потопена в анализирания разтвор и потенциалната разлика между референтния електрод и гейта на транзистора модулира тока, протичащ между неговия източник и изтичане. Поради селективността на мембраната или отложения слой, модулираният ток става функция на активността на съответния компонент на разтвора. Полупроводниковите сензори формират основата на монитори и анализатори на различни газове и пари. Малкият размер на такива сензори дава възможност да се комбинират под формата на мозайка върху един субстрат, така че да се получи анализатор, който може да следи цял набор от вредни вещества. Сигналите от отделните сензори, включени в мозайката, могат да се записват последователно и периодично от измервателния център на аналитичната система.
Развитието на микроелектрониката прави възможно проектирането на компактни анализатори тип сонда с помощта на съвременни ISE. В този случай в дръжката на сондата може да се монтира схема, която обработва реакцията от обекта за контрол на околната среда и дори дисплей.
В специализираната литература можете да разберете подробности за метода, , , .
Кулонометриченметодът за анализ е измерване на тока на електродната реакция, в която изследваното вещество влиза в кулонометричната клетка с анализирания поток. Схематичната диаграма на кулонометрична клетка е показана в ориз. 4.

1 – катодна камера; 2 – анодна камера; 3 – микроамперметър
Ориз. 4. Схема на кулонометрична клетка
Кулонометричният анализ се основава на измерване на количеството електроенергия, изразходвано за количествено извършване на даден електрохимичен процес в дадена проба, т.е. при условие, че текущата ефективност е 100%. Това е количеството електричество с помощта на токово-времев интегратор, свързан последователно с измервателната клетка, или кулометър-електролизатор, в който се извършва електрохимичен процес със сто процента токова ефективност, придружен от освобождаване на вещество, чието количество може лесно и точно да се възстанови.
В съответствие със Закон на Фарадей:
м( х)/М(х) = м(к)/М(к),
Където м(х), m(k) –масата на определяното вещество хи съответно веществото, освободено в кулометъра; М(х), М(к) – моларна маса на еквивалентите на веществото хи вещество, освободено в кулометъра, g/mol.

Изчислението може да се направи и с помощта на уравнението, описващо закона на Фарадей:
![]()
ако силата на тока се измерва по време на анализа i, A и време T, s, изразходвани за провеждане на електрохимичния процес.
В друга модификация на този метод, наречена
кулонометрично титруване
, титрантът се генерира електролитно в анализирания разтвор при даден ток. Консумацията на титрант в аналитичната реакция се замества от заряда, протичащ през разтвора, когато титрантът се генерира, докато се достигне точката на еквивалентност.
Един от предимствата на кулонометричните методие, че процесът на стандартизация на титранта често не е необходим, тъй като изчисленията се основават на константата на Фарадей, т.е. методът е абсолютен и ви позволява да оцените количеството на определяното вещество, а не неговата концентрация. Недостатъкът на кулонометрията с даден потенциал е продължителността на процедурата за анализ, свързана с необходимостта от пълно завършване на електролизата. Компютърната технология дава възможност да се намали това време чрез прогнозиране на края на електролизата чрез математическа обработка на кривата ток-време за началните етапи на електролизата и чрез изчисляване на количеството електричество или концентрацията на вещество в разтвора. При анализиране на многокомпонентни проби може да се използва сканираща кулонометрия , при които електролизният потенциал се променя непрекъснато или стъпаловидно. За такива системи кулонометричното титруване е за предпочитане пред директната кулонометрия, тъй като 100% токова ефективност при генериране на титрант може лесно да бъде постигната чрез правилния избор на реагент за титриране и състав на работната среда. Кулонометричното титруване е приложимо за определяне на вещества от 0,01 до 100 mg (понякога под 1 μg). Обемът на работната проба обикновено е от 10 до 50 ml. Методът се характеризира с висока точност, относителната грешка не надвишава няколко десети от процента дори при кулонометрично титруване на микрограмово съдържание. При оптимални условия титруването може да се извърши с много ниски общи грешки от 0,01% (отн.). Различни киселинно-основни, редокс; Опциите за утаяване и комплексометрично титруване могат да се извършват кулонометрично.
Кулонометрични газови анализатори и акваанализатори („кулонометри“) са разработени и произведени за определяне на серен диоксид и сероводород (сулфати и сулфиди), озон (и водороден пероксид), хлор във въздуха (и активен хлор във вода), въглероден оксид и азотен диоксид във въздуха (нитрати и нитрити във вода). Кулонометрията се използва и като електрохимичен инструмент за откриване в течната хроматография.
Подробности за метода могат да бъдат намерени в специализирана литература.
Кондуктометричен методанализът се основава на измерване на електрическата проводимост на разтвора. Кондуктометричният метод за анализ се състои в измерване на промяната в съпротивлението на електролитен разтвор, когато компонент от сместа се абсорбира. Кондуктометричните инсталации се използват например за определяне на въглероден оксид и диоксид, бензинови пари, амоняк и др.
Електрическата проводимост е реципрочната на съпротивлението Р, размерът му е cm (Siemens) т.е. æ = 1/ Р.
Електрическата проводимост на разтвора зависи от броя на йоните в единица обем на разтвора, т.е. върху концентрацията СЪС, върху подвижността на тези йони – V.Въз основа на известни връзки
![]()
Където З– разстояние между електродите; С -площ на електрода; к– коефициент на пропорционалност.
За определена двойка електроди с постоянно разстояние между тях С/З= конст. Тогава
![]() ,
,
Където к 1 = к(С/З).
При извършване на изчисления в кондуктометрията се използва понятието "електропроводимост" æ 0:
![]()
При изчисленията е удобно да се използва еквивалентната електрическа проводимост, която е равна на:
Където П -брой молове еквивалент в 1 cm 3 разтвор. Еквивалентната електрическа проводимост l ¥ при безкрайно разреждане е равна на сумата от подвижността на катиони Uи анион V.
Съотношението на еквивалентната електрическа проводимост на слаб електролитен разтвор към еквивалентната електрическа проводимост на този електролит при безкрайно разреждане е равно на степента на дисоциация a на този електролит:
Въпреки своята неспецифичност, този метод се използва доста често в системите за мониторинг на околната среда в сравнение с други електрохимични методи. Това се обяснява с факта, че при оценката на замърсяването, например на водата и атмосферата, е възможен не поетапен, а изходен (окончателен) контрол на промишлените процеси. Поради изключително ниската електрическа проводимост на водата, често е достатъчно да се оцени общото съдържание на замърсители, което осигурява кондуктометрията. Типични примери за използване на кондуктометрични методи в мониторинга на околната среда са анализаторите на детергентите в отпадъчните води, концентрацията на синтетични компоненти в напоителните системи и качеството (солеността) на питейната вода. Кондуктометричните анализатори се използват за непрекъснат мониторинг на замърсители във въздуха и валежите като SO 2 и H 2 SO 4 . В допълнение към директна кондуктометрияможе да се използва за определяне на определени видове замърсяване непрякметоди, които осигуряват много ефективни оценки на съдържанието на изброените по-горе вещества, които взаимодействат преди измерване със специално подбрани реактиви и регистрираната промяна в електропроводимостта се причинява само от наличието на съответните продукти в реакцията. По този начин можете да определите азотните оксиди след тяхната каталитична редукция на преамоняк, както и HCl, HBr и CO 2 след предварителна реакция с Ba(OH) 2 или NaOH. Описаният принцип за определяне на CO 2 може да се използва и за индиректно определяне на органични вещества във вода.
В допълнение към класическата кондуктометрия има и високочестотна версия ( осцилометрия ), при които индикаторната електродна система не влиза в контакт с пробата. Този принцип често се прилага в анализатори на непрекъсната проводимост.
Електрохимичните методи за анализ също са описани в редица учебни и специални публикации.
ЛИТЕРАТУРА
1. Другов Ю.С., Роден А.А.Аналитична химия на околната среда.
Санкт Петербург: 2002. – 464 с.
2. Пашкевич М.А., Шуйски В.Ф. Мониторинг на околната среда.Урок. Държавен университет в Санкт Петербург. – Санкт Петербург, 2002. – 90 с.
3. Катрал Робърт У. Химически сензори.М.: Научен свят, 2000. – 144 с.
4. Турян Я.И., Рувински О.Е., Зайцев П.М.Полярографска каталиметрия.М.: Химия, 1998. – 272 с.
5. Будников Г.К., Майстренко В.Н., Муринов Ю.И. Волтаметрия с модифицирани и ултрамикроелектроди.М.: Наука, 1994. – 239s.
6. Браинина Х.З., Нейман Е.Я., Слепушкин В.В. Инверсионни електроаналитични методи.М.: 1988. – 240 с.
7. Салихджанова Р.Ф. и т.н. Полярографи и използването им в практически анализи и изследвания.М.: Химия, 1988. – 192 с.
8. Каплан Б.Я., Пац Р.Г., Салихджанова Р.Ф. AC волтаметрия.М.: Химия, 1985. – 264.
9. Бонд А.М. Полярографски методи в аналитичната химия.М.: Химия, 1983.
10. Ефременко О.А. Потенциометричен анализ.М.: ВМА им. ТЯХ. Сеченова, 1998.
11. Справочно ръководство за прилагане на йон селективни електроди.М.: Мир, 1986.
12. Корита И. Йони, електроди, мембрани.М.: Мир, 1983.
13. Николски Б.В., Матерова Е.А. Йоноселективни електроди.Л.: Химия, 1980.
14. Ефременко О.А.Кулонометрично титруване.М.: ВМА им. ТЯХ. Сеченова, 1990.
15. Худякова Т.А., Корешков А.П. Кондуктометричен метод за анализ.Учебник за ВУЗ. М.: Висше училище, 1975. – 207 с.
16. Будников Г.К., Майстренко В.Н., Вяселев М.Р. Основи на съвременния електрически анализ.М.: Химия, 2000.
17. Прохорова Г.В. Въведение в електрохимичните методи за анализ.М.: Издателство на Московския държавен университет, 1991. – 97 с.
18. Електроаналитични методи в мониторинга на околната среда. /Ред. Р. Калвода, Р. Зика, К. Щулик и др., М.: Химия, 1990. – 240 с.
19. Пламбек Дж.Електрохимични методи за анализ. Основи на теорията и приложението./Прев. от английски М.: Мир, 1986.
Описание на работата
Съвременните отрасли на производството и социалния живот на хората поставят свои специфични задачи пред физичните и химичните методи за анализ за контрол на качеството на продуктите. Един от основните физикохимични методи за анализ са електрохимичните методи за анализ.
Тези методи могат бързо и сравнително точно да определят много показатели за качество на продукта.
Електрохимичните методи за анализ на състава на материята се използват широко в различни индустрии. Те ви позволяват да автоматизирате получаването на резултати за качеството на продукта и да коригирате нарушенията, без да спирате производството. В хранително-вкусовата промишленост тези методи определят киселинно-алкалния баланс на продукта, наличието на вредни и токсични вещества и други показатели, които влияят не само на качеството, но и на безопасността на храните.
Оборудването, предназначено за електрохимичен анализ, е сравнително евтино, достъпно и лесно за използване. Поради това тези методи се използват широко не само в специализирани лаборатории, но и в много индустрии.
В тази връзка целта на тази ку
ВЪВЕДЕНИЕ 2
ТЕОРЕТИЧНА ЧАСТ 3
1.1 Общи характеристики на физикохимичните методи за анализ 3
1.2 Характеристики на електрохимичните методи 4
1.3 Класификация на електрохимичните методи за анализ 5
2 ЕКСПЕРИМЕНТАЛНО-ПРАКТИЧЕСКА ЧАСТ 15
ЗАКЛЮЧЕНИЕ 21
ЛИТЕРАТУРА 22
Въведение
Глава 1. Общи понятия. Класификация на електрохимичните методи за анализ
Глава 2. Потенциометрични методи за анализ (потенциометрия)
1 Принцип на метода
3 Потенциометрично титруване
Глава 3. Кондуктометричен метод за анализ
1 Принцип на метода. Основни понятия
2 Принцип на кондуктометрията
3 Кондуктометрично титруване
Глава 4. Кондуктометричен анализ (кондуктометрия)
1 Същност на метода
2 Количествен полярографски анализ
3 Приложения на полярографията
Глава 5. Амперометрично титруване
Глава 6. Кулонометричен анализ (кулонометрия)
1 Принцип на метода
3 Кулонометрично титруване
Заключение
Библиография
ВЪВЕДЕНИЕ
Електрохимичните методи за анализ са набор от методи за качествен и количествен анализ, основани на електрохимични явления, възникващи в изследваната среда или на границата и свързани с промени в структурата, химичния състав или концентрацията на аналита.
Електрохимичните методи за анализ се разделят на пет основни групи: потенциометрия, волтаметрия, кулометрия, кондуктометрия и амперометрия.
Използването на тези методи при количествен анализ се основава на зависимостта на стойностите на измерените параметри по време на електрохимичния процес от отделеното вещество в анализирания разтвор, участващо в този електрохимичен процес. Такива параметри включват разликата в електрическия потенциал и количеството електричество. Електрохимичните процеси са процеси, които са съпроводени едновременно с химическа реакция и промяна в електрическите свойства на системата, която в такива случаи може да се нарече електрохимична система. В аналитичната практика една електрохимична система обикновено съдържа електрохимична клетка, включваща съд, съдържащ електропроводим тестов разтвор, в който са потопени електроди.
Има директни и индиректни електрохимични методи. При директните методи се използва зависимостта на силата на тока (потенциал и др.) от концентрацията на определяния компонент. При индиректните методи силата на тока (потенциал и др.) се измерва, за да се намери крайната точка на титруване на определяния компонент с подходящ титрант, т.е. използва се зависимостта на измерения параметър от обема на титранта.
ГЛАВА 1. ОБЩИ ПОНЯТИЯ. КЛАСИФИКАЦИЯ НА МЕТОДИ ЗА ЕЛЕКТРОХИМИЧЕН АНАЛИЗ
Електроаналитичната химия включва електрохимични методи за анализ, базирани на електродни реакции и пренос на електричество през разтвори.
Използването на електрохимични методи в количествения анализ се основава на използването на зависимости на стойностите на измерените параметри на електрохимичните процеси (електрическа потенциална разлика, ток, количество електричество) от съдържанието на аналита в анализирания разтвор, участващ в този електрохимичен процес. Електрохимичните процеси са процеси, които са придружени от едновременното протичане на химични реакции и промяна в електрическите свойства на системата, която в такива случаи може да се нарече електрохимична система. В аналитичната практика електрохимичната система обикновено съдържа електрохимична клетка, включително съд с електропроводим тестов разтвор, в който са потопени електроди.
Класификация на електрохимичните методи за анализ. Електрохимичните методи за анализ се класифицират по различни начини.Класификацията се основава на отчитане на естеството на източника на електрическа енергия в системата. Има две групи методи:
а) Методи без налагане на външен (чужд) потенциал.
Източникът на електрическа енергия е самата електрохимична система, която е галваничен елемент (галванична верига). Тези методи включват потенциометрични методи. Електродвижещата сила - EMF - и електродните потенциали в такава система зависят от съдържанието на аналита в разтвора.
б) Методи с налагане на външен (чужд) потенциал. Тези методи включват:
кондуктометричен анализ - базира се на измерване на електропроводимостта на разтвори като функция от тяхната концентрация;
волтаметричен анализ - базиран на измерване на тока като функция от приложената известна потенциална разлика и концентрацията на разтвора;
кулонометричен анализ - базиран на измерване на количеството електричество, преминаващо през разтвор, като функция на неговата концентрация;
електрогравиметричен анализ - базира се на измерване на масата на продукта от електрохимична реакция.
Класификация според начина на приложение на електрохимичните методи. Има директни и косвени методи.
а) Директни методи. Електрохимичният параметър се измерва като известна функция от концентрацията на разтвора и според показанията на съответния измервателен уред се установява съдържанието на определяното вещество в разтвора.
б) Индиректните методи са методи на титруване, при които краят на титруването се определя въз основа на измервания на електрическите параметри на системата.
В съответствие с тази класификация се прави разлика между например директна кондуктометрия и кондуктометрично титруване.
ГЛАВА 2. МЕТОД ЗА ПОТЕНЦИОМЕТРИЧЕН АНАЛИЗ (ПОТЕНЦИОМЕТРИЯ)
1 Принцип на метода
Потенциометричният анализ (потенциометрия) се основава на измерването на емф и електродните потенциали като функция от концентрацията на анализирания разтвор.
Ако в електрохимична система - в галванична клетка - протича реакция на електродите:
aA+bB↔dD + eE
с прехвърлянето на n електрони, тогава уравнението на Нернст за емф E на тази реакция има формата:
E꞊E˚- RTnFlnaDda Eea(A)a aBb
където, както обикновено, E° е стандартната ЕМП на реакцията (разликата в стандартните електродни потенциали), R е газовата константа, T е абсолютната температура, при която протича реакцията, F е числото на Фарадей; a(A), a(B), a(D) и i(E) - активността на реагентите, участващи в реакцията. Уравнение (10.1) е валидно за ЕДС на реверсивно работещ галваничен елемент.
За стайна температура уравнение (10.1) може да бъде представено във формата:
E꞊E˚- 0,059nlnaDda Eea(A)a aBb
При условия, при които активността на реагентите е приблизително равна на техните концентрации, уравнение (1) става уравнение (3):
꞊E˚- RTnFlncDdc EecAa aBb
където c(A), c(B), c(E), c(D) са концентрациите на реагентите. За стайна температура това уравнение може да бъде представено като (4):
꞊E˚- 0,059nlncDdc EecAa aBb
За потенциометрични измервания в електрохимична клетка се използват два електрода: индикаторен електрод, чийто потенциал зависи от концентрацията на анализираното (определящо потенциала) вещество в анализирания разтвор, и референтен електрод, чийто потенциал остава постоянен при условия на анализ. Следователно величината на ЕМП, определена от уравнения (1)-(4), може да се изчисли като разликата между реалните потенциали на тези два електрода.
В потенциометрията се използват следните видове електроди: електроди от първи, втори вид, редокс, мембранни електроди.
Електродите от първия вид са електроди, които са обратими от катион, общ за електродния материал. Има три вида електроди от първия вид.
а) Метал М, потопен в разтвор на сол на същия метал. На повърхността на такива електроди възниква обратима реакция:
Mn+ + ne = M
Реалният потенциал на такъв електрод от първи вид зависи от активността a(Mn+) на металните катиони и се описва с уравнения (5)-(8).
Като цяло, за всяка температура:
꞊E˚+ RTnFln a(Mn+)
За стайна температура:
꞊E˚+ 0,059nln a(Mn+)
При ниски концентрации c(Mn+), когато активността на a(Mn+) металните катиони е приблизително равна на тяхната концентрация:
꞊E˚+ RTnFln c(Mn+)
За стайна температура:
b) Газови електроди, например водороден електрод, включително стандартен водороден електрод. Потенциалът на обратимо работещ газов водороден електрод се определя от активността на водородните йони, т.е. рН стойността на разтвора и при стайна температура е равна на:
꞊E˚+ 0,059 lg a(H30+) = 0,059 lg a(H3O+) = -0,059рН
тъй като за водороден електрод стандартният потенциал се приема за нула ( £° =0), и в съответствие с електродната реакция: H++e = N броят на електроните, участващи в тази реакция, е равен на единица: n = 1. в) Амалгамени електроди, които представляват метална амалгама, потопена в разтвор, съдържащ катиони на същия метал. Потенциалът на такива електроди от първи вид зависи от активността на a(Mn+) метални катиони в разтвора и активността на a(M) метал в амалгамата: ꞊E˚+ RTnFlna(Mn+)a(M) Амалгамните електроди са силно обратими. Електродите от втория тип са анионни обратими. Разграничават се следните видове електроди от втория тип. а) Метал, чиято повърхност е покрита с умерено разтворима сол на същия метал, потопен в разтвор, съдържащ анионите, които изграждат тази трудно разтворима сол. Пример за това е сребърнохлоридният електрод Ag|AgCl, KS1 или каломеловият електрод Hg|Hg2Cl2, KS1. Електродът от сребърен хлорид се състои от сребърна жица, покрита с леко водоразтворима сол AgCI, потопена във воден разтвор на калиев хлорид. Възниква обратима реакция при електрода от сребърен хлорид Каломеловият електрод се състои от метален живак, покрит с паста от слабо разтворим живачен (1) хлорид Hg2Cl2 - каломел, в контакт с воден разтвор на калиев хлорид. Настъпва обратима реакция при каломелния електрод: Cl2 + 2e = 2Hg + 2SG. Реалният потенциал на електродите от втория вид зависи от активността на анионите и за обратим електрод, върху който протича реакцията: Ne = M + An- описани от уравненията на Нернст (9)-(12). Като цяло, при всяка приемлива температура T: ꞊E˚- RTnFln a(An-) За стайна температура: ꞊E˚- 0,059nln a(An-) За условия, при които активността на анионите е приблизително равна на тяхната концентрация c(A"~): E꞊E˚- RTnFln c(An-) За стайна температура: ꞊E˚- 0,059nln c(An-) Например, реалните потенциали E1 и E2 съответно на електродите от сребърен хлорид и каломел при стайна температура могат да бъдат представени като: ꞊E1˚- 0,0591g a(Cl-),꞊E2˚- 0,0591g a(Cl-). Електродите от втория тип са силно обратими и стабилни при работа, така че често се използват като референтни електроди, способни стабилно да поддържат постоянна стойност на потенциала. б) Газови електроди от втори тип, например хлорен електрод Pt, Cl2 KS1. Газовите електроди от втория тип рядко се използват в количествения потенциометричен анализ. Редокс електродите се състоят от инертен материал (платина, злато, волфрам, титан, графит и др.), потопен в разтвор, съдържащ окислени Ox и редуцирани червени форми на това вещество. Има два вида редокс електроди: а) електроди, чийто потенциал не зависи от активността на водородните йони, например Pt | FeCl3, FeCI2, Pt | К3, К4 и др.; б) електроди, чийто потенциал зависи от активността на водородните йони, например хинхидронов електрод. На редокс електрода, чийто потенциал не зависи от активността на водородните йони, възниква обратима реакция: Ox + ne = Червено Реалният потенциал на такъв редокс електрод зависи от активността на окислените и редуцирани форми на дадено вещество и за обратимо работещ електрод се описва, в зависимост от условията (по аналогия с потенциалите, обсъдени по-горе), от уравненията на Нернст ( 13)-(16): ꞊E˚+ RTnFln a (Ox)a (червено)꞊E˚+ 0,059nlg a (Ox)a (червено)꞊E˚+ RTnFln c(Ox)c (червено)꞊E˚+ 0,059nlg c (Ox) c (червен) Ако водородните йони участват в електродната реакция, тогава тяхната активност (концентрация) се взема предвид в съответните уравнения на Нернст за всеки конкретен случай. Мембранните или йон-селективните електроди са електроди, които са обратими за определени йони (катиони или аниони), сорбирани от твърда или течна мембрана. Реалният потенциал на такива електроди зависи от активността на онези йони в разтвора, които се сорбират от мембраната. Твърдите мембранни електроди съдържат много тънка мембрана, от двете страни на която има различни разтвори, съдържащи едни и същи йони за определяне, но с различни концентрации: разтвор (стандарт) с точно известна концентрация на йоните за определяне и разтвор за анализиране с неизвестна концентрация на йоните, които трябва да се определят. Поради различните концентрации на йони в двата разтвора, йони от различните страни на мембраната се сорбират в неравни количества и електрическият заряд, произтичащ от сорбцията на йони от различните страни на мембраната, също е различен. В резултат на това възниква мембранна потенциална разлика. Определянето на йони с помощта на мембранни йон-селективни електроди се нарича йонометрия. Както бе споменато по-горе, при потенциометричните измервания електрохимичната клетка включва два електрода - индикаторен електрод и референтен електрод. Големината на ЕМП, генерирана в клетката, е равна на потенциалната разлика между тези два електрода. Тъй като потенциалът на референтния електрод остава постоянен при условията на потенциометрично определяне, ЕДС зависи само от потенциала на индикаторния електрод, т.е. върху активността (концентрацията) на определени йони в разтвора. Това е основата за потенциометричното определяне на концентрацията на дадено вещество в анализирания разтвор. За потенциометрично определяне на концентрацията на вещество в разтвор се използват както директна потенциометрия, така и потенциометрично титруване, въпреки че вторият метод се използва много по-често от първия. Определянето на концентрацията на веществото при директна потенциометрия обикновено се извършва с помощта на метода на калибровъчната крива или метода на стандартното добавяне. а) Метод на калибровъчна графика. Пригответе серия от 5-7 стандартни разтвора с известно съдържание на аналита. Концентрацията на аналита и йонната сила в стандартните разтвори не трябва да се различават значително от концентрацията и йонната сила на анализирания разтвор: при тези условия грешките при определяне са намалени. Йонната сила на всички разтвори се поддържа постоянна чрез въвеждане на индиферентен електролит. Стандартните разтвори се въвеждат последователно в електрохимична (потенциометрична) клетка. Обикновено тази клетка е стъклена чаша, в която са поставени индикаторен електрод и референтен електрод. ЕМП на стандартните разтвори се измерва чрез щателно измиване на електродите и стъклото с дестилирана вода преди пълнене на клетката с всеки стандартен разтвор. Въз основа на получените данни се построява калибровъчна графика в EMF-log c координати, където c е концентрацията на аналита в стандартния разтвор. Обикновено тази графика е права линия. След това анализираният разтвор се добавя към електрохимичната клетка (след измиване на клетката с дестилирана вода) и се измерва ЕДС на клетката. С помощта на графиката за калибриране се намира log c(X), където c(X) е концентрацията на аналита в анализирания разтвор. б) Стандартен метод на добавяне. Известен обем V(X) от анализирания разтвор с концентрация c(X) се добавя към електрохимичната клетка и се измерва ЕДС на клетката. След това точно измерен малък обем от стандартен разтвор V(st) с известна, достатъчно голяма концентрация c(st) на аналита се добавя към същия разтвор и отново се определя ЕДС на клетката. Изчислете концентрацията c(X) на аналита в анализирания разтвор, като използвате формула (10.17): c(X)= c(st) V (st)V X+ V (st) Където △ E е разликата между две измерени стойности на ЕМП, n е броят на електроните, участващи в електродната реакция. Приложение на директна потенциометрия. Методът се използва за определяне на концентрацията на водородни йони (pH на разтвори), аниони и метални йони (йонометрия). При използване на директна потенциометрия изборът на подходящ индикаторен електрод и точното измерване на равновесния потенциал играят важна роля. При определяне на pH на разтвори като индикаторни електроди се използват електроди, чийто потенциал зависи от концентрацията на водородни йони: стъкло, водород, хинхидрон и някои други. По-често се използва мембранен стъклен електрод, който е обратим във водородни йони. Потенциалът на такъв стъклен електрод се определя от концентрацията на водородни йони, следователно ЕМП на верига, включваща стъклен електрод като индикатор, се описва при стайна температура с уравнението: К + 0,059рН, където константата K зависи от материала на мембраната и естеството на референтния електрод. Стъкленият електрод ви позволява да определите pH в диапазона pH = 0-10 (по-често в диапазона pH = 2-10) и е силно обратим и стабилен при работа. Електродът хинхидрон, често използван в миналото, е редокс електрод, чийто потенциал зависи от концентрацията на водородни йони. Състои се от платинова жица, потопена в киселинен разтвор (обикновено НС1), наситен с хинхидрон, еквимолекулно съединение на хинон и хидрохинон със състав C6H402 C6H4(OH)2 (тъмнозелен прах, слабо разтворим във вода). Схематично обозначение на хинхидронов електрод: Pt | хинхидрон, НС1. На хинхидроновия електрод възниква редокс реакция: C6H402 + 2H+ + 2e = C6H4(OH)2 Потенциалът на хинхидроновия електрод при стайна температура се описва с формулата E°-0.059рН. Квинхидроновият електрод ви позволява да измервате pH на разтвори в диапазона pH = 0-8,5. При pH< 0 хингидрон гидролитически расщепляется: при рН >8.5 хидрохинон, който е слаба киселина, претърпява реакция на неутрализация.Хинхидроновият електрод не може да се използва в присъствието на силни окислители и редуциращи агенти. Мембранните йон-селективни електроди се използват, както беше отбелязано по-горе, в йонометрията като индикатори за определяне на различни катиони (Li+, Na+, K+ Mg2t, Ca2+, Cd2+, Fe2+, Ni2+ и др.) йони (F-, Cl-, Br -, I-, S2- и т.н.). Предимствата на директната потенциометрия включват простотата и скоростта на измерванията; измерванията изискват малки обеми разтвори. 3Потениометрично титруване Потенциометричното титруване е метод за определяне на обема на титранта, изразходван за титруване на аналита в анализирания разтвор чрез измерване на EMF (по време на процеса на титруване) с помощта на галванична верига, съставена от индикаторен електрод и референтен електрод. При потенциометрично титруване се титрува анализираният разтвор, намиращ се в електрохимична клетка подходящ титрант, фиксиращ края на титруването чрез рязка промяна на ЕМП на измерваната верига - потенциалът на индикаторния електрод, който зависи от концентрацията на съответните йони и се променя рязко в точката на еквивалентност. Промяната в потенциала на индикаторния електрод по време на процеса на титруване се измерва в зависимост от обема на добавения титрант. Въз основа на получените данни се построява потенциометрична крива на титруване и по тази крива се определя обемът на изразходвания титрант в горивната клетка. Потенциометричното титруване не изисква използването на индикатори, които променят цвета си в близост до горивния елемент. Приложение на потенциометрично титруване. Методът е универсален, може да се използва за обозначаване на края на титруването при всички видове титруване: киселинно-основно, редокс, комплексиметрично, утаяване и при титруване в неводни среди. Като индикаторни електроди се използват стъклени, живачни, йонселективни, платинени и сребърни електроди, а като еталонни електроди се използват каломелни, сребърнохлоридни и стъклени електроди. Методът има висока точност и голяма чувствителност: позволява титруване в мътна, оцветена, неводна среда и отделно определяне на компонентите на сместа в един анализиран разтвор, например отделно определяне на хлоридни и йодидни йони по време на аргентометрично титруване. Методите на потенциометрично титруване се използват за анализ на много лекарствени вещества, например аскорбинова киселина, сулфатни лекарства, барбитурати, алкалоиди и др. За основоположник на кондуктометричния анализ се смята немският физик и физикохимик Ф.В.Г. Kohlrausch (1840-1910), който за първи път през 1885 г. предлага уравнение, установяващо връзка между електрическата проводимост на разтвори на силни електролити и тяхната концентрация. IN средата на 40-те ХХ век е разработен метод за високочестотно кондуктометрично титруване. От началото на 60-те години. ХХ век Кондуктометричните детектори започват да се използват в течната хроматография. 1 Принцип на метода. Основни понятия Кондуктометричният анализ (кондуктометрия) се основава на използването на връзката между електрическата проводимост (електропроводимост) на електролитни разтвори и тяхната концентрация. Електрическата проводимост на електролитни разтвори - проводници от втори тип - се оценява въз основа на измерване на тяхното електрическо съпротивление в електрохимична клетка, която представлява стъклен съд (стъкло) с два електрода, запоени в него, между които се намира тестовият електролитен разтвор разположен. През клетката преминава променлив електрически ток. Електродите най-често се изработват от метална платина, която за увеличаване на повърхността на електродите се покрива със слой от пореста платина чрез електрохимично отлагане на платинови съединения от разтвори (платинизирани платинени електроди). За да се избегнат усложнения, свързани с процесите на електролиза и поляризация, кондуктометричните измервания се извършват в променливо електрическо поле. Електрическото съпротивление R на слоя електролитен разтвор между електродите, подобно на електрическото съпротивление на проводници от първи вид, е право пропорционално на дължината (дебелината) l на този слой и обратно пропорционално на повърхността S на електродите: R= ρ lS lkS където коефициентът на пропорционалност p се нарича специфично електрическо съпротивление, а обратната стойност k = 1/p се нарича специфична електрическа проводимост (електропроводимост). Тъй като електрическото съпротивление R се измерва в ома, дебелината l на слоя електролитен разтвор е в cm, а повърхността S на електродите е в cm2, специфичната електрическа проводимост k се измерва в единици Ohm-1 cm-1, или, тъй като Ohm-1 е Siemens (Sm), тогава - в единици Sm cm-1. По физичен смисъл специфичната електрическа проводимост е електрическата проводимост на електролитен слой, разположен между стените на куб с дължина на страната 1 cm, числено равна на тока, преминаващ през слой електролитен разтвор с площ на напречното сечение 1 cm2 с приложен градиент на електрически потенциал от 1 V/cm. Специфичната електрическа проводимост зависи от естеството на електролита и разтворителя, от концентрацията на разтвора и от температурата. С увеличаване на концентрацията на електролитния разтвор неговата специфична електрическа проводимост първо се увеличава, след това преминава през максимум и след това намалява. Този характер на промяната в електропроводимостта се дължи на следните причини. Първоначално, с увеличаване на концентрацията на електролита, броят на йоните - тоководещи частици - се увеличава както за силните, така и за слабите електролити. Следователно електрическата проводимост на разтвора (преминаващия през него електрически ток) се увеличава. След това, с увеличаване на концентрацията на разтвора, неговият вискозитет (намаляване на скоростта на движение на йони) и електростатичните взаимодействия между йони се увеличават, което предотвратява увеличаването на електрическия ток и при достатъчно високи концентрации спомага за неговото намаляване. В разтвори на слаби електролити, тъй като концентрацията се увеличава, степента на дисоциация на електролитните молекули намалява, което води до намаляване на броя на йони - проводими частици - и до намаляване на специфичната електрическа проводимост. В разтвори на силни електролити при високи концентрации е възможно образуването на йонни асоциати (йонни близнаци, тройници и др.), Което също благоприятства намаляването на електрическата проводимост. Специфичната електрическа проводимост на електролитните разтвори се увеличава с повишаване на температурата поради намаляване на вискозитета на разтворите, което води до увеличаване на скоростта на движение на йони, а за слабите електролити също до увеличаване на степента на тяхната йонизация (дисоциация на йони). Следователно, количествените кондуктометрични измервания трябва да се извършват при постоянна температура, като се термостатира кондуктометричната клетка. В допълнение към специфичната електрическа проводимост, кондуктометрията използва еквивалентна електрическа проводимост X и моларна електрическа проводимост p. Физически, еквивалентната електрическа проводимост X е електрическата проводимост на слой от електролитен разтвор с дебелина 1 cm, разположен между еднакви електроди с такава площ, че обемът на електролитния разтвор, затворен между тях, съдържа 1 g-equiv от разтвореното вещество. В този случай моларната маса на еквивалента се приема като моларна маса на идентични частици с единично зарядно число („заряд“), например, H+, Br -, 12Ca2+, 13Fe3+ и др. Еквивалентната електрическа проводимост се увеличава с намаляване на концентрацията на електролитния разтвор. Максималната стойност на еквивалентната електропроводимост се постига при безкрайно разреждане на разтвора. Еквивалентната електрическа проводимост, подобно на специфичната проводимост, се увеличава с повишаване на температурата. Еквивалентната електрическа проводимост X е свързана със специфичната електрическа проводимост k чрез връзка (20): λ= 1000 kc При директната кондуктометрия концентрацията на вещество в анализирания разтвор се определя от резултатите от измерванията на специфичната електрическа проводимост на този разтвор. При обработката на данните от измерванията се използват два метода: методът на изчисление и методът на калибровъчната графика. Метод на изчисление. В съответствие с уравнение (10.20), моларната концентрация на еквивалента c на електролита в разтвора може да се изчисли, ако са известни специфичната електрическа проводимост k и еквивалентната електрическа проводимост : c = 1000 kλ Специфичната електрическа проводимост се определя експериментално въз основа на измерване на електрическото съпротивление на термостатирана кондуктометрична клетка. Еквивалентна електропроводимост на разтвора λ равна на сумата от катионните подвижности λ+ и анион X λ -:
λ = λ + + λ-
Ако подвижността на катиона и аниона е известна, тогава концентрацията може да се изчисли по формула (24): c = 1000 kλ + + λ- Това се прави, когато чрез директна кондуктометрия се определя концентрацията на слабо разтворим електролит в неговия наситен разтвор (калций, бариеви сулфати; сребърни халогениди и др.). Метод на калибровъчна графика. Приготвя се серия от стандартни разтвори, всеки от които съдържа точно известна концентрация на аналита, и тяхната електропроводимост се измерва при постоянна температура в термостатирана кондуктометрична клетка. Въз основа на получените данни се изгражда калибрираща графика, нанасяща концентрацията на стандартните разтвори по абсцисната ос и стойностите на специфичната електропроводимост по ординатната ос. В съответствие с уравнение (24), начертаната графика обикновено представлява права линия в относително малък диапазон от промени в концентрацията. В широк диапазон от концентрации, когато подвижността на катиона и аниона, включени в уравнение (24), може да се промени забележимо, се наблюдават отклонения от линейната зависимост. След това, строго при същите условия, се измерва специфичната електрическа проводимост k(X) на електролита, който се определя в анализирания разтвор с неизвестна концентрация c(X) и се намира желаната стойност c(X) от графиката. Така например се определя съдържанието на барий в баритна вода - наситен разтвор на бариев хидроксид. Приложение на директната кондуктометрия. Методът на директната кондуктометрия се характеризира с простота и висока чувствителност. Методът обаче не е много селективен. Директната кондуктометрия има ограничено приложение в анализа. Използва се за определяне на разтворимостта на слабо разтворими електролити, за контрол на качеството на дестилирана вода и течни хранителни продукти (мляко, напитки и др.), за определяне на общото съдържание на соли в минерална, морска, речна вода и в някои други случаи. . 3 Кондуктометрично титруване При кондуктометрично титруване напредъкът на титруването се наблюдава чрез промени в електрическата проводимост на анализирания разтвор, разположен в кондуктометрична клетка между два инертни електрода (обикновено направени от платинирана платина). Въз основа на получените данни се съставя кондуктометрична крива на титруване, отразяваща зависимостта на електропроводимостта на титрувания разтвор от обема на добавения титрант. Крайната точка на титруването най-често се намира чрез екстраполиране на участъци от кривата на титруване в областта, където се променя наклонът й. В този случай не се изисква използването на индикатори, които променят цвета си в близост до TE. При кондуктометрично титруване се използват различни видове реакции: киселинно-основни, редокс, утаяване, процеси на комплексообразуване. Приложение на кондуктометрично титруване. Методът на кондуктометрично титруване има редица предимства. Титруването може да се извърши в мътна, оцветена, непрозрачна среда. Чувствителността на метода е доста висока - до ~10~* mol/l; грешката при определяне варира от 0,1 до 2%. Анализът може да бъде автоматизиран. Недостатъците на метода включват ниска селективност. Концепцията за високочестотно (радиочестотно) кондуктометрично титруване. Напредъкът на титруването се наблюдава с помощта на модифицирана кондуктометрична техника за променлив ток, при която честотата на променливия ток може да достигне от порядъка на милион осцилации в секунда. Обикновено електродите се поставят (прилагат) от външната страна на съда за титруване (клетка за проводимост), така че да не влизат в контакт с титрувания разтвор. Въз основа на резултатите от измерването се изчертава крива на кондуктометрично титруване. Крайната точка на титруването се намира чрез екстраполиране на участъци от кривата на титруване в областта, където нейният наклон се променя. ГЛАВА 4. КОНДУКТОМЕТРИЧЕН АНАЛИЗ (КОНДУКТОМЕТРИЯ) 4.1 Същност на метода Полярографският анализ (полярография) се основава на използването на следните връзки между електрическите параметри на електрохимична (в този случай полярографска) клетка, към която се прилага външен потенциал, и свойствата на анализирания разтвор, съдържащ се в нея. а) Качественият полярографски анализ използва връзката между големината на външния електрически потенциал, приложен върху микроелектрода, при който се наблюдава редукция (или окисление) на аналита върху микроелектрода при дадени условия, и естеството на веществото, което се редуцира (или окислен). б) При количествен полярографски анализ се използва връзката между величината на дифузионния електрически ток и концентрацията на веществото, което се определя (редуциращо или окисляващо) в анализирания разтвор. Електрическите параметри - големината на приложения електрически потенциал и големината на дифузионния ток - се определят чрез анализиране на получените поляризационни или ток-напреженови криви, които графично отразяват зависимостта на електрическия ток в полярографската клетка от големината на приложения потенциал на микроелектрода. Следователно полярографията понякога се нарича директна волтаметрия. Класическият полярографски метод за анализ с помощта на живачен капещ електрод е разработен и предложен през 1922 г. от чешкия учен Ярослав Хейровски (1890-1967), въпреки че самият живачен капещ електрод е използван от чешкия физик Б. Кучера през 1903 г. През 1925 г. J. Heyrovsky и M. Shikata проектират първия полярограф, който дава възможност за автоматично записване на поляризационни криви. Впоследствие бяха разработени различни модификации на полярографския метод. Стойността на средния дифузионен ток iD се определя от уравнението на Илкович (25): където K е коефициентът на пропорционалност, c е концентрацията (mmol/l) на полярографски активното деполяризиращо вещество; iD се измерва в микроампера като разликата между ограничаващия ток и остатъчния ток. Коефициентът на пропорционалност K в уравнението на Илкович зависи от редица параметри и е равен на K=607nD12m23τ16 където n е броят на електроните, участващи в електродната редокс реакция; D е коефициентът на дифузия на редуктора (cm2/s); t е масата на живака, изтичащ от капиляра за секунда (mg); t е времето за образуване (в секунди) на капка живак при полувълнов потенциал (обикновено е 3-5 s). Тъй като коефициентът на дифузия D зависи от температурата, коефициентът на пропорционалност K в уравнението на Илкович се променя с температурата. За водни разтвори в температурния диапазон 20-50 °C, коефициентът на дифузия на полярографски активните деполяризиращи вещества се увеличава с приблизително 3% с повишаване на температурата с един градус, което води до увеличаване на средния дифузионен ток iD с ~1 -2%. Следователно полярографията се извършва при постоянна температура, като полярографската клетка се термостатира обикновено при 25 ± 0,5 ° C. Масата на живака t и времето на образуване на капка t зависят от характеристиките на електрода за капене на живак и височината на живачния стълб в капиляра и в резервоара, свързан с капиляра. Стъклената капилярка на живачен капещ микроелектрод обикновено има външен диаметър 3-7 мм, вътрешен диаметър 0,03 до 0,05 мм и дължина 6-15 см. Височината на живачния стълб от долния край на капиляра до горното ниво на повърхността на живак в резервоара е 40-80 см; Съдържанието на индиферентния електролит в анализирания полярографиран разтвор трябва да бъде приблизително 100 пъти по-високо от съдържанието на определяното деполяризиращо вещество и йоните на фоновия електролит не трябва да се изпускат при полярографски условия, докато полярографски активното вещество не се разреди. Полярографията се извършва с вода, водно-органични смеси (вода - етанол, вода - ацетон, вода - диметилформамид и др.) И неводни среди (етанол, ацетон, диметилформамид, диметилсулфоксид и др.) Като разтворител. Преди да започне полярографията, през анализирания разтвор се пропуска ток от инертен газ (азот, аргон и др.) за отстраняване на разтворения кислород, който също произвежда полярографска вълна поради редукция съгласно следната схема: 2Н+ + 2е = Н202 Н202 + 2Н+ + 2е = 2Н20 Понякога - в случай на алкални разтвори - вместо пропускане на поток от инертен газ, към анализирания разтвор се добавя малко количество активен редуциращ агент - натриев сулфит, метол, който свързва разтворения кислород, като реагира с него. 4.2 Количествен полярографски анализ От горното следва, че количественият полярографски анализ се основава на измерване на дифузионния ток iD като функция на концентрацията на полярографски активното деполяризиращо вещество, определено в полярографирания разтвор. Когато се анализират получените полярограми, концентрацията на аналита се определя с помощта на методите на калибровъчна крива, стандартни добавки и стандартни разтвори. а) Най-често се използва методът на калибровъчната крива. С помощта на този метод се приготвят серия от стандартни разтвори, всеки от които съдържа точно известна концентрация на аналита. Всеки разтвор се полярографира (след продухване на ток от инертен газ през него) при същите условия, получават се полярограми и се намират стойностите на E12 (еднакви за всички разтвори) и дифузионния ток iD (различен за всички разтвори) . Въз основа на получените данни се изгражда калибровъчна графика в iD-c координати, която обикновено е права линия в съответствие с уравнението на Илкович. След това се извършва полярография на анализирания разтвор с неизвестна концентрация c(X) на аналита, получава се полярограма, измерва се дифузионният ток iD(X) и се намира концентрацията c(X) от калибрационната графика . б) Стандартен метод на добавяне. Получава се полярограма на анализирания разтвор с неизвестна концентрация c(X) на аналита и се намира стойността на дифузионния ток, т.е. височина h на полярограмата. След това точно известно количество от аналита се добавя към анализирания разтвор, увеличавайки концентрацията му с стойност c(st), полярографията се извършва отново и се намира нова стойност на дифузионния ток - височината на полярограмата h + △ ч. В съответствие с уравнението на Илкович (25) можем да запишем: h = Kc(X), △ h = Kc(st), където ч △ h = c(X)c(st) и c(X) = h △ hc(st) в) Метод на стандартно решение. При еднакви условия полярографията се извършва на два разтвора: анализиран разтвор с неизвестна концентрация c(X) и стандартен разтвор с точно известна концентрация c(st) на определяното вещество. От получените полярограми се намират височините на полярографските вълни h(X) и h(st), съответстващи на дифузионния ток при концентрации съответно c(X) и c(st). Съгласно уравнението на Илкович (25) имаме: (X) = Kc(X), h(st) = Kc(st), Стандартният разтвор се приготвя така, че концентрацията му да е възможно най-близка до концентрацията на определяния разтвор. При това условие грешката при определяне е сведена до минимум. 3 Приложения на полярографията Приложение на метода. Полярографията се използва за определяне на малки количества неорганични и органични вещества. Разработени са хиляди техники за количествен полярографски анализ. Предложени са методи за полярографско определяне на почти всички метални катиони, редица аниони (броматни, йодатни, нитратни, перманганатни йони), органични съединения от различни класове, съдържащи диазогрупи, карбонилни, пероксидни, епоксидни групи, двойни въглерод-въглеродни връзки , както и връзките въглерод-халоген, азот-кислород, сяра-сяра. Фармакопейният метод се използва за определяне на салицилова киселина, норсулфазол, алкалоиди на витамин В, фолиева киселина, келин на прах и таблетки, никотинамид, пиридоксин хидрохлорид, арсенови препарати, сърдечни гликозиди, както и кислород и различни примеси във фармацевтичните продукти. Методът има висока чувствителност (до 10"5-10T6 mol/l); селективност; относително добра възпроизводимост на резултатите (до ~2%); широк спектър от приложения; ви позволява да анализирате смеси от вещества без тяхното разделяне, оцветени разтвори, малки обеми от разтвори (обемът на полярографските клетки може да бъде само 1 ml); извършвайте анализ в поток от разтвор; автоматизирайте анализа." Недостатъците на метода включват токсичността на живака, сравнително лесното му окисление в присъствието на окисляващи вещества и относителната сложност на използваното оборудване. Други варианти на полярографския метод. В допълнение към описаната по-горе класическа полярография, която използва капещ живачен микроелектрод с равномерно нарастващ върху него електрически потенциал при постоянен електрически ток, са разработени и други варианти на полярографския метод - производна, диференциална, импулсна, осцилографска полярография; полярография с променлив ток - също в различни версии. ГЛАВА 5. АМПЕРОМЕТРИЧНО ТИТРУВАНЕ Същността на метода. Амперометричното титруване (потенциостатично поляризационно титруване) е вид волтаметричен метод (заедно с полярографията). Базира се на измерване на тока между електродите на електрохимична клетка, към която е приложено определено напрежение, като функция от обема на добавения титрант. В съответствие с уравнението на Илкович (25): Дифузионният ток iD в полярографската клетка е толкова по-голям, колкото по-висока е концентрацията c на полярографски активното вещество. Ако при добавяне на титрант към анализирания титриран разтвор, разположен в полярографска клетка, концентрацията на такова вещество намалява или се увеличава, тогава дифузионният ток също намалява или съответно се увеличава. Точката на еквивалентност се определя от рязката промяна в намаляването или увеличаването на дифузионния ток, което съответства на края на реакцията на титруваното вещество с титранта. Прави се разлика между амперометрично титруване с един поляризуем електрод, наричано още титруване чрез ограничаване на тока, полярографско или поляриметрично титруване и амперометрично титруване с два еднакви поляризуеми електрода или титруване „до пълно спиране на тока“, биамперометрично титруване. Амперометрично титруване с един поляризуем електрод. Основава се на измерване на тока в полярографска клетка в зависимост от количеството добавен титрант при постоянен външен потенциал на микроелектрода, малко по-висок от потенциала на полувълната на кривата ток-напрежение на титрираното вещество X или титрант Т. Обикновено избраният външен потенциал съответства на токоограничаващата област на полярограмата X или T. Титруването се извършва на инсталация, състояща се от източник на постоянен ток с регулируемо напрежение, към който са свързани последователно галванометър и полярографска титруваща клетка. Работният (показващ) електрод на клетката може да бъде живачен капещ електрод, неподвижен или въртящ се платинен или графитен електрод. При използване на твърди електроди е необходимо разтворът да се разбърква по време на титруване. Като еталонен електрод се използват електроди от сребърен хлорид или каломел. Фонът е, в зависимост от условията, различни полярографски неактивни електролити при даден потенциал (HN03, H2S04, NH4NO3 и др.). Първо се получават криви ток-напрежение (полярограми) за X и T при същите условия, при които се предполага, че се извършва амперометрично титруване. Въз основа на разглеждането на тези криви се избира потенциална стойност, при която се постига граничната стойност на тока на полярографски активния X или T. Избраната потенциална стойност се поддържа постоянна през целия процес на титруване. Концентрацията на титранта T, използвана за амперометрично титруване, трябва да бъде приблизително 10 пъти по-висока от концентрацията X; в този случай практически няма нужда да се въвежда корекция за разреждане на разтвора по време на титруване. В противен случай са изпълнени всички условия, необходими за получаване на полярограми. Изискванията за термостатиране са по-малко строги, отколкото за директна полярография, тъй като краят на титруването се определя не от абсолютната стойност на дифузионния ток, а от рязката промяна в неговата стойност. Анализираният разтвор, съдържащ X, се добавя към полярографската клетка и титрантът T се добавя на малки порции, като всеки път се измерва токът i. Големината на тока i зависи от концентрацията на полярографски активното вещество. В точката на еквивалентност стойността на i се променя рязко. Въз основа на резултатите от амперометричното титруване се изграждат титруващи криви. Амперометричната крива на титруване е графично представяне на промяната в тока / като функция на обема V на добавения титрант. Кривата на титруване се начертава в координатите ток i - обем V на добавения титрант Т (или степен на титруване). В зависимост от естеството на титруваното вещество X и титранта Т, амперометричните криви на титруване могат да бъдат от различни типове. Биамперометричното титруване се извършва при енергично разбъркване на разтвора в система, състояща се от източник на постоянен ток с потенциометър, от който чрез чувствителен микроамперметър към електродите на електрохимичната клетка се подава регулируема потенциална разлика (0,05-0,25 V). Преди титруване разтворът, който трябва да се титрува, се добавя към последния и титрантът се добавя на части, докато токът внезапно спре или се появи, както се преценява по показанията на микроамперметър. Платиновите електроди, използвани в електрохимичната клетка, се почистват периодично чрез потапянето им за ~30 минути във вряща концентрирана азотна киселина, съдържаща добавки от железен хлорид, последвано от измиване на електродите с вода. Биамперометричното титруване е фармакопеен метод; използвани в йодометрия, нитритометрия, акваметрия и за титруване в неводни среди. ГЛАВА 6. КУЛОМЕТРИЧЕН АНАЛИЗ (КУЛОМЕТРИЯ) 1 Принципи на метода електрохимична кондуктометрия титруване кулонометрия Кулонометричният анализ (кулонометрия) се основава на използването на връзката между масата m на вещество, което реагира по време на електролиза в електрохимична клетка, и количеството електричество Q, преминало през електрохимичната клетка по време на електролизата само на това вещество. В съответствие с единния закон на електролизата M Фарадей, масата t (в грамове) е свързана с количеството електричество Q (в кулони) чрез връзката (27) където M е моларната маса на веществото, реагирало по време на електролиза, g/mol; n е броят на електроните, участващи в електродната реакция; 96487 C/mol е числото на Фарадей. Количеството електричество Q (в C), преминало през електрохимична клетка по време на електролиза, е равно на произведението на електрически ток i (в A) и времето на електролиза τ ( в c): Ако се измерва количеството електричество Q, тогава съгласно (27) може да се изчисли масата m. Това е вярно в случая, когато цялото количество електричество Q, преминало през електрохимичната клетка по време на електролиза, се изразходва само за електролизата на дадено вещество; трябва да се изключат странични процеси. С други думи, токовият изход (ефективност) трябва да бъде 100%. Тъй като, в съответствие с единния закон за електролизата на М. Фарадей, за да се определи масата t (g) на вещество, реагиращо по време на електролиза, е необходимо да се измери количеството електричество Q, изразходвано за електрохимичната трансформация на определяното вещество , в кулони, методът се нарича кулонометрия. Основната задача на кулонометричните измервания е да се определи количеството електричество Q възможно най-точно. Кулонометричният анализ се извършва или в амперостатичен (галваностатичен) режим, т.е. с постоянен електрически ток i=const, или с контролиран постоянен потенциал на работния електрод (потенциостатична кулонометрия), когато електрическият ток се изменя (намалява) по време на процеса на електролиза. В първия случай, за да се определи количеството електричество Q, е достатъчно да се измери времето на електролиза t(s), постоянен ток /(A) възможно най-точно и да се изчисли стойността на Q по формула (10.28). Във втория случай стойността на Q се определя или чрез изчисление, или с помощта на химически кулометри. Има директна кулонометрия и индиректна кулонометрия (кулонометрично титруване). Същността на метода. Директната кулонометрия при постоянен ток се използва рядко. По-често се използва кулонометрия с контролиран постоянен потенциал на работния електрод или директна потенциостатична кулонометрия. При директната потенциостатична кулонометрия определяното вещество се електролизира директно. Измерва се количеството електричество, изразходвано за електролизата на това вещество, и масата m на определяното вещество се изчислява с помощта на уравнението. По време на процеса на електролиза потенциалът на работния електрод се поддържа постоянен, E = const, за което обикновено се използват устройства - потенциостати. Постоянната стойност на потенциала E се избира предварително въз основа на разглеждане на кривата на ток-напрежение (поляризация), построена в координатите ток i - потенциал E (както се прави в полярографията), получена при същите условия, при които ще бъде електролизата извършено. Обикновено се избира потенциална стойност E, която съответства на областта на граничния ток за анализираното вещество и е малко по-висока от неговия полувълнов потенциал E12 (с -0,05-0,2 V). При тази потенциална стойност, както при полярографията, фоновият електролит не трябва да се подлага на електролиза. Тъй като процесът на електролиза протича при постоянен потенциал, електрическият ток в клетката намалява, тъй като концентрацията на електроактивното вещество, участващо в електродната реакция, намалява. В този случай електрическият ток намалява с времето според експоненциален закон от първоначалната стойност i0 в момент t = O до стойност i в момент t: където коефициентът k зависи от естеството на реакцията, геометрията на електрохимичната клетка, площта на работния електрод, коефициента на дифузия на определяното вещество, скоростта на разбъркване на разтвора и неговия обем. Методи за определяне на количеството електричество, преминало през разтвор при директна потенциостатична кулонометрия. Стойността на Q може да се определи чрез изчислителни методи или с помощта на химически кулометър. а) Изчисляване на количеството Q от площта под кривата на i спрямо m. За да се определи Q без забележима грешка, методът изисква почти пълно завършване на процеса на електролиза, т.е. за дълго време. На практика, както е отбелязано по-горе, площта се измерва при стойност от m съответстваща 0,001i0 (0,1% от i0). б) Изчисляване на стойността на Q въз основа на зависимостта на In / от m. В съответствие с това имаме: Q = 0∞i0e-k τ д τ =i00∞e-k τ д τ =i0k Тъй като ∞i0e-k τ д τ = - k-1 e-k∞-e-k0= k-10-1=k-1 Приложение на директната кулонометрия. Методът има висока селективност, чувствителност (до 10~8-10~9 g или до ~10~5 mol/l), възпроизводимост (до ~1-2%) и позволява определяне на съдържанието на микропримеси. Недостатъците на метода включват високата трудоемкост и продължителност на анализа и необходимостта от скъпо оборудване. Директната кулонометрия може да се използва за определяне - по време на катодна редукция - на метални йони, органични нитро- и халогенни производни; по време на анодно окисление - хлоридни, бромидни, йодидни, тиоцианатни аниони, метални йони в по-ниски степени на окисление при превръщането им в по-високи степени на окисление, например: As(IH) -> As(V),Cr(II) -> Cr(III) ), Fe(II) -» Fe(III), T1(I) -> Tl(III) и др. Във фармацевтичния анализ директната кулонометрия се използва за определяне на аскорбинова и пикринова киселина, новокаин, хидроксихинолин и в някои други случаи. Както беше отбелязано по-горе, директната кулонометрия е доста трудоемка и отнема много време. Освен това в някои случаи страничните процеси започват да се появяват забележимо дори преди завършването на основната електрохимична реакция, което намалява ефективността на тока и може да доведе до значителни грешки в анализа. Поради това по-често се използва непряка кулонометрия - кулонометрично титруване. 3 Кулонометрично титруване Същността на метода. При кулонометрично титруване аналитът X, който е в разтвор в електрохимична клетка, реагира с „титранта“ Т, вещество, непрекъснато образувано (генерирано) върху електрода на генератора по време на електролизата на спомагателно вещество, също присъстващо в разтвора. Краят на титруването - моментът, когато целият аналит X напълно реагира с генерирания „титрант“ T, се записва или визуално чрез индикаторния метод, като в разтвора се въвежда подходящ индикатор, който променя цвета си в близост до TE, или с помощта на инструментални методи - потенциометрично, амперометрично, фотометрично. Така при кулонометрично титруване титрантът не се добавя от бюретата към титрувания разтвор. Ролята на титрант се играе от вещество Т, което непрекъснато се генерира по време на електродната реакция на генераторния електрод. Очевидно има аналогия между конвенционалното титруване, когато титрантът се въвежда отвън в титрирания разтвор и, докато се добавя, реагира с аналита, и генерирането на вещество Т, което, когато се образува, също реагира с аналита. Следователно разглежданият метод се нарича "кулонометрично титруване". Кулонометричното титруване се извършва в амперостатичен (галваностатичен) или потенциостатичен режим. По-често кулонометричното титруване се извършва в амперостатичен режим, като се поддържа постоянен електрически ток през цялото време на електролиза. Вместо обема на добавения титрант, при кулонометричното титруване се измерват времето t и токът i на електролизата. Процесът на образуване на вещество Т в кулонометрична клетка по време на електролиза се нарича генериране на титрант. Кулонометрично титруване при постоянен ток. По време на кулонометрично титруване в амперостатичен режим (при постоянен ток) се измерва времето t, през което е извършена електролизата, и количеството електроенергия Q, изразходвано по време на електролиза, се изчислява по формулата, след което масата на аналита X се намира чрез съотношението. Така например, стандартизирането на разтвор на солна киселина НС1 по метода на кулонометрично титруване се извършва чрез титруване на водородни йони Н30+ на стандартизирания разтвор, съдържащ НС1, електрически генерирани на платиновия катод от хидроксидни йони ОН- по време на електролизата на вода: Н20 + 2е = 20Н- + Н2 Полученият титрант - хидроксидни йони - реагира с H30+ йони в разтвор: H30+ + OH- = 2H20 Титруването се извършва в присъствието на индикатора фенолфталеин и се спира при поява на светлорозов цвят на разтвора. Познавайки величината на постоянния ток i (в ампери) и времето t (в секунди), изразходвано за титруване, количеството електричество Q (в кулони) се изчислява с помощта на формула (28) и масата (в грамове) на съдържащата се реагирала HC1 във формула (27).в аликвотна част от стандартизирания разтвор на НС1, добавен към кулонометричната клетка (в съда на генератора). Условия за кулонометрично титруване. От горното следва, че условията за провеждане на кулонометрично титруване трябва да осигуряват 100% токова ефективност. За да направите това, трябва да изпълните поне следните изисквания. а) Спомагателният реагент, от който се генерира титрантът на работния електрод, трябва да присъства в разтвора в голям излишък спрямо определяното вещество (~ 1000-кратен излишък). При тези условия обикновено се елиминират страничните електрохимични реакции, основната от които е окисляването или редуцирането на фоновия електролит, например водородни йони: Н+ + 2е = Н2 б) Стойността на постоянния ток i=const по време на електролиза трябва да бъде по-малка от стойността на дифузионния ток на спомагателния реагент, за да се избегне реакция с йони на фоновия електролит. в) Необходимо е да се определи възможно най-точно количеството електроенергия, консумирана по време на електролиза, което изисква точно записване на началото и края на отброяването на времето и големината на тока на електролизата. Кулонометрично титруване при постоянен потенциал. Потенциостатичният режим се използва по-рядко при кулонометрични титрувания. Кулонометричното титруване в потенциостатичен режим се извършва при постоянна стойност на потенциала, съответстваща на потенциала на изпускане на вещество върху работния електрод, например по време на катодната редукция на метални катиони М "* върху платинен работен електрод. Тъй като реакцията продължава, потенциалът остава постоянен, докато всички метални катиони реагират, след което рязко намалява, тъй като в разтвора вече няма метални катиони, определящи потенциала. Приложение на кулонометрично титруване. При кулонометрично титруване могат да се използват всички видове реакции на титриметричен анализ: киселинно-основни, редокс, утаяване, реакции на комплексообразуване. По този начин, малки количества киселини могат да бъдат определени чрез кулонометрично киселинно-алкално титруване с електрогенерирани OH- йони, образувани по време на електролизата на водата на катода: Н20 + 2е = 20Н" + Н2 Базите могат също да бъдат титрувани с водородни йони H+, генерирани на анода по време на електролизата на водата: Н20-4е = 4Н+ + 02 С редокс бромометрично кулонометрично титруване е възможно да се определят съединения на арсен (III), антимон (III), йодиди, хидразин, феноли и други органични вещества. Бромът, който се генерира електрически на анода, действа като титрант: VG -2e = Vg2 Утаителното кулометрично титруване може да определи халидните йони и органичните сяросъдържащи съединения чрез електрогенерирани сребърни катиони Ag+, цинкови катиони Zn2+ чрез електрогенерирани фероцианидни йони и др. Комплексометрично кулонометрично титруване на метални катиони може да се извърши с EDTA аниони, електрогенерирани върху живачен (I) комплексонатен катод. Кулонометричното титруване има висока точност, широк спектър от приложения в количествения анализ, ви позволява да определяте малки количества вещества, нискоустойчиви съединения (тъй като те реагират веднага след образуването им), например мед (1), сребро (H) , калай (P), титан (III), манган (III), хлор, бром и др. Предимствата на метода включват и факта, че не се изисква подготовка, стандартизация и съхранение на титранта, тъй като той се образува непрекъснато по време на електролизата и веднага се изразходва в реакцията с определяното вещество. ЗАКЛЮЧЕНИЕ Електрохимичните методи за анализ се основават на процеси, протичащи върху електродите или междуелектродното пространство. Електрохимичните методи за анализ са сред най-старите физикохимични методи за анализ (някои са описани в края на 19 век). Предимството им е високата точност и сравнителната простота както на оборудването, така и на техниките за анализ. Високата точност се определя от много точни закони, използвани в електрохимичните методи за анализ, например закона на Фарадей. Голямо удобство е, че те използват електрически въздействия и фактът, че резултатът от това въздействие (отговор) се получава под формата на електрически сигнал. Това осигурява висока скорост и точност на отчитане и отваря широки възможности за автоматизация. Електрохимичните методи за анализ се отличават с добра чувствителност и селективност, в някои случаи те могат да бъдат класифицирани като микроанализ, тъй като понякога по-малко от 1 ml разтвор е достатъчен за анализ. Техният инструмент е електрохимична клетка, която представлява съд с електролитен разтвор, в който са потопени поне два електрода. В зависимост от проблема, който се решава, формата и материала на съда, броят и естеството на електродите, разтворът и условията за анализ (приложено напрежение (ток) и записан аналитичен сигнал, температура, разбъркване, продухване с инертен газ и др. ) може да варира. Определяното вещество може да бъде част както от електролита, запълващ клетката, така и от един от електродите. Електрохимичните методи за анализ играят важна роля в съвременния свят. В наше време грижата за околната среда е особено важна. С помощта на тези методи е възможно да се определи съдържанието на огромен брой различни органични и неорганични вещества. Сега те са по-ефективни при идентифицирането на опасни вещества.
Изпратете добрата си работа в базата знания е лесно. Използвайте формата по-долу
Студенти, докторанти, млади учени, които използват базата от знания в обучението и работата си, ще ви бъдат много благодарни.
публикувано на http://www.allbest.ru
Министерство на образованието и науката на Руската федерация
Федерална държавна бюджетна образователна институция
висше образование
"Иркутски национален изследователски технически университет"
Катедра Металургия на цветните метали
(име на отдела)
"Електрохимични методи за изследване"
Резюме по дисциплината
“Физико-химични методи за изследване на металургичните процеси”
Попълнено от студент от група МСМ-16-1
Захаренков Р.И.
Проверен от учителя на катедрата MCM
Кузмина М.Ю.
Иркутск 2017 г
ВЪВЕДЕНИЕ
Електрохимията е клон на физичната химия, който разглежда системи, съдържащи йони (разтвори или стопилки на електролити) и процеси, протичащи на границата на две фази с участието на заредени частици.
Първите идеи за връзката между химичните и електрическите явления са известни през 18 век, тъй като са проведени огромен брой физични и химични експерименти с електрически и мълниеносни разряди, като зарядите са разположени в лайденски буркани, но всички те са произволни в природа поради липсата на постоянен мощен източник на електрическа енергия. Произходът на електрохимията се свързва с имената на Л. Галвани и А. Волта. Докато изучава физиологичните функции на жабата, Галвани случайно създава електрохимична верига. Състоеше се от два различни метала и готов жабешки бут. Лапата е едновременно електролит и индикатор за електрически ток, но заключението е дадено неправилно, т.е. според Галвани този електрически ток, който възниква във веригата, е от животински произход, т.е. той е свързан с функционалните характеристики на тяло на жаба (теория „животинско електричество“).
Правилната интерпретация на експериментите на Галвани е дадена от А. Волта. Той създава първата батерия от галванични клетки - волтова колона. Батерийните клетки се състоят от медни и цинкови дискове, а електролитът е гъба, напоена със солена вода или киселина. Именно тази връзка направи възможно получаването на електрически ток. Скоро, чрез трудовете на великите учени А. Волта, Дж. Даниел, Б. С. Якоби, П. Р. Багратион, Г. Планте и други, се появяват мощни галванични елементи и батерии, лесни за използване. Тогава А. Волта разработи серия от метални напрежения. Ако два различни метала бъдат поставени в контакт и след това разделени, тогава с помощта на физически средства, като например електроскоп, може да се види, че единият метал е придобил положителен заряд, а другият - отрицателен. Тази серия от метали, в която всеки предходен метал е зареден положително, но след контакт с всеки следващ, т.е. серията Волта, се оказа подобна на серията на напрежение.
Освен това в началото на 19 век се развива електролизата и М. Фарадей установява количествените закони на електролизата. Учените имат голям принос за развитието на електрохимията: S. A. Arrhenius, V. F. Ostwald, R. A. Colley, P. Debye, W. Nernst, G. Helmholtz и др. Сега електрохимията е разделена на теоретична и приложна. Чрез използването на електрохимични методи тя се свързва с други клонове на физикохимията, както и с аналитичната химия и други науки.
електрохимична потенциометрия кондуктометрия кулонометрия
1 . ЕЛЕКТРОХИМИЧНИ МЕТОДИ НА ИЗСЛЕДВАНЕ
Необходимостта от използване на различни методи за изследване на електрохимичните процеси се дължи на широкия диапазон от вариации в скоростта на пренос на електрони при електродни реакции. Всеки от методите има определена граница на определяната стойност на плътността на обменния ток, над която не могат да се определят електрохимичните параметри на електродната реакция. По отношение на всеки конкретен обект е необходимо да се избере методът, който осигурява максимално количество надеждна информация. При провеждане на електрохимични изследвания е необходимо да се знае химичният състав на изходните материали и продуктите на реакцията. За определяне състава на електролита се използват различни физични и химични методи: спектрофотометрични, потенциометрични, аналитични и др. При провеждане на електрохимични изследвания трябва да се спазват следните условия.
1. Максимална чистота на използваните реактиви; съставът на електродите трябва да се знае стриктно, както и състоянието на техните повърхности. Трябва да се внимава повърхността на електродите да не претърпи промени по време на процеса на измерване.
2. Конструкцията на електрохимичната клетка и разположените в нея електроди трябва да осигуряват равномерно разпределение на тока по цялата повърхност на работния електрод.
3. Измерванията трябва да се извършват при строго контролирани температури.
4. Поддържайте постоянно налягане и състав на газовата фаза над електролита. По правило изследванията се провеждат в среда на инертен газ (N 2, Ar, Ne, He H 2), тъй като кислородът в газовата фаза може да има значителен ефект върху механизма на процеса.
5. Необходимо е да се осигурят такива експериментални условия, при които спадът на потенциала в дифузната част на двойния електрически слой да бъде минимален или точно известен. За да се намали този потенциал, като правило се използва фонов електролит, чиято концентрация трябва да бъде не по-малко от 20 пъти по-висока от тази на основното вещество. Първо обаче трябва да се уверите, че фоновият електролит не изкривява поляризационната крива на изследваната реакция.
6. Точно измерване на потенциала на работния електрод. За да направите това, е необходимо да се елиминира дифузионният потенциал между изследвания електролит и електролита на референтния електрод. Този потенциал придобива максималната си стойност при приближаване на ограничаващия ток и може значително да изкриви резултатите от измерването. За да се елиминира дифузионният потенциал между изследвания електролит и електролита на референтния електрод, е желателно: а) да изберете референтен електрод, който има същия електролитен състав като този, който се изследва. Например, когато се изследват в хлоридни разтвори, е удобно да се използват електроди от сребърен хлорид, каломел и хлор; в кисели сулфатни разтвори - живачно-сулфатни електроди и др.; б) използвайте референтен електрод с електролит, на границата на който с изследвания електролит потенциалът на дифузия може да се изчисли с помощта на известни формули.
При измерване в разтвори с постоянна йонна сила и при високи фонови концентрации - с постоянна йонна концентрация, можете по принцип да използвате всеки референтен електрод. Дифузионният потенциал в този случай може да бъде много голям, но и постоянен - той може да бъде изчислен или определен експериментално.
Във всички случаи на изследване на кинетиката на електрохимичните процеси е необходимо да се измери плътността на тока. Обикновено те започват с откриване с помощта на методи на аналитична химия и кулонометрия, за да определят дали на електрода протича само една изследвана реакция или тя е усложнена от странични реакции. В случай на странични реакции е необходимо да се установи каква част от тока се дължи само на осъществяването на изследваната реакция (изградете така наречената частична поляризационна характеристика за изследваната реакция).
Механизмът на електродната реакция може да се интерпретира най-просто само в случай, когато изходното вещество се превръща в един продукт със 100% токова ефективност. Проверката на реакцията за съответствие със закона на Фарадей или извършването на кулонометрични измервания ви позволява едновременно да определите броя на електроните, участващи в общата електродна реакция. Познаването на състава на изходното вещество и реакционния продукт, както и общия брой прехвърлени електрони, позволява да се напише уравнението за общата електродна реакция.
Следващата стъпка в изучаването на механизма на електродната реакция е да се установи кой етап е ограничаващ.
Ако ограничаващият етап е етапът на разряд-йонизация, а всички останали протичат обратимо, тогава основните кинетични параметри на процеса могат да бъдат определени графично или аналитично чрез прилагане на уравненията на теорията на бавния разряд към поляризационните характеристики.
1.1 Електрохимични методи за анализ
Електрохимични методианализе набор от методи за качествен и количествен анализ, основани на електрохимични явления, възникващи в изследваната среда или на границата и свързани с промени в структурата, химичния състав или концентрацията на анализираното вещество.
Има директни и индиректни електрохимични методи. Директните методи използват зависимостта на силата на тока (потенциал и др.) от концентрацията на определяния компонент. При косвените методи силата на тока (потенциал и др.) се измерва, за да се намери крайната точка на титруване на аналита с подходящ титрант, т.е. Използва се зависимостта на измервания параметър от обема на титранта.
За всякакъв вид електрохимични измервания е необходима електрохимична верига или електрохимична клетка, от която анализираният разтвор е неразделна част.
Електрохимичните методи се класифицират в зависимост от вида на явленията, измерени по време на процеса на анализ. Има две групи електрохимични методи:
1. Методи без налагане на външен потенциал, базирани на измерване на потенциалната разлика, която възниква в електрохимична клетка, състояща се от електрод и съд с тестовия разтвор. Тази група методи се нарича потенциометрични. Потенциометричните методи използват зависимостта на равновесния потенциал на електродите от концентрацията на йони, участващи в електрохимичната реакция върху електродите.
2. Методи с налагане на външен потенциал, базирани на измерване:
а) Електропроводимост на разтворите? кондуктометрия;
б) Количеството електричество, преминаващо през разтвора? кулонометрия;
в) Зависимост на тока от приложения потенциал? волт-амперометрия;
d) Времето, необходимо за протичане на електрохимичната реакция - хроноелектрохимични методи(хроноволтаметрия, хронокондуктометрия).
При методите от тази група към електродите на електрохимичната клетка се прилага външен потенциал.
Основният елемент на уредите за електрохимичен анализ е електрохимичната клетка. При методи без налагане на външен потенциал е така галванична клетка, при които възниква електрически ток поради химични редокс реакции. В клетка като галванична клетка два електрода са в контакт с анализирания разтвор - индикаторен електрод, чийто потенциал зависи от концентрацията на веществото, и електрод с постоянен потенциал - референтен електрод, срещу който измерва се потенциалът на индикаторния електрод. Потенциалната разлика се измерва с помощта на специални устройства - потенциометри.
При методи с налагане на външен потенциал, електрохимична клетка, наречен така, защото на електродите на клетката, под въздействието на приложен потенциал, възниква електролиза - окисление или редукция на вещество. При кондуктометричен анализ се използва кондуктометрична клетка, в която се измерва електрическата проводимост на разтвор. Според метода на приложение електрохимичните методи могат да бъдат класифицирани в директни, при които концентрацията на веществата се измерва според показанията на устройството, и електрохимично титруване, където индикацията на точката на еквивалентност се записва с помощта на електрохимични измервания. В съответствие с тази класификация се разграничават потенциометрия и потенциометрично титруване, кондуктометрия и кондуктометрично титруване и др.
Инструментите за електрохимични определяния, в допълнение към електрохимичната клетка, бъркалката и съпротивлението на натоварване, включват устройства за измерване на потенциална разлика, ток, съпротивление на разтвора и количество електричество. Тези измервания могат да се извършват със стрелкови инструменти (волтметър или микроамперметър), осцилоскопи и потенциометри за автоматично записване. Ако електрическият сигнал от клетката е много слаб, тогава той се усилва с помощта на радиоусилватели. В устройствата на методите с налагане на външен потенциал важна част е устройството за захранване на клетката с подходящ потенциал на стабилизиран постоянен или променлив ток (в зависимост от вида на метода). Захранващият блок за устройства за електрохимичен анализ обикновено включва токоизправител и стабилизатор на напрежението, което осигурява постоянна работа на устройството.
1.2 Потенциометрия
Потенциометрията се основава на измерване на разликата в електрическите потенциали, която възниква между различни електроди, потопени в разтвор с определяното вещество. Електрическият потенциал възниква на електродите, когато върху тях протича редокс (електрохимична) реакция. Редокс реакции протичат между окислител и редуциращ агент с образуването на редокс двойки, чийто потенциал E се определя от уравнението на Нернст от концентрациите на компонентите на двойката [ok] и [rec]:
Където E°- стандартен електроден потенциал, V;
н- броя на електроните, участващи в процеса.
Потенциометричните измервания се извършват чрез спускане на два електрода в разтвора - индикаторен електрод, който реагира на концентрацията на определяните йони, и стандартен или референтен електрод, спрямо който се измерва потенциалът на индикатора. Използват се няколко вида индикаторни и стандартни електроди.
Електроди от първи видобратими по отношение на металните йони, от които се състои електродът. Когато такъв електрод се спусне в разтвор, съдържащ метални катиони, се образува електродна двойка: М н + /М.
Електроди от втори вид чувствителни към аниони и са метал M, покрити със слой от неговата неразтворима сол MA с анион А- към които електродът е чувствителен. Когато такъв електрод влезе в контакт с разтвор, съдържащ определения анион А-, възниква потенциал Е, чиято стойност зависи от произведението на разтворимостта на солта
ДР М.А. и концентрация на аниони [ А-] в разтвор.
Електродите от втория тип са сребърен хлорид и каломел. Електродите от наситен сребърен хлорид и каломел поддържат постоянен потенциал и се използват като референтни електроди, спрямо които се измерва потенциалът на индикаторния електрод.
Инертни електроди- плоча или тел от трудно окисляеми метали - платина, злато, паладий. Те се използват за измерване на E в разтвори, съдържащи редокс двойка (например Fe 3+ /Fe 2+).
Мембранни електроди различните видове имат мембрана, върху която възниква мембранен потенциал Е. Стойността на Е зависи от разликата в концентрациите на един и същи йон от различните страни на мембраната. Най-простият и най-често използван мембранен електрод е стъкленият електрод.
Тип смесване на неразтворими соли AgBr, AgCl, AgIи други с някои пластмаси (каучук, полиетилен, полистирен) доведоха до създаването йоноселективни електродиНа бр-, кл-, аз-, селективно адсорбирайки посочените йони от разтвора поради правилото на Панет - Фаянс - Хан. Тъй като концентрацията на откриваемите йони извън електрода се различава от тази вътре в електрода, равновесията на мембранните повърхности са различни, което води до появата на мембранен потенциал.
За извършване на потенциометрични определяния се сглобява електрохимична клетка от индикаторен референтен електрод, който се потапя в анализирания разтвор и се свързва към потенциометър. Електродите, използвани в потенциометрията, имат високо вътрешно съпротивление (500-1000 MOhm), така че има видове потенциометри, които са сложни електронни волтметри с високо съпротивление. За измерване на ЕМП на електродната система в потенциометрите се използва компенсационна верига за намаляване на тока във веригата на клетката.
Най-често потенциометрите се използват за директни измервания на pH, индикатори за концентрациите на други йони pNa, pK, pNH2, pClи mV. Измерванията се извършват с помощта на подходящи йон-селективни електроди.
За измерване на pH се използват стъклен електрод и референтен електрод - сребърен хлорид. Преди извършване на анализи е необходимо да се провери калибрирането на рН метри с помощта на стандартни буферни разтвори, чиято фиксация е прикрепена към устройството.
pH метри в допълнение към директните определяния pH, pNa, pK, pNH2, pClи други позволяват потенциометрично титруване на определяния йон.
1.3 Потенциометрично титруване
Потенциометричното титруване се извършва в случаите, когато не могат да се използват химически индикатори или когато не е наличен подходящ индикатор.
При потенциометричното титруване като индикатори се използват потенциометърни електроди, поставени в титрувания разтвор. В този случай се използват електроди, които са чувствителни към титрирани йони. По време на процеса на титруване концентрацията на йони се променя, което се записва на измервателната скала на потенциометъра. След като записвате показанията на потенциометъра в единици pH или mV, начертайте зависимостта им от обема на титранта (крива на титруване), определете точката на еквивалентност и обема на титранта, изразходван за титруване. Въз основа на получените данни се построява крива на потенциометрично титруване.
Потенциометричната крива на титруване има форма, подобна на кривата на титруване в титриметричния анализ. Кривата на титруване се използва за определяне на точката на еквивалентност, която се намира в средата на скока на титруване. За целта се начертават допирателни към участъци от кривата на титруване и точката на еквивалентност се определя в средата на тангентата на скока на титруване. Най-голямата стойност на промяната ? pH/?Vпридобива в точката на еквивалентност.
Точката на еквивалентност може да се определи още по-точно чрез метода на Гран, който се използва за изграждане на зависимостта ? V/?Eот обема на титранта. С помощта на метода на Гран може да се извърши потенциометрично титруване, без да се достига до точката на еквивалентност.
Потенциометричното титруване се използва във всички случаи на титриметричен анализ.
Киселинно-алкалното титруване използва стъклен електрод и референтен електрод. Тъй като стъкленият електрод е чувствителен към промените в pH на средата, когато те се титруват, промените в pH на средата се записват на потенциометъра. Киселинно-базовото потенциометрично титруване се използва успешно при титруването на слаби киселини и основи (pK?8). При титруване на смеси от киселини е необходимо техните pK да се различават с повече от 4 единици, в противен случай част от по-слабата киселина се титрува заедно със силната и скокът на титруване не е ясно изразен.
Това позволява използването на потенциометрия за конструиране на експериментални криви на титруване, избор на индикатори за титруване и определяне на константите на киселинност и основност.
При утаително потенциометрично титруване като индикатор се използва електрод, изработен от метал, който образува електродна двойка с определяните йони.
Когато се използва комплексометрично титруване: а) метален електрод, обратим към йона на определяния метал; б) платинов електрод в присъствието на редокс двойка в разтвора. Когато един от компонентите на редокс двойката се свърже с титранта, неговата концентрация се променя, което води до промени в потенциала на индикаторния платинен електрод. Използва се също обратно титруване на излишък от разтвор на EDTA, добавен към метална сол с разтвор на желязна (III) сол.
За редокс титруване се използват референтен електрод и платинен индикаторен електрод, чувствителни към редокс двойки.
Потенциометричното титруване е един от най-използваните методи за инструментален анализ поради своята простота, достъпност, селективност и широки възможности.
1.4 Кондуктометрия. Кондуктометрично титруване
Кондуктометрията се основава на измерване на електрическата проводимост на разтвор. Ако два електрода се поставят в разтвор на вещество и към електродите се приложи потенциална разлика, през разтвора ще протече електрически ток. Както всеки проводник на електричество, разтворите се характеризират със съпротивление Ри обратната му величина – електропроводимост Л:
Където Р- съпротивление, Ohm;
Специфично съпротивление, Ohm. см;
С - повърхностна площ, cm 2.
Където Л - електропроводимост, Ohm-1;
Р- съпротивление, Ом.
Кондуктометричният анализ се извършва с помощта на кондуктометри - устройства, които измерват съпротивлението на разтворите. По стойност на съпротивлението Ропределя електрическата проводимост на разтворите, която е нейната обратна стойност Л.
Концентрацията на разтворите се определя чрез директна кондуктометрия и кондуктометрично титруване. Директна кондуктометрияизползвани за определяне на концентрацията на разтвор с помощта на калибровъчна графика. За да се създаде калибрационна графика, се измерва електрическата проводимост на серия от разтвори с известна концентрация и се изгражда калибрационна графика на електрическата проводимост спрямо концентрацията. След това се измерва електропроводимостта на анализирания разтвор и концентрацията му се определя от графиката.
По-често се използва кондуктометрично титруване. В този случай анализираният разтвор се поставя в клетка с електроди, клетката се поставя върху магнитна бъркалка и се титрува със съответния титрант. Титрантът се добавя на равни части. След добавяне на всяка порция титрант, измерете електрическата проводимост на разтвора и начертайте зависимостта между електрическата проводимост и обема на титранта. Когато се добави титрант, настъпва промяна в електрическата проводимост на разтвора. кривата на титруване се огъва.
От п подвижността на йоните зависи от електрическата проводимост на разтвора: толкова по-висока е мобилността b йони, толкова по-голяма е електрическата проводимост на разтвора.
Кондуктометричното титруване има няколко предимства. Може да се извършва в мътна и оцветена среда, при липса на химически индикатори. Методът има повишена чувствителност и ви позволява да анализирате разредени разтвори на вещества (до 10-4 mol/dmі). Смеси от вещества се анализират чрез кондуктометрично титруване, т.к разликите в подвижността на различните йони са значителни и могат да се титруват различно в присъствието един на друг.
Кондуктометричният анализ може лесно да се автоматизира, ако разтворът на титранта се подава от бюрета с постоянна скорост и промяната в електрическата проводимост на разтвора се записва на записващо устройство.
Този тип кондуктометрия се нарича хроно- кондуктометричен анализ.
При киселинно-алкално титруване чрез кондуктометрия могат да се определят силни киселини, слаби киселини, соли на слаби основи и силни киселини.
IN утаяващ кондуктометричентитруванеелектрическата проводимост на титруваните разтвори първо намалява или остава на определено постоянно ниво поради свързването на титрувания електролит в утайка, след т.е. когато се появи излишък от титрант, той отново се увеличава.
IN комплексметрично кондуктометрично титруванепромените в електрическата проводимост на разтвора възникват поради свързването на метални катиони в комплекс с EDTA.
Редокс кондуктометриятитро- циявъз основа на промяна в концентрацията на реагиращите йони и появата на нови йони в разтвора, което променя електрическата проводимост на разтвора.
През последните години има развитие високочестотна кондуктометрия, при който електродите нямат контакт с разтвора, което е важно при анализ на агресивни среди и разтвори в затворени съдове.
Разработени са два варианта - праввисокочестотна кондуктометрия и високочестотно титруване.
Директната високочестотна кондуктометрия се използва за определяне съдържанието на влага на вещества, зърно, дървесина, концентрацията на разтвори в затворени съдове - ампули и при анализ на агресивни течности.
Високочестотното титруване се извършва на специални титратори - TV-6, TV-6L.
Високочестотните кондуктометрични титрувания се извършват като киселинно-основни, редокс или утаителни титрувания в случаите, когато не е наличен подходящ индикатор или когато се анализират смеси от вещества.
1.5 Кулонометрия. Кулонометрично титруване
В кулонометрията веществата се определят чрез измерване на количеството електричество, изразходвано за тяхната количествена електрохимична трансформация. Кулонометричният анализ се извършва в електролитна клетка, в която се поставя разтвор на определяното вещество. Когато се приложи подходящ потенциал към електродите на клетката, настъпва електрохимична редукция или окисление на веществото. Според законите на електролизата, открити от Фарадей, количеството вещество, реагиращо на електрода, е пропорционално на количеството електричество, преминаващо през разтвора:
Където ж- маса на освободеното вещество, g;
н- броя на електроните, прехвърлени в електродния процес;
Е- число на Фарадей (F = 96485 C/mol);
аз- сила на тока, A;
T-време, s;
М- моларна маса на освободеното вещество, g/mol.
Кулонометричният анализ дава възможност да се определят вещества, които не се отлагат върху електродите или не излизат в атмосферата по време на електрохимична реакция.
Има директна кулонометрия и кулонометрично титруване.. Високата точност и чувствителност на методите за измерване на електрически ток осигурява кулонометричен анализ с уникална точност от 0,1-0,001% и чувствителност до 1 10 -8? 1 10 -10 г. Следователно кулонометричният анализ се използва за определяне на микропримеси и продукти от разрушаване на вещества, което е важно при наблюдение на тяхното качество.
Да се посочи т.е. При кулонометрично титруване могат да се използват химични и инструментални методи - добавяне на индикатори, откриване на оцветени съединения фотометрично или спектрофотометрично.
За разлика от други методи за анализ, кулометрията може да бъде напълно автоматизирана, което свежда до минимум случайните грешки при определяне. Тази функция е използвана за създаване на автоматични кулонометрични титратори - чувствителни инструменти, използвани за особено точни анализи, когато други методи не са достатъчно чувствителни. Когато се анализират вещества, които са слабо разтворими във вода, кулонометрията може да се извърши върху електроди, изработени от ацетиленово черно, които са добър адсорбент и отстраняват такива вещества от реакционната среда с достатъчна пълнота. Кулонометричното титруване е обещаващ метод за инструментален анализ. Може да намери широко приложение за решаване на редица специални аналитични задачи - анализ на примеси, малки количества лекарства, определяне на токсични вещества, микроелементи и други съединения в биологичен материал и околната среда.
ЗАКЛЮЧЕНИЕ
Работата предоставя преглед на основните електрохимични методи за изследване, като подробно описва техния принцип, приложение, предимства и недостатъци.
Електрохимичните методи за анализ са група методи за количествен химичен анализ, основани на използването на електролиза.
Разновидности на метода са електрогравиметричен анализ (електроанализ), вътрешна електролиза, контактен обмен на метали (циментиране), полярографски анализ, кулонометрия и др. По-специално електрогравиметричният анализ се основава на претегляне на веществото, освободено върху един от електродите. Методът позволява не само да се извършват количествени определяния на мед, никел, олово и др., но и да се разделят смеси от вещества.
В допълнение, електрохимичните методи за анализ включват методи, базирани на измерване на електрическата проводимост (кондуктометрия) или електроден потенциал (потенциометрия). Някои електрохимични методи се използват за намиране на крайната точка на титруване (амперометрично титруване, кондуктометрично титруване, потенциометрично титруване, кулонометрично титруване).
СПИСЪК НА ИЗПОЛЗВАНАТА ЛИТЕРАТУРА
1. Основи на съвременния електрохимичен анализ. Будников Г.К., Майстренко В.Н., Вяселев М.Р., М., Мир, 2003.
2. Дж. Пламбек, изд. S. G. Mayranovsky Електрохимични методи за анализ. Основи на теорията и приложението: прев. от английски / Виданя: Мир, 1985.
3. Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Електрохимия - М.: химия, 2001. 624 с.
4. STO 005-2015. Система за управление на качеството. Учебно-методическа дейност. Регистрация на курсови проекти (работи) и заключителни квалификационни работи по технически специалности.
Публикувано на Allbest.ru
...Подобни документи
Класификация на електрохимичните методи за анализ, същността на волтаметрията, кондуктометрията, потенциометрията, амперометрията, кулометрията, тяхното приложение в опазването на околната среда. Характеристики на химическо аналитично оборудване и основни фирми за продажба.
курсова работа, добавена на 08.01.2010 г
Електрохимичните методи се основават на измерване на електрическите параметри на електрохимичните явления, протичащи в изследвания разтвор. Класификация на електрохимичните методи за анализ. Потенциометрично, кондуктометрично, кулонометрично титруване.
резюме, добавено на 01/07/2011
Класификация на електрохимичните методи за анализ. Потенциометрично определяне на концентрацията на вещество в разтвор. Принципът на кондуктометрията. Видове реакции при кондуктометрично титруване. Количествен полярографски анализ. Директна кулонометрия.
курсова работа, добавена на 04.04.2013 г
Същността на електроаналитичните методи, способността за получаване на експериментална информация за кинетиката и термодинамиката на химичните системи. Предимства, недостатъци и пригодност на волтаметрията, кондуктометрията, потенциометрията, амперометрията и кулометрията.
резюме, добавено на 20.11.2009 г
Обща характеристика на потенциометричния анализ. Индикаторни електроди (електроннообменни и йоноселективни). Видове потенциометрични методи за анализ. Директна потенциометрия и потенциометрично титруване. Измерване на ЕМП на електрохимични вериги.
курсова работа, добавена на 08.06.2012 г
Общи понятия, условия и класификация на електрохимичните методи за анализ. Потенциометричен анализ (потенциометрия). Амперометрично титруване (потенциометрично поляризационно титруване). Количествен полярографски анализ.
резюме, добавено на 01.10.2012 г
Електрохимични методи за изследване, тяхната класификация и същност, история на възникване. Определяне на концентрацията на киселина чрез кондуктометрично титруване; потенциали на електроди, ЕМП на галваничен елемент, електрохимичен еквивалент на мед.
курсова работа, добавена на 15.12.2014 г
Изследване на метода на потенциометричния анализ. Анализ и оценка на обекти на изследване. Изследване на техниката на потенциометричен анализ, приложена към този обект. Определяне възможността за използване на методи за потенциометричен анализ на месни продукти.
курсова работа, добавена на 16.09.2017 г
Основни електрохимични методи за анализ. Обща характеристика на потенциометричния анализ. Видове потенциометрични методи за анализ. Използването на галванична клетка, състояща се от два електрода. Процедурата за измерване на потенциала на индикаторния електрод.
курсова работа, добавена на 08/11/2014
Класификация на инструменталните методи за анализ според определяния параметър и метода на измерване. Същността на потенциометричното, амперометричното, хроматографското и фотометричното титруване. Качествено и количествено определяне на цинков хлорид.
Електрохимичните методи за анализ са набор от методи за качествен и количествен анализ, основани на електрохимични явления, възникващи в изследваната среда или на границата и свързани с промени в структурата, химичния състав или концентрацията на аналита.
Електрохимичните методи за анализ (ECMA) се основават на процеси, протичащи върху електродите или междуелектродното пространство. Предимството им е високата точност и сравнителната простота на оборудването и методите за анализ. Високата точност се определя от много прецизни модели, използвани в ECMA. Голямо удобство е, че този метод използва електрически въздействия, както и фактът, че резултатът от това въздействие (отговор) също се получава под формата на електрически сигнал. Това осигурява висока скорост и точност на отчитане и отваря широки възможности за автоматизация. ECMA се отличават с добра чувствителност и селективност, в някои случаи те могат да бъдат класифицирани като микроанализ, тъй като понякога за анализ е достатъчен по-малко от 1 ml разтвор.
Според видовете аналитични сигнали те се разделят на:
1) кондуктометрия - измерване на електрическата проводимост на тестовия разтвор;
2) потенциометрия - измерване на безтоковия равновесен потенциал на индикаторния електрод, за който изпитваното вещество е потенциоопределящо;
3) кулометрия - измерване на количеството електричество, необходимо за пълна трансформация (окисление или редукция) на изследваното вещество;
4) волтаметрия - измерване на стационарни или нестационарни поляризационни характеристики на електроди в реакции с участието на тестваното вещество;
5) електрогравиметрия - измерване на масата на вещество, освободено от разтвор по време на електролиза.
27. Потенциометричен метод.
потенциометрия - измерване на безтоковия равновесен потенциал на индикаторния електрод, за който изпитваното вещество е потенциращо.
А) стандартен (референтен електрод) – има постоянен потенциал, независим от външни въздействия. Условия
Б) индивидуален електрод – потенциалът му зависи от концентрацията на веществото.
Потенциалът зависи от концентрацията: E = f(c)
Уравнение на Нерист E= E° + lna кат
д° - стандартен. Електрон. потенциал (конст)
Р- Универ. Газова константаконст)
T – абсолютна температура (T)- +273 °
.п – брой на участващите електрони. При окисление/редукция Реакции
. а – активна концентрация
Потенциометричен метод
Ионометрична потенциометрия (малък разтвор се добавя към изследователския разтвор. Стандартен разтвор (титран) се добавя на порции, след всяко добавяне се измерва потенциалът. - E)
Точка на еквивалентност
дСх Vх = л t *Vt
28. Кондуктометричен метод.
кондуктометрия - измерване на електрическата проводимост на тестовия разтвор.
Кондуктометрично титруване
Кондуктометър (уред)
Кондуктометричният анализ (кондуктометрия) се основава на използването на връзката между електрическата проводимост (електропроводимост) на електролитни разтвори и тяхната концентрация.
Електрическата проводимост на електролитни разтвори - проводници от втори тип - се оценява въз основа на измерване на тяхното електрическо съпротивление в електрохимична клетка, която представлява стъклен съд (стъкло) с два електрода, запоени в него, между които се намира тестовият електролитен разтвор разположен. През клетката преминава променлив електрически ток. Електродите най-често се изработват от метална платина, която за увеличаване на повърхността на електродите се покрива със слой от пореста платина чрез електрохимично отлагане на платинови съединения от разтвори (платинизирани платинени електроди).
29.Полярография.
Полярографията е метод за качествен и количествен химичен анализ, основан на получаване на криви на тока спрямо напрежението във верига, състояща се от изследвания разтвор и електроди, потопени в него, единият от които е силно поляризуем, а другият практически неполяризуем. Такива криви - полярограми - се получават с помощта на полярографи.
Полярографският метод се характеризира с висока чувствителност. За извършване на анализа обикновено са достатъчни 3-5 ml от тестовия разтвор. Анализът с помощта на полярограф с автоматично записване продължава само около 10 минути. Полярографията се използва за определяне на съдържанието на токсични вещества в обекти от биологичен произход (например съединения на живак, олово, талий и др.), За определяне на степента на насищане на кръвта с кислород, за изследване на състава на издишания въздух, и вредни вещества във въздуха на промишлени предприятия Полярографският метод за анализ е много чувствителен и дава възможност за определяне на вещества в много ниски (до 0,0001%) концентрации в разтвор.
30. Класификация на методите за спектрален анализ. Концепцията за спектър.
Спектралния анализ е набор от методи за определяне на качеството и количеството. Състав, както и структура на материята (въз основа на взаимодействието на изследователския обект с различни видове радиация.)
Всички спектроскопски методи се основават на взаимодействието на атоми, молекули или йони, които изграждат анализираното вещество, с електромагнитно излъчване. Това взаимодействие се проявява в поглъщането или излъчването на фотони (кванти). В зависимост от естеството на взаимодействието на пробата с електромагнитното излъчване се разграничават две групи методи:
Емисия и абсорбция. В зависимост от това кои частици формират аналитичния сигнал се прави разлика между методите на атомната спектроскопия и методите на молекулярната спектроскопия
Емисия
При емисионните методи анализираната проба излъчва фотони в резултат на своето възбуждане.
абсорбция
При абсорбционните методи радиацията от външен източник преминава през пробата и някои от квантите се абсорбират селективно от атоми или молекули
Обхват- разпределение на стойностите на физическо количество (обикновено енергия, честота или маса). Графично представяне на такова разпределение се нарича спектрална диаграма. Обикновено спектърът се отнася до електромагнитния спектър - спектъра от честоти (или същото нещо като квантовите енергии) на електромагнитното излъчване.
1.отражение на светлината
2. въртене на светлинния лъч (дефракция)
3. разсейване на светлината: нефелометрия, турбидиметрия
4.поглъщане на светлина
5 повторно излъчване
А) фосфоресценция (продължава дълго време)
Б) флуоресценция (много къса)
Според естеството на разпределението на стойностите на физическите величини спектрите могат да бъдат дискретни (линейни), непрекъснати (твърди), а също така да представляват комбинация (суперпозиция) на дискретни и непрекъснати спектри.
Примери за линейни спектри включват масспектри и спектри на свързани-свързани електронни преходи на атом; примери за непрекъснати спектри са спектърът на електромагнитното излъчване на нагрято твърдо тяло и спектърът на свободни електронни преходи на атом; примери за комбинирани спектри са емисионните спектри на звездите, където хромосферните абсорбционни линии или повечето звукови спектри се наслагват върху непрекъснатия спектър на фотосферата.
31. Фотометрия: принцип на метода, приложение в криминалистичните изследвания.
Фотометрия - спектрален метод, основан на абсорбцията на електромагнитно лъчение във видимия и близкия ултравиолетов диапазон (методът се основава на абсорбцията на светлина)
Молекулярно атомно
Спектроскопия спектроскопия (При електронен анализ)
Кювета – през нея се пропуска светлина
л
I (интензитет на изходната светлина)
I° е интензитетът на падащата светлина.
Фотометрията е раздел от физическата оптика и измервателната техника, посветен на методите за изследване на енергийните характеристики на оптичното излъчване в процеса на неговото излъчване, разпространение в различни среди и взаимодействие с тела. Фотометрията се извършва в диапазоните на инфрачервените лъчи (дължини на вълните - 10 -3 ... 7 10 -7 m), видими (7 10 -7 ... 4 10 -7 m) и ултравиолетови (4 10 -7 ... 10 -8 m) оптично лъчение. Когато електромагнитното излъчване на оптичния диапазон се разпространява в биологична среда, се наблюдават редица основни ефекти: абсорбция и разсейване на радиация от атоми и молекули на средата, разсейване на нехомогенности на средата от частици, деполяризация на радиацията. Чрез записване на данни за взаимодействието на оптичното излъчване със средата е възможно да се определят количествени параметри, свързани с медицинските и биологични характеристики на изследвания обект. За измерване на фотометрични величини се използват инструменти, наречени фотометри. От фотометрична гледна точка светлината е радиация, способна да предизвика усещане за яркост, когато е изложена на човешкото око. Основата на фотометрията като наука е теорията на светлинното поле, разработена от А. Гершун.
Има два основни метода на фотометрия: 1) визуална фотометрия, която използва способността на човешкото око да възприема разликите в яркостта чрез изравняване на яркостта на две полета за сравнение чрез механични или оптични средства; 2) физическа фотометрия, при която различни приемници на светлина от различен вид се използват за сравняване на два източника на светлина - вакуумни фотоклетки, полупроводникови фотодиоди и др.
32. Закон на Бугер-Ламберт-Беер, използването му в количествения анализ.
Физически закон, който определя затихването на паралелен монохроматичен лъч светлина, докато се разпространява в абсорбираща среда.
Законът се изразява със следната формула:
![]() ,
,

където е интензитетът на входящия лъч, е дебелината на слоя вещество, през което преминава светлината, е индексът на абсорбция (да не се бърка с безразмерния индекс на абсорбция, който е свързан с формулата, където е дължината на вълната) .
Индексът на поглъщане характеризира свойствата на веществото и зависи от дължината на вълната λ на погълнатата светлина. Тази зависимост се нарича абсорбционен спектър на веществото.
За разтвори на абсорбиращи вещества в разтворители, които не абсорбират светлина, индексът на абсорбция може да се запише като
където е коефициентът, характеризиращ взаимодействието на молекула на абсорбиращо разтворено вещество със светлина с дължина на вълната λ, е концентрацията на разтвореното вещество, mol/l.
Твърдението, което не зависи от се нарича закон на Биър (да не се бърка със закона на Биър). Този закон предполага, че способността на една молекула да абсорбира светлина не се влияе от други околни молекули на същото вещество в разтвор. Наблюдават се обаче многобройни отклонения от този закон, особено при широки .
Ако светлинен поток с интензитет I преминава през определен слой от разтвор или газ с дебелина I, тогава според закона на Ламберт-Беер количеството абсорбирана светлина ще бъде пропорционално на интензитета /, концентрацията c на веществото, абсорбиращо светлината и дебелината на СЛОЯ) законът BMB, който свързва интензитета на светлината, падаща върху веществото и веществото, преминало през него, с концентрацията на веществото и дебелината на абсорбиращия слой. Е, това е същото като пречупването, само затихване в веществото. Което поглъща светлина в определен процент. Тоест остатъкът от светлинния поток е
33.ИЧ спектроскопия.
Този метод за анализ се основава на запис на инфрачервените абсорбционни спектри на дадено вещество. Поглъщането от материята в инфрачервената област възниква поради вибрации на атомите в молекулите. Вибрациите се делят на разтягащи (когато разстоянията между атомите се променят по време на вибрацията) и вибрационни (когато ъглите между връзките се променят по време на вибрацията). Преходите между различните вибрационни състояния в молекулите се квантуват, поради което абсорбцията в IR областта има формата на спектър, където всяка вибрация има своя собствена дължина на вълната. Ясно е, че дължината на вълната за всяка вибрация зависи от това кои атоми участват в нея и освен това зависи малко от тяхната среда.
Методът на инфрачервената спектроскопия не е метод за разделяне, тоест при изследване на всяко вещество може да се окаже, че това, което всъщност е изследвано, е смес от няколко вещества, което, разбира се, значително ще изкриви резултатите от дешифрирането на спектъра. Е, не е съвсем коректно да се говори за недвусмислена идентификация на вещество с помощта на метода на инфрачервената спектроскопия, тъй като методът по-скоро позволява да се идентифицират определени функционални групи, а не тяхното количество в съединение и методът им на комуникация помежду си.
Методът на инфрачервената спектроскопия се използва за провеждане на изследвания на полимерни материали, влакна, бояджийски покрития и наркотични вещества (при идентифициране на пълнителя често се използват въглехидрати, включително полизахариди). Методът е особено незаменим при изследване на смазочни материали, тъй като позволява едновременно да се определи естеството както на смазочната основа, така и на възможните добавки (добавки) към тази основа.
34. Рентгенофлуоресцентен анализ.
(XRF) е един от съвременните спектроскопски методи за изследване на вещество с цел получаване на неговия елементен състав, т.е. елементен анализ. Може да се използва за анализ на различни елементи от берилий (Be) до уран (U). XRF методът се основава на събирането и последващия анализ на спектър, получен чрез излагане на изследвания материал на рентгеново лъчение. При облъчване атомът преминава във възбудено състояние, което се състои в прехода на електрони към по-високи енергийни нива. Атомът остава във възбудено състояние за изключително кратко време, от порядъка на една микросекунда, след което се връща в спокойно положение (основно състояние). В този случай електроните от външните обвивки или запълват получените празни места и излишната енергия се излъчва под формата на фотон, или енергията се прехвърля към друг електрон от външните обвивки (Оже електрон)
Екология и опазване на околната среда: определяне на тежки метали в почви, седименти, вода, аерозоли и др.
Геология и минералогия: качествен и количествен анализ на почви, минерали, скали и др.
Металургия и химическа промишленост: контрол на качеството на суровините, производствения процес и готовата продукция
Бояджийска и лакова промишленост: анализ на оловни бои
35. Атомно-емисионна спектроскопия.
Атомно-емисионният спектрален анализ е набор от методи за елементен анализ, базирани на изследване на емисионните спектри на свободни атоми и йони в газовата фаза. Обикновено емисионните спектри се записват в най-удобния оптичен диапазон на дължина на вълната от 200 до 1000 nm.
AES (атомно-емисионна спектрометрия) е метод за определяне на елементарния състав на веществото от спектрите на оптичните емисии на атомите и йоните на анализираната проба, възбудени в източници на светлина. Като източници на светлина за анализ на атомни емисии се използват пламък на горелка или различни видове плазма, включително електрическа искра или дъгова плазма, лазерна искрова плазма, индуктивно свързана плазма, тлеещ разряд и др. AES е най-разпространеният експресен, високочувствителен метод за идентифициране и количествено определяне на примеси на елементи в газообразни, течни и твърди вещества, включително такива с висока чистота.
Области на употреба:
Металургия: анализ на състава на метали и сплави,
Минна промишленост: изследване на геоложки проби и минерални суровини,
Екология: анализ на водата и почвата,
Оборудване: анализ на моторни масла и други технически течности за метални примеси,
Биологични и медицински изследвания.
Принцип на действие.
Принципът на работа на атомно-емисионния спектрометър е доста прост. Основава се на факта, че атомите на всеки елемент могат да излъчват светлина с определени дължини на вълната - спектрални линии, като тези дължини на вълните са различни за различните елементи. За да започнат атомите да излъчват светлина, те трябва да бъдат възбудени – чрез топлина, електрически разряд, лазер или по друг начин. Колкото повече атоми на даден елемент присъстват в анализираната проба, толкова по-ярко ще бъде излъчването на съответната дължина на вълната.
Интензитетът на спектралната линия на анализирания елемент, в допълнение към концентрацията на анализирания елемент, зависи от голям брой различни фактори. Поради тази причина е невъзможно теоретично да се изчисли връзката между интензитета на линията и концентрацията на съответния елемент. Ето защо за анализ са необходими стандартни проби, които са подобни по състав на анализираната проба. Тези стандартни проби първо се експонират (изгарят) на устройството. Въз основа на резултатите от тези изгаряния се изгражда калибровъчна графика за всеки анализиран елемент, т.е. зависимост на интензитета на спектралната линия на даден елемент от неговата концентрация. Впоследствие, когато се анализират проби, тези калибрационни графики се използват за преизчисляване на измерените интензитети в концентрации.
Подготовка на проби за анализ.
Трябва да се има предвид, че реално се анализират няколко милиграма проба от нейната повърхност. Следователно, за да се получат правилни резултати, пробата трябва да бъде хомогенна по състав и структура и съставът на пробата трябва да бъде идентичен със състава на анализирания метал. Когато анализирате метал в леярна или топилна фабрика, се препоръчва използването на специални форми за отливане на проби. В този случай формата на пробата може да бъде произволна. Необходимо е само анализираната проба да има достатъчна повърхност и да може да се закрепи в стойка. Специални адаптери могат да се използват за анализ на малки проби като пръти или жици.
Предимства на метода:
Безконтактен,
Възможност за едновременно количествено определяне на голям брой елементи,
Висока точност,
Ниски граници на откриване,
Лесна подготовка на пробите,
Ниска цена.
36. Атомно-абсорбционна спектроскопия.
метод за количествено определяне на елементарния състав на изследваното вещество с помощта на атомни абсорбционни спектри, основан на способността на атомите да абсорбират селективно електромагнитно излъчване при разлагане. части от спектъра. А.-а.а. извършва се на спец устройства - абсорбционни спектрофотометри. Проба от анализирания материал се разтваря (обикновено с образуване на соли); разтворът под формата на аерозол се подава в пламъка на горелката. Под въздействието на пламък (3000°C) молекулите на солта се разпадат на атоми, които могат да абсорбират светлина. След това през пламъка на горелката се пропуска лъч светлина, в спектъра на който има спектрални линии, съответстващи на един или друг елемент. Изследваните спектрални линии се изолират от общата радиация с помощта на монохроматор, а интензитетът им се записва от записващо устройство. математика обработката се извършва по формулата: J = J0 * e-kvI,
където J и J0 са интензитетите на пропусната и падаща светлина; kv – коеф абсорбция, в зависимост от честотата му; I - дебелина на абсорбиращия слой
по-чувствителни от атомните електроцентрали
37. Нефелометрия и турбидиметрия.
S = log (I°/I) спад на интензитета. В разтвор (I°) разделете на интензитета, напускащ разтвора (I) =
k-const мътност
b – дължина на пътя на светлинния лъч
N е броят на частиците на единица. решение
Нефелометричният и турбидиметричният анализ използва феномена на разсейване на светлината от твърди частици, суспендирани в разтвор.
Нефелометрията е метод за определяне на дисперсията и концентрацията на колоидните системи по интензитета на разпръснатата от тях светлина. Нефелометрия, измерванията се извършват в специално устройство, нефелометър, чието действие се основава на сравняване на интензитета на светлината, разсеяна от изследваната среда, с интензитета на светлината, разсеяна от друга среда, която служи като стандарт. Теорията за разсейване на светлината от колоидни системи, в които размерите на частиците не надвишават половината от дължината на вълната на падащата светлина, е разработена от английския физик J. Rayleigh през 1871 г. Съгласно закона на Rayleigh, интензитетът на светлината I, разпръсната в посока, перпендикулярна на падащият лъч се изразява с формулата I = QNvlk - където q е интензитетът на падащата светлина, N е общият брой частици на единица обем или частична концентрация, v е обемът на една частица, \ е дължината на вълната на падащата светлина, k е константа, зависеща от показателите на пречупване на колоидните частици и заобикалящата ги дисперсионна среда, разстоянието от източника на светлина, както и от приетите мерни единици
Турбидиметрията е метод за анализ на мътни среди, базиран на измерване на интензитета на абсорбираната от тях светлина. Турбидиметричните измервания се извършват в пропускаща светлина с помощта на визуални турбидиметри или фотоелектрични колориметри. Техниката на измерване е подобна на колориметричната и се основава на приложимостта на закона на Бугер-Ламбер към мътни среди, който в случая на суспензии е валиден само за много тънки слоеве или при значителни разреждания. Турбидиметрията изисква внимателно спазване на условията за образуване на дисперсната фаза, подобни на условията, наблюдавани при нефелометрията. Значително подобрение в турбидиметрията е използването на турбидиметрично титруване на пикова мътност с помощта на фотоелектрични колориметри. Турбидиметрията се използва успешно за аналитично определяне на сулфати, фосфати, хлориди, цианиди, олово, цинк и др.
Основното предимство на нефелометричните и турбидиметричните методи е тяхната висока чувствителност, което е особено ценно по отношение на елементи или йони, за които няма цветни реакции. В практиката, например, широко се използва нефелометрично определяне на хлориди и сулфати в природни води и подобни обекти. По отношение на точността, турбидиметрията и нефелометрията са по-ниски от фотометричните методи, което се дължи главно на трудностите при получаване на суспензии със същите размери на частиците, стабилност във времето и т.н. В допълнение към обичайните относително малки грешки при фотометрично определяне, свързаните грешки с недостатъчната възпроизводимост на химичните аналитични методи се добавят свойства на суспензиите.
Нефелометрията и турбидиметрията се използват например за определяне на SO4 под формата на суспензия на BaSO4, Cl- под формата на суспензия на AgCl, S2- под формата на суспензия на CuS от дъното. границите на откриваемото съдържание са ~ 0,1 μg/ml. За стандартизиране на условията на анализ в експериментите е необходимо стриктно да се контролира температурата, обемът на суспензията, концентрацията на реагентите, скоростта на разбъркване и времето на измерване. Утаяването трябва да протича бързо, а утаените частици трябва да са с малък размер и ниско pH. За да се предотврати коагулацията на големи частици, често към разтвора се добавя стабилизатор, например. желатин, глицерин.
38. Хроматография: история на възникване, принцип на метода, приложение в съда. Проучване.
Хроматографията е динамичен сорбционен метод за разделяне и анализ на смеси от вещества, както и за изследване на физикохимичните свойства на веществата. Основава се на разпределението на веществата между две фази - неподвижна (твърда фаза или течност, свързана върху инертен носител) и подвижна (газова или течна фаза, елуент). Името на метода се свързва с първите експерименти в хроматографията, по време на които разработчикът на метода Михаил Цвет отделя ярко оцветени растителни пигменти.
Хроматографският метод е използван за първи път от руския ботаник Михаил Семенович Цвет през 1900 г. Той използва колона, пълна с калциев карбонат, за да раздели растителните пигменти. Първият доклад за развитието на хроматографския метод е направен от Цвет на 30 декември 1901 г. XI конгрес на естествоизпитателите и лекаритев Санкт Петербург. Първата печатна работа по хроматография е публикувана през 1903 г. в списанието Сборници на Варшавското дружество на естествоизпитателите. Срок за първи път хроматографиясе появява в две печатни произведения на Color през 1906 г., публикувани в немско списание Berichte der Deutschen Botanischen Gesellschaft. През 1907 г. Цвет демонстрира своя метод Германско ботаническо дружество.
През 1910-1930 г. методът е незаслужено забравен и практически не се развива.
През 1931 г. R. Kuhn, A. Winterstein и E. Lederer, използвайки хроматография, изолират α и β фракции в кристална форма от суровия каротин, като по този начин демонстрират препаративната стойност на метода.
През 1941 г. A. J. P. Martin и R. L. M. Singh разработват нов тип хроматография, която се основава на разликата в коефициентите на разпределение на отделените вещества между две несмесващи се течности. Методът беше наречен " разделителна хроматография».
През 1947 г. Т. Б. Гапон, Е. Н. Гапон и Ф. М. Шемякин разработват метода на „йонообменна хроматография“.
През 1952 г. Дж. Мартин и Р. Сингх са удостоени с Нобелова награда за химия за създаването на метода на разделителната хроматография.
От средата на 20 век до наши дни хроматографията се развива интензивно и се превръща в един от най-използваните аналитични методи.
Класификация: газ, течност
Основи на хроматографията процес.За извършване на хроматография разделяне на веществата или определяне на физико-хим. характеристики обикновено се използват специални. уреди - хроматографи. Основен хроматографски единици - хроматографски. колона, детектор и устройство за инжектиране на проба. Колоната, съдържаща сорбента, изпълнява функцията за разделяне на анализираната смес на съставните компоненти, а детекторът изпълнява функцията за разделяне на техните количества. дефиниции. Детекторът, разположен на изхода на колоната, автоматично определя непрекъснато концентрацията на отделените съединения. в потока на подвижната фаза След въвеждане на анализираната смес с потока на подвижната фаза в колоната, зоните на всички вещества се намират в началото на хроматографията. колони (фиг. 1). Под въздействието на потока на подвижната фаза компонентите на сместа започват да се движат по колоната с разлагане. скорости, чиито стойности са обратно пропорционални на коефициентите на разпределение K на хроматографираните компоненти. Добре сорбираните вещества, чиито константи на разпределение са големи, се движат по сорбентния слой по протежение на колоната по-бавно от слабо сорбираните вещества. Следователно компонент A напуска колоната най-бързо, след това компонент B, а последният, който напуска колоната, е компонент C (K A<К Б <К В). Сигнал детектора, величина к-рого пропорциональна концентрации определяемого в-ва в потоке элюента, автоматически непрерывно записывается и регистрируется (напр., на диаграммной ленте). Полученная хроматограмма отражает расположение хроматографич. зон на слое сорбента или в потоке подвижной фазы во времени.

Ориз. 1.Разделяне на смес от три компонента (А, В и С) на хроматографска колона К с детектор D: а - положение на хроматографските зони на отделените компоненти в колоната през определени интервали от време; b - хроматограма (C - сигнал, t - време) .
С плоскослойна хроматография При разделяне в хроматограф се поставя лист хартия или плоча със слой сорбент с нанесени проби от изследваното вещество. камера. След разделянето компонентите се определят по всеки подходящ метод.
39. Класификация на хроматографските методи.
Хроматографията е метод за разделяне и анализ на вещества въз основа на разпределението на аналита. Разликата между 2 фази: мобилна и стационарна
Разтвор на смес от вещества, които трябва да се разделят, преминава през стъклена тръба (адсорбционна колона), пълна с адсорбент. В резултат на това компонентите на сместа се задържат на различни височини на адсорбентната колона под формата на отделни зони (слоеве). Нещата са по-добри от adsorbir. Те са в горната част на колоната и по-лошо се адсорбират в долната част на колоната. Веществата, които не могат да бъдат адсорбирани, преминават през колоната без спиране и се събират във филтъра.
класификации:
1. Според агрегатното състояние на фазите.
1) Подвижен
А) газ (инертни газове: хелий, аргон, азон)
Б) течност
2. според начина на изпълнение
1) на равнина (плоска); тънкослойна хартия
2) колонен
A) пакетиран (опакована колона, пълна със сорбент)
B) капиляр (тънък капиляр от стъкло/кварц, върху чиято вътрешна повърхност е нанесена неподвижна фаза)
Можете да дефинирате. Артикули в малки количества.
Летливите вещества се отделят.
40. Хроматограма. Основни параметри на хроматографския пик.
Хроматограмата е резултат от записване на зависимостта на концентрацията на компонентите на изхода на колоната от времето.
з С
Всеки пик в хроматограмата се характеризира с две основни параметри
1. Време на задържане ( T Р) е времето от момента на въвеждане на анализираната проба до записването на максимума на хроматографския пик. Зависи от природата на веществото и е качествена характеристика.
2. Височина ( ч) или област ( С) връх
С = ½ ω × ч. (4)
Височината и площта на пика зависят от количеството на веществото и са количествени характеристики.
Времето на задържане се състои от два компонента - времето на престой на веществата в подвижната фаза ( T м) и времето на престой в стационарната фаза ( T с):
Идентифицирането на пикове на неизвестни компоненти на анализираната смес се извършва чрез сравнение (сравнение). стойности, определени директно от хроматограмата, със съответните таблични данни за известни съединения. При идентифициране в хроматография само отрицателният е надежден. отговор; например, пик i не е елемент А, ако времената на задържане на пик i и елемент А не съвпадат. Съвпадението на времената на задържане на пик i и елемент А е необходимо, но не достатъчно условие, за да се заключи, че пик i е елемент А.
В практическата работа изборът на един или друг параметър за количествено декодиране на хроматограмите се определя от комбинираното влияние на няколко фактора: скоростта и лекотата на изчисление, формата (широка, тясна) и степента на асиметрия на хроматографския пик, ефективността на използваната колона, пълнотата на разделяне на компонентите на сместа, наличието на необходимите автоматизирани устройства (интегратори, компютърни системи за обработка на хроматографски данни).
Определеният параметър на хроматографския пик се измерва ръчно от оператора на хроматограмата в края на цикъла на разделяне на компонентите на анализираната смес
Определеният параметър на хроматографския пик се измерва автоматично с помощта на цифрови волтметри, интегратори или специализирани компютри, едновременно с разделянето на компонентите на анализираната смес в колоната и запис на хроматограмата
Тъй като техниката за декодиране на хроматограми се свежда до измерване на параметрите на хроматографските пикове на представляващото интерес съединение и стандартното съединение, условията на хроматография трябва да осигурят пълното им разделяне, доколкото е възможно; всички други компоненти на оригиналната проба при приетите условия за анализ могат да бъдат да не се отделят един от друг или дори изобщо да не се появяват на хроматограмата (това е предимство на метода на вътрешния стандарт пред метода на вътрешна нормализация)
41. Качествен хроматографски анализ.
Ако дължината на колоната е достатъчна, може да се постигне пълно разделяне на компонентите на всяка смес. И след елуиране на отделените компоненти в отделни фракции (елуати), определете броя на компонентите на сместа (той съответства на броя на елуатите), установете техния качествен състав, определете количеството на всеки от тях, като използвате подходящи методи за количествен анализ. .
Качествен хроматографски анализ, т.е. идентифицирането на веществото според неговата хроматограма може да се извърши чрез сравняване на хроматографските характеристики, най-често задържания обем (т.е. обемът на подвижната фаза, преминал през колоната от началото на въвеждане на сместа до появата на този компонент на изхода от колоната), открити при определени условия за компонентите на смесите на анализираните вещества и за стандарта.
42.Количествен хроматографски анализ.
Количественият хроматографски анализ обикновено се извършва на хроматограф. Методът се основава на измерване на различни параметри на хроматографския пик, в зависимост от концентрацията на хроматографираните вещества - височина, ширина, площ и задържан обем или произведението на задържания обем и височина на пика.
При количествената газова хроматография се използват методите на абсолютно калибриране и вътрешна нормализация или нормализация. Използва се и методът на вътрешния стандарт. При абсолютно калибриране експериментално се определя зависимостта на височината или площта на пика от концентрацията на веществото и се изграждат калибрационни графики или се изчисляват съответните коефициенти. След това се определят същите характеристики на пиковете в анализираната смес и концентрацията на аналита се намира от графиката за калибриране. Този прост и точен метод е основният за определяне на следи от примеси.
Когато се използва методът на вътрешна нормализация, сумата от всички пикови параметри, например сумата от височините на всички пикове или сумата от техните площи, се приема за 100%. Тогава съотношението на височината на отделен пик към сумата от височините или съотношението на площта на един пик към сумата от площите, когато се умножи по 100, ще характеризира масовата част (%) на компонента в смес. При този подход е необходимо зависимостта на стойността на измервания параметър от концентрацията да е еднаква за всички компоненти на сместа.
43. Планарна хроматография. Използване на тънкослойна хроматография за анализ на мастило.
Първата форма на използване на целулоза в тънкослойна хроматография е хартиената хроматография. Наличните TLC и високопроизводителни TLC плаки позволяват разделянето на смеси от полярни вещества, като се използват поне трикомпонентни смеси от вода, несмесващ се органичен разтворител и водоразтворим разтворител, който насърчава образуването на една фаза като елуенти)