Dūmu bez uguns
Sārmu metāli reaģē ar amonjaku, veidojot amīdus:
Sārmzemju metāli veido nitrīdus
Citi slāpekļa ūdeņraža savienojumi
Bezkrāsains šķidrums, kas smaržo pēc amonjakaKvīts:
Tāpat kā amonjaks, tam piemīt pamatīpašības.
Kā bāze hidrazīns veido divas hidrazonija sāļu sērijas, piemēram,
N2H6C12 (dihlorīds) un N2H5C1 (hlorīds), pēdējo var iegūt arī
un karsējot dihlorīdu:
Tā ir nestabila viela, kas karsējot viegli sadalās:
Tā ir vājāka bāze nekā amonjaks un hidrazīns, un tā ir
reducētājs, oksidējas līdz slāpekļa oksīdam (I) 3. Ar amonjaku notiek sprādziens:
4. Saskaroties ar spēcīgiem oksidētājiem, tas darbojas kā reducētājs:
NO ķīmiskās īpašības
NO ir tipisks reducētājs; tas maina kālija permanganāta šķīduma krāsu:Viegli oksidējas ar atmosfēras skābekli. Reakcija ir ļoti ātra, jo slāpekļa oksīds (II)
ir nepāra elektrons un būtībā ir radikāls:
Reakcija noved pie slāpekļa oksīda (IV) veidošanās, kam ir raksturīga sarkanbrūna krāsa
krāsa.
Oksidēšanas īpašības ir mazāk raksturīgas (tikai ar spēcīgiem reducētājiem):
Rodija katalizatorā tas oksidē oglekļa monoksīdu līdz oglekļa dioksīdam. Šādi katalizatori tiek ievietoti
automašīnu izplūdes caurules, lai izvairītos no oglekļa monoksīda piesārņojuma.
Bioloģiskā loma:
NO spēj iekļūt šūnu membrānās. Šai molekulai ir svarīga loma asins regulēšanā
spiedienu, muskuļu relaksāciju un ir iesaistīts nespecifiskā imūnreakcijā. Dažu narkotiku darbība
piemēram, nitroglicerīns, balstās uz šīs konkrētās molekulas veidošanos.
Tajā pašā laikā NO ir toksisks, jo tas spēj saistīties ar hemoglobīnu kā oglekļa monoksīds un novērst
skābekļa un oglekļa dioksīda transportēšana.
Slāpekļa oksīda (IV) ķīmiskās īpašības
Tas pastāv līdzsvara maisījuma veidā:Slāpekļa oksīds (IV) ir divu skābju: slāpekļa un slāpekļa oksīds. Nesamērīgi ūdenī:
Tā kā pēdējā skābe ir stabila tikai aukstumā, istabas temperatūrā un augstāk
temperatūrā, reakcija norit savādāk:
Taču, ja slāpekļa oksīda (IV) un gaisa maisījumu laiž cauri ūdenim, veidojas tikai slāpekļa oksīds.
skābe:
Līdzīgi notiek reakcijas ar sārmiem: izlaižot slāpekļa oksīdu, veidojas maisījums
sāļi, un, ja oksīds tiek nodots kopā ar gaisu, tad tikai viens sāls.
Slāpekļa oksīds (IV) ir spēcīgs oksidētājs, tajā deg sērs, ogleklis un metāli.
Gāzes fāzē tas pat oksidē hlorīda jonu:
Ir arī citi slāpekļa oksīdi (III un V), taču tie nav stabili. Slāpekļskābe ir ļoti spēcīgs oksidētājs
noteiktos apstākļos reaģē ar vairākumu
neorganiskās un organiskie savienojumi
Mijiedarbība ar metāliem
Slāpekļskābes sāļu ķīmiskās īpašības: I. Nitrātu sāļu sadalīšanās
1. IA grupas metāli (izņemot litija nitrātu)2. Litija nitrāts un citu metālu nitrāti (izņemot dzīvsudraba nitrātus un
Sudrabs)
3. Dzīvsudrabs un sudraba nitrāti sadalās līdz tīram metālam, jo tie
oksīds ir nestabils
4. Metālu sadalīšanās zemākos oksidācijas pakāpēs turpinās ar
šī metāla oksidēšana
4Fe(NO3)2 2Fe2O3 + 8NO2 + O2
II Nitrātu sāļu oksidējošās īpašības
5. Nitrāti ir daļa no šaujampulvera:
6. Šķīdumā tie reaģē ar metāliem:
Fosfora ķīmiskās īpašības
Kvalitatīvi uzdevumi (Doronkins, Berežnaja)
Turpinājums
Projektēšanas uzdevumi Slāpekļa uzdevumi
1.2.
3.
4.
5.
6.
7.
Vara plāksne, kas sver 1,28 g, tika nolaista 63% slāpekļskābes šķīdumā, kas sver 10 g. Atrast masu
10% nātrija hidroksīda šķīdums, kas pilnībā neitralizētu iegūto šķīdumu. (Atbilde:
24d).
Vara (II) nitrāta un nātrija nitrāta maisījums, kas sver 46,1 g, tika kalcinēts, iegūstot maisījumu.
gāzes, kas tika izlaistas caur bārija hidroksīda šķīdumu. Rezultātā tika iegūts sāls ar masu 52,2 g.
Nosaka sāļu masas daļas sākotnējā maisījumā (attiecīgi 81,56% un 18,44%).
Oglekļa un silīcija maisījumu, kas sver 8 g, pievienoja 63% slāpekļskābes šķīdumam. Izceļas brūns
gāze tika izlaista caur kālija hidroksīda šķīdumu, iegūstot šķīdumu, kas sver 484,8 g ar masu
sāls īpatsvars ir 8,33%. Nosaka vienkāršu vielu masas daļas sākotnējā maisījumā (30% un 70%
attiecīgi).
Magnija gabals, kas sver 4,8 g, tika izšķīdināts 630 g 6% slāpekļskābes šķīduma, kamēr tas bija gāzveida
produkti netika izlaisti. Atrodiet 40% nātrija hidroksīda šķīduma masu, kas spēj pilnībā
reaģē ar iegūto šķīdumu. (55 g).
Alumīnija un vara pulveru maisījumu pievienoja 61% slāpekļskābes šķīdumam istabas temperatūrā.
temperatūru, un novēroja krāsainas gāzes izdalīšanos ar tilpumu 26,88 litri. Pēc tam uz iegūto maisījumu
tika pievienots pārāk daudz nātrija hidroksīda šķīduma, kā rezultātā izveidojās gāze un nogulsnes molārā
attiecība 1:2. Nosaka metālu masas daļas sākotnējā maisījumā. (Atbilde: 12,3% un 87,7%
attiecīgi.)
42 g slāpekļskābes šķīduma tika pievienota kristāliskā soda, kas sver 14,3 g. Uz saņemto
Šķīdumam tika pievienota vara stieple, un tika atbrīvota bezkrāsaina gāze ar tilpumu 560 ml
šķīdumā nav palikuši ūdeņraža joni. Nosaka skābes masas daļu sākotnējā šķīdumā.
(Atbilde: 30%).
Cinka nitrāta dihidrāts tika izšķīdināts 100 g ūdens, iegūstot 3,62%
sāls šķīdums. Tad tur pievienoja 100 g 40% nātrija hidroksīda šķīduma un šķīdumu ar
sārmu masas daļa 18%. Nosaka kristāliskā hidrāta masu. (4,5 g)
Uzdevumi par fosforu
1.2.
3.
4.
5.
6.
7.
Tika sadedzināts baltais fosfors, kas sver 9,3 g, un iegūtā baltā viela tika izšķīdināta ūdenī un karsēta.
Atrodiet 10% nātrija hidroksīda šķīduma tilpumu (blīvums 1,2 g/ml), kas nepieciešams, lai iegūtu
divi skābes sāļi vienādās molārās attiecībās. (Atbilde: 150 ml).
Atrodiet baltā fosfora masu, kas izšķīdināta 100 g 40% karstā hidroksīda šķīdumā
nātrijs, lai sārmu masas daļa šķīdumā kļūtu vienāda ar 25,69%. (Atbilde: 12,4 g)
Sajauc 340 g 5% sudraba nitrāta šķīduma un 164 g 10% šķīduma. Atrodiet minimālo tilpumu 15%
šķīdums (blīvums 1,14 g / ml), kas nepieciešams, lai izšķīdinātu iegūtās nogulsnes. (Atbilde:
19,1 ml).
Kalcija ortofosfātam, kas sver 31 g, tika pievienoti 392 g 10% sērskābes šķīduma. Atrodiet skaļumu
20% kālija hidroksīda šķīdums (blīvums 1,12 g / ml), kas nepieciešams pilnīgai
iegūtā šķīduma neitralizācija. (Atbilde: 200 ml).
Fosfors tika sadedzināts skābekļa pārpalikumā, un iegūtais produkts tika pievienots 110 g 2% šķīduma.
nātrija hidroksīdu, tādējādi iegūstot skābos un vidējos sāļus attiecībā 1:3. (Atbilde: 0,62g)
Fosfora jodīds, kas sver 66,6 g, tika izšķīdināts ūdens pārpalikumā. Nosaka 20% nitrāta šķīduma masu
sudrabs, kas spēj pilnībā reaģēt ar iegūto šķīdumu un kopējo masu
nogulsnes, kas veidojas. (Atbilde: 680 g šķīduma un 159,4 g nogulumu).
Tika sadedzināts fosfīns ar svaru 3,4 g, tā sadegšanas produkts tika izžāvēts un pievienots 160 g 10% šķīduma.
nātrija hidroksīds. Nosakiet 16% sudraba nitrāta šķīduma masu, kas var pilnībā
reaģē ar iegūto šķīdumu. (Atbilde: 425g).
Ķīmijas stunda 10. klasē: "Slāpeklis un fosfors - VA grupas p-elementi"
- sagatavots
- ķīmijas un bioloģijas skolotāja
- GUO vidusskola №163 Minska
- Kostjukevičs Jurijs Mihailovičs
- Ķīmiskajos savienojumos slāpekļa un fosfora atomi var uzrādīt oksidācijas pakāpi no -3 līdz +5.
- Slāpeklis ir apzīmēts ar N
- (lat. Nitrogenium, t.i. "salpetra dzemdēšana).
- Vienkārša viela slāpeklis (N2) ir diezgan inerta pie normāli apstākļi bezkrāsaina, bez garšas un smaržas gāze.
- Slāpeklis diatomisku N2 molekulu veidā veido lielāko daļu atmosfēras, kur tā saturs ir 78,084 tilpuma% (tas ir, aptuveni 3,87 1015 tonnas).
- Ārpus Zemes slāpeklis ir atrodams gāzveida miglājos, Saules atmosfērā, Urānā, Neptūnā, starpzvaigžņu telpā utt. Slāpeklis ir 4. izplatītākais elements. Saules sistēma(pēc ūdeņraža, hēlija un skābekļa).
- Fosfors dabiski sastopams fosfātu veidā. Tādējādi kalcija fosfāts Ca3(PO4)2 ir minerāla apatīta galvenā sastāvdaļa.
- Fosfors ir atrodams visās daļās zaļie augi, vēl vairāk tā augļos un sēklās.
- Satur dzīvnieku audos, ir daļa no olbaltumvielām un citiem būtiskiem organiskiem savienojumiem (ATP, DNS), ir dzīvības elements.
- Apatīts
- Fosfors
- Gaismā un sildot līdz 300 ° C bez gaisa baltais fosfors pārvēršas sarkanajā fosforā.
- No metāliem normālos apstākļos slāpeklis reaģē tikai ar litiju, veidojot litija nitrīdu:
- Slāpekļa un fosfora reducējošās īpašības izpaužas, kad tie mijiedarbojas ar skābekli. Tātad slāpeklis reaģē ar skābekli aptuveni 3000˚С temperatūrā, veidojot slāpekļa oksīdu (II):
- Baltā fosfora oksidēšanos pavada luminiscence. Baltais un sarkanais fosfors aizdedzoties aizdegas un sadeg ar žilbinoši spilgtu liesmu, veidojot baltus fosfora (IV) oksīda dūmus:
- - Sarajevas aplenkuma laikā fosfora šāviņus izmantoja Bosnijas serbu artilērija. 1992. gadā šādas čaulas nodedzināja Orientālistikas institūta ēku, kā rezultātā tika iznīcināti daudzi vēstures dokumenti.
- - 2003.-2004.gadā tos izmantoja Lielbritānijas izlūkdienesti Basras apkaimē Irākā.
- - 2004. gadā ASV izmantoja pret partizānu pagrīdi Irākā kaujā par Fallūdžu.
- 2006. gada vasarā, Otrā Libānas kara laikā, artilērijas šāviņus ar balto fosforu izmantoja Izraēlas armija.
- 2009. gadā operācijas Cast Lead laikā Gazas joslā Izraēlas armija izmantoja ar starptautiskajiem tiesību aktiem atļauto munīciju, kas satur balto fosforu.
- Kopš 2009. gada palestīniešu teroristi ir pielādējuši savas raķetes ar balto fosforu.
- Vienkāršu vielu lietošana
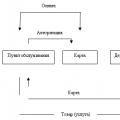
- Ražošana
- amonjaks
- Lielākā daļa mūsdienu lampu ir piepildītas ar ķīmiski inertu gāzi. Slāpekļa N2 maisījumi ar argonu Ar ir visizplatītākie to zemo izmaksu dēļ.
- http://ru.wikipedia.org/wiki/Slāpeklis
- http://ru.wikipedia.org/wiki/Fosfors
- http://distant-lesssons.ru/ximiya/podgruppa-azota
- http://www.vredno.com.ua/2011/10/05/
- http://21region.org/sections/book/41869-istoriya-spichek.html
- http://x-ufo.ru/2008/08/19/fotografii_pjejjnobektov_s_kladbishha.html
- http://www.varson.ru/images/Himia_jpeg_big/7-04.jpg
- http://lols.ru/2010/11/09/
"Fosfora savienojumi" - Fosfora oksīds. Fosforskābes mijiedarbība ar sāļiem. Fosforskābe (H3PO4). Fosfora (V) oksīda ķīmiskās īpašības. Fosforskābes mijiedarbība ar sārmiem. Ķīmiskās īpašības. Savienojums. Fosforskābes mijiedarbība ar metāliem. Fosfora savienojumi. Fosfora (V) oksīda fizikālās īpašības.
"Fosfora nodarbība" - Motivācijas-orientēšanās posms. Fosfora atklāšanas vēsture. Iegūto zināšanu primārā nostiprināšana. Fosfors kā elements. Video "Fosfora sadedzināšana hlorā." 1682 – R. Boils ķīmiskajā laboratorijā, strādājot ar fosforu. Melns. Mēģiniet noteikt, kur ir patiesība un kur autora izdomājums? Fosfora allotropija.
"Nodarbība Fosfora savienojumi" - 1. Orientēšanās un motivācija. 2. Darbības un izpildes. 3. Reflektīvs-vērtējošs. Reaģenti ir sarkanais fosfors. 2. posms. Operatīvā izpilde. Aprīkojums un didaktiskais materiāls. Fosfora pozīcija D.I. Mendeļejeva periodiskajā sistēmā. Skolotāja motivē skolēnus, lasot A. Konana Doila romāna fragmentu.
"Fosfors un tā savienojumi" - Secinājumi. Fosfors un tā savienojumi. Ammophos. Nogulsnējas. Fosfora mēslošanas līdzekļi. Ar fosfora trūkumu attīstās augu slimības. Fosfora savienojumi augu šūnā. Mērķis: izpētīt fosfora ietekmi uz augu augšanu un attīstību. Vienkāršs superfosfāts. Fosfora padeve augam ir īpaši nepieciešama jaunā vecumā.
"Fosfora elementa raksturojums" - Baltā fosfora mirdzums. Slāpekļa un fosfora atoma uzbūves salīdzinājums. baltais fosfors. Fosfora iegūšana. Oksidētājs. Atklājis vācu alķīmiķis X. Brand. Sarkanā fosfora degšana. Fosfors deg ar gaiši zaļu liesmu. Fosfora allotropās modifikācijas. Nemetāla. Fosfora izmantošana. Fosfīdus enerģiski sadala ūdens.
"Elements fosfors" - Mijiedarbība ar metāliem. Melnais fosfors. Kalcija savienojumu saistīšanai pievieno kvarca smiltis. Fosfors. Karsējot balto fosforu sārma šķīdumā, tas nesamērīgi kļūst. Mijiedarbība ar sārmiem. baltais fosfors. Fosfors ir 12. vietā visbiežāk sastopamais elements dabā. Mijiedarbība ar vienkāršām vielām – nemetāliem.
Tēmā kopā ir 12 prezentācijas
1. slaids
 2. slaids
2. slaids
 3. slaids
3. slaids
 4. slaids
4. slaids
 5. slaids
5. slaids
 6. slaids
6. slaids
 7. slaids
7. slaids
 8. slaids
8. slaids
 9. slaids
9. slaids
 10. slaids
10. slaids
 11. slaids
11. slaids
 12. slaids
12. slaids
 13. slaids
13. slaids
 14. slaids
14. slaids
 15. slaids
15. slaids
 16. slaids
16. slaids
 17. slaids
17. slaids
 18. slaids
18. slaids
 19. slaids
19. slaids
 20. slaids
20. slaids
 21. slaids
21. slaids
 22. slaids
22. slaids
 23. slaids
23. slaids
 24. slaids
24. slaids
 25. slaids
25. slaids
 26. slaids
26. slaids
 27. slaids
27. slaids
 28. slaids
28. slaids
 29. slaids
29. slaids
Prezentāciju par tēmu "Fosfors" var lejupielādēt pilnīgi bez maksas mūsu vietnē. Projekta priekšmets: Ķīmija. Krāsaini slaidi un ilustrācijas palīdzēs ieinteresēt klasesbiedrus vai auditoriju. Lai skatītu saturu, izmantojiet atskaņotāju vai, ja vēlaties lejupielādēt pārskatu, noklikšķiniet uz atbilstošā teksta zem atskaņotāja. Prezentācijā ir 29 slaidi.
Prezentācijas slaidi

1. slaids
Materiāls atkārtošanai un sagatavošanai GIA Ķīmijas skolotājam Pašvaldības izglītības iestādē "Ģimnāzija Nr. 1", Saratov Shishkina I.Yu.

2. slaids
Ievads……………………………………………………………………………. Fosfora attīstības vēsture………………………………………………………… Dabiskie savienojumi un fosfora ražošana…………………………………… ……… Ķīmiskās īpašības ……………………………………………………………… Allotropās izmaiņas……………………………………………… …………….. a) balts……………………………………………………………………………….. b) sarkans………………… ………………… …………………………… c) melns……………………………………………………………………………… . Fosfora oksīdi…………………………………………………………………… Ortofosforskābe……………………………………………………… …… ……… Ortofosfāti………………………………………………………………………. Fosfors cilvēka organismā…………………………………………………….. Atbilst…………………………………………………………… ………………………. Fosfātu mēslošanas līdzekļi…………………………………………………………….. Secinājums……………………………………………………………… ……………………. 1. Fosfora vērtība…………………………………………………………………….. 2. Fosfora izmantošana……………………………… ……………… ………………… Bibliogrāfija…………………………………………………..

3. slaids
Ievads:
Periodiskās sistēmas piektajā grupā ietilpst divi tipiski elementi slāpeklis un fosfors un arsēna un vanādija apakšgrupas. Starp pirmo un otro tipisko elementu ir ievērojama īpašību atšķirība. Vienkāršu vielu stāvoklī slāpeklis ir gāze, bet fosfors ir cieta viela. Šīs divas vielas tika plaši izmantotas, lai gan, kad slāpekli pirmo reizi izdalīja no gaisa, to uzskatīja par kaitīgu gāzi, un no fosfora pārdošanas tika nopelnīti daudz naudas (fosfors tika novērtēts pēc tā spējas spīdēt tumsā ).

4. slaids
Fosfora atklāšanas vēsture
Ironiski, ka fosfors ir atklāts vairākas reizes. Un katru reizi, kad viņi to saņēma no ... urīna. Ir atsauces, ka arābu alķīmiķis Alhilds Behils (XII gs.) atklāja fosforu, destilējot urīnu, kas sajaukts ar māliem, kaļķiem un akmeņoglēm. Tomēr par fosfora atklāšanas datumu tiek uzskatīts 1669. gads. Hamburgas amatieris alķīmiķis Henings Brends, sagrauts tirgotājs, kurš sapņoja uzlabot savas lietas ar alķīmijas palīdzību, apstrādāja visdažādākos produktus. Pieņemot, ka fizioloģiskie produkti varētu saturēt "sākotnējo vielu", kas tiek uzskatīta par Filozofu akmens pamatu, Brends sāka interesēties par cilvēka urīnu. Viņš savāca apmēram tonnu urīna no karavīru kazarmām un iztvaicēja to līdz sīrupa veidam. Šo šķidrumu viņš destilē vēlreiz un ieguva smagu sarkanu "urinācijas eļļu", kas tika destilēta, veidojot cietu atlikumu. Sildot pēdējo, nepiekļūstot gaisam, viņš pamanīja baltu dūmu veidošanos, kas nosēdās uz trauka sienām un spoži spīdēja tumsā. Saņemto vielu Brends nosauca par fosforu, kas grieķu valodā nozīmē "gaismas nesējs". Vairākus gadus fosfora "sagatavošanas recepte" tika glabāta visstingrākajā pārliecībā un bija zināma tikai dažiem alķīmiķiem. Trešo reizi fosforu atklāja R. Boils 1680. gadā. Nedaudz pārveidotā veidā 18. gadsimtā tika izmantota arī vecā fosfora iegūšanas metode: tika karsēts urīna maisījums ar svina oksīdu (PbO), nātrija hlorīdu (NaCl), potašu (K2CO3) un akmeņoglēm (C). Tikai 1777. gadā K.V.Šēle izstrādāja metodi fosfora iegūšanai no dzīvnieku ragiem un kauliem.

5. slaids
Dabiskie savienojumi un fosfora iegūšana
Pēc izplatības zemes garozā fosfors apsteidz slāpekli, sēru un hloru. Atšķirībā no slāpekļa, fosfors augstās ķīmiskās aktivitātes dēļ dabā sastopams tikai savienojumu veidā. Nozīmīgākie fosfora minerāli ir apatīts Ca5 (PO4) 3X (X ir fluors, retāk hlors un hidroksilgrupa) un fosforīts, kura pamatā ir Ca3 (PO4) 2. Lielākā apatīta atradne atrodas Kolas pussalā, Hibiņu kalnu reģionā. Fosforīta atradnes atrodas Karatau kalnos, Maskavas, Kalugas, Brjanskas apgabalos un citās vietās. Fosfors ir daļa no dažām proteīna vielām, kas atrodas augu ģeneratīvajos orgānos, dzīvnieku un cilvēku organismu nervu un kaulu audos. Smadzeņu šūnas ir īpaši bagātas ar fosforu. Mūsdienās fosforu ražo elektriskās krāsnis, reducējot apatītu ar akmeņoglēm silīcija dioksīda klātbūtnē: Ca3(PO4)2+3SiO2+5C 3CaSiO3+5CO+2P Fosfora tvaiki šajā temperatūrā gandrīz pilnībā sastāv no P2 molekulām, kuras atdzesējot kondensējas P4 molekulās.

6. slaids
Ķīmiskās īpašības
Fosfora atoma elektroniskā konfigurācija ir 1s22s22p63s23p3 Ārējais elektronu slānis satur 5 elektronus. Trīs nesapārotu elektronu klātbūtne ārējā enerģijas līmenī izskaidro faktu, ka normālā, neuzbudinātā stāvoklī fosfora valence ir 3. Bet trešajā enerģijas līmenī ir brīvas d-orbitāļu šūnas, tāpēc, pārejot uz ierosinātu. stāvoklī, 3S-elektroni atdalīsies, pāries uz d apakšlīmeni, kas noved pie 5 nesapārotu elementu veidošanās. Tādējādi fosfora valence ierosinātā stāvoklī ir 5. Savienojumos fosfora oksidācijas pakāpe parasti ir +5 (P2O5, H3PO4), retāk +3 (P2O3, PF3), -3 (AlP, PH3, Na3P, Mg3P2).

7. slaids
Fosfora atoma pāreja uz ierosinātu stāvokli

9. slaids
Baltais fosfors
Tvaika kondensācijas rezultātā iegūtajai fosfora baltajai modifikācijai ir molekulārais kristāla režģis, kura mezglos tiek izmežģītas P4 molekulas. Starpmolekulāro spēku vājuma dēļ baltais fosfors ir gaistošs, kausējams, sagriež ar nazi un izšķīst nepolāros šķīdinātājos, piemēram, oglekļa disulfīdā. Baltais fosfors ir ļoti reaģējoša viela. Tas spēcīgi reaģē ar skābekli, halogēniem, sēru un metāliem. Fosfora oksidēšanos gaisā pavada karsēšana un spīdums. Tāpēc baltais fosfors tiek uzglabāts zem ūdens, ar kuru tas nereaģē. Baltais fosfors ir ļoti toksisks. Apmēram 80% no kopējā baltā fosfora produkcijas tiek novirzīti tīras fosforskābes sintēzei. To savukārt izmanto nātrija polifosfātu iegūšanai (tos izmanto, lai samazinātu stingrību dzeramais ūdens) un pārtikas fosfātus. Pārējo balto fosforu izmanto dūmus veidojošu vielu un aizdedzinošu maisījumu radīšanai. Drošības tehnika. Fosfora un tā savienojumu ražošanā ir nepieciešami īpaši piesardzības pasākumi, jo baltais fosfors ir spēcīga inde. Ilgstošs darbs baltā fosfora atmosfērā var izraisīt kaulu audu slimības, zobu zudumu, žokļu apvidu nekrozi. Aizdedzinot, baltais fosfors izraisa sāpīgus apdegumus, kas ilgstoši nedzīst. Baltais fosfors jāuzglabā zem ūdens, hermētiski noslēgtos traukos. Degošais fosfors tiek dzēsts ar oglekļa dioksīdu, CuSO4 šķīdumu vai smiltīm. Apdegusi āda jānomazgā ar KMnO4 vai CuSO4 šķīdumu. Pretlīdzeklis saindēšanās gadījumā ar fosforu ir 2% CuSO4 šķīdums. Ilgstošas uzglabāšanas laikā, kā arī karsējot, baltais fosfors pārvēršas sarkanā modifikācijā (pirmo reizi tas tika saņemts tikai 1847. gadā). Sarkanā fosfora nosaukums attiecas uz vairākām modifikācijām vienlaikus, kas atšķiras pēc blīvuma un krāsas: tas svārstās no oranžas līdz tumši sarkanai un pat purpursarkanai. Visas sarkanā fosfora šķirnes nešķīst organiskajos šķīdinātājos, un, salīdzinot ar balto fosforu, tās ir mazāk reaģējošas un tām ir polimēra struktūra: tie ir P4 tetraedri, kas savienoti viens ar otru bezgalīgās ķēdēs.

10. slaids
Sarkanais un melnais fosfors
Sarkano fosforu izmanto metalurģijā, pusvadītāju materiālu un kvēlspuldžu ražošanā, kā arī sērkociņu ražošanā. Visstabilākā fosfora modifikācija ir melnais fosfors. To iegūst alotropiski pārveidojot balto fosforu pie t=2200C un augsta spiediena. Autors izskats tas izskatās pēc grafīta. Melnā fosfora kristāliskā struktūra ir slāņaina, sastāv no gofrētiem slāņiem (2. att.). Melnais fosfors ir vismazāk aktīvā fosfora modifikācija. Sildot, nepiekļūstot gaisam, tas, tāpat kā sarkans, pāriet tvaikos, no kura tas kondensējas baltajā fosforā.

11. slaids
Eksperiments, kas ilustrē sarkanā fosfora pāreju uz balto
1-baltā fosfora molekulas; 2-kristālisks. melnais fosfora režģis

12. slaids
Fosfora (V) oksīds - Р2О5
Fosfors veido vairākus oksīdus. Vissvarīgākais no tiem ir fosfora oksīds (V) P4O10. Bieži vien tā formula ir rakstīta vienkāršotā formā - P2O5. Šī oksīda struktūra saglabā fosfora atomu tetraedrisku izvietojumu. Balti kristāli, t kušanas = 5700°C, vārīšanās temperatūra t = 6000°C, ρ = 2,7 g/cm3. Ir vairākas modifikācijas. Tvaikos tas sastāv no P4H10 molekulām, tas ir ļoti higroskopisks (izmanto kā sausinātāju gāzēm un šķidrumiem). Pagatavošana: 4P + 5O2 = 2P2O5 Ķīmiskās īpašības Visas skābo oksīdu ķīmiskās īpašības: reaģē ar ūdeni, bāziskiem oksīdiem un sārmiem 1) P2O5 + H2O = 2HPO3 (metafosforskābe) P2O5 + 2H2O = H4P2O7 (pirofosfāts) skābe) +2 3BaO =Ba3(PO4)2 Pateicoties tā izcilajai higroskopitātei, fosfora (V) oksīds tiek izmantots laboratorijas un rūpnieciskajās tehnoloģijās kā žāvēšanas un dehidratācijas līdzeklis. Savā žūšanas efektā tas pārspēj visas citas vielas.

13. slaids
Ortofosforskābe.
Ir zināmas vairākas fosforu saturošas skābes. Svarīgākā no tām ir ortofosforskābe H3PO4.Bezūdens ortofosforskābe ir viegla dzidri kristālišķīstošs gaisā istabas temperatūrā. Kušanas temperatūra 42,35°C. Ar ūdeni fosforskābe veido jebkuras koncentrācijas šķīdumus.

14. slaids

15. slaids
H3PO4 fizikālās īpašības
Ortofosforskābe tīrā veidā normālos apstākļos ir bezkrāsaini rombveida kristāli, kas kūst 42,3 ° C temperatūrā. Tomēr ķīmiķi reti sastopas ar šādu skābi. Daudz biežāk viņi nodarbojas ar H3PO4 * 0,5 H2O pushidrātu, kas, atdzesējot koncentrētus fosforskābes ūdens šķīdumus, izgulsnējas bezkrāsainu sešstūra prizmu veidā. Hemihidrāta kušanas temperatūra ir 29,3°C. Tīrs H3PO4 pēc kausēšanas veido viskozu eļļainu šķidrumu ar zemu elektrovadītspēju un ievērojami samazinātu difūziju. Šīs īpašības, kā arī detalizēta spektru izpēte liecina, ka H3PO4 molekulas šajā gadījumā praktiski nav disociētas un ir apvienotas ar spēcīgām ūdeņraža saitēm vienotā makromolekulārā struktūrā. Parasti molekulas ir savienotas viena ar otru ar vienu, retāk divām un ļoti reti ar trim ūdeņraža saitēm. Ja skābi atšķaida ar ūdeni, tad tās molekulas, visticamāk, veidos ūdeņraža saites ar ūdeni, nevis viena ar otru. Tādas "simpātijas" pret ūdeni dēļ skābe ar to sajaucas jebkurās attiecībās. Hidratācijas enerģija šeit nav tik liela kā sērskābei, tāpēc H3PO4 karsēšana pēc atšķaidīšanas nav tik spēcīga un disociācija ir mazāk izteikta. Saskaņā ar pirmo disociācijas posmu fosforskābi uzskata par vidēja stipruma elektrolītu (25 - 30%), saskaņā ar otro - vāju, pēc trešā - ļoti vāju.

17. slaids
H3PO4 ķīmiskās īpašības
Neitralizējot fosforskābi ar sārmiem, veidojas sāļi: dihidrofosfāti, hidrofosfāti un arī fosfāti, piemēram:

18. slaids
Fosfors cilvēka organismā
Cilvēka ķermenī, kas sver 70 kg. Satur apmēram 780 g fosfora. Kalcija fosfātu veidā fosfors atrodas cilvēku un dzīvnieku kaulos. Tas ir atrodams arī olbaltumvielās, fosfolipīdos, nukleīnskābes; fosfora savienojumi ir iesaistīti enerģijas metabolismā (adenizīna trifosforskābe, ATP). Cilvēka organisma ikdienas nepieciešamība pēc fosfora ir 1,2g.Galveno daudzumu to uzņemam kopā ar pienu un maizi (100g maizes satur aptuveni 200mg fosfora). Zivis, pupiņas un daži siera veidi ir visbagātākie ar fosforu. Interesanti, par pareizu uzturu nepieciešams saglabāt līdzsvaru starp patērētā fosfora un kalcija daudzumu: optimālā attiecība šajos pārtikas elementos ir 1,5/1. Fosforu saturošas pārtikas pārpalikums izraisa kalcija izskalošanos no kauliem, un ar kalcija pārpalikumu attīstās urolitiāze.

19. slaids
aizdedzinoša virsma sērkociņu kastīte pārklāts ar sarkanā fosfora un stikla pulvera maisījumu. Sērkociņu galviņas sastāvā ir oksidētāji (PbO2, KClO3, BaCrO4) un reducētāji (S, Sb2S3). Ar berzi no aizdedzinošās virsmas uz sērkociņa uzklātais maisījums aizdegas. Pirmie fosfora sērkociņi - ar baltu fosfora galvu - tika izveidoti tikai 1827. gadā. 6P + 5KCLO3 = 5KCL + 3P2O5 Šādi sērkociņi aizdegās, beržot pret jebkuru virsmu, kas bieži izraisīja ugunsgrēkus. Turklāt baltais fosfors ir ļoti toksisks. Aprakstīti saindēšanās gadījumi ar fosfora sērkociņiem gan neuzmanīgas apiešanās dēļ, gan pašnāvības nolūkos: šim pietika apēst dažas sērkociņu galviņas. Tāpēc fosfora sērkociņi tika aizstāti ar drošiem, kas mums uzticīgi kalpo līdz šai dienai. rūpnieciskā ražošana drošības spēles sākās Zviedrijā 60. gados. XIX gs.

24. slaids
Fosfora vērtība
Fosforskābei ir liela nozīme kā vienu no svarīgākajām augu uztura sastāvdaļām. Fosforu augi izmanto, lai izveidotu svarīgākās daļas, sēklas un augļus. Ortofosforskābes atvasinājumi ir ļoti nepieciešami ne tikai augiem, bet arī dzīvniekiem. Kauli, zobi, čaumalas, nagi, adatas, tapas lielākajā daļā dzīvo organismu sastāv galvenokārt no kalcija ortofosfāta. Turklāt fosforskābe, veidojot dažādus savienojumus ar organiskām vielām, aktīvi iesaistās dzīva organisma vielmaiņas procesos ar vide. Tā rezultātā fosfora atvasinājumi ir atrodami cilvēku un dzīvnieku organismu kaulos, smadzenēs, asinīs, muskuļos un saistaudos. Īpaši daudz fosforskābes ir nervu (smadzeņu) šūnu sastāvā, kas ļāva A.E. Fersmans, labi pazīstams ģeoķīmiķis, fosforu nosauca par "domas elementu". Ļoti negatīvi (dzīvnieku slimības rahīts, anēmija u.c.) ietekmē organisma stāvokli, pazeminot fosfora savienojumu saturu uzturā vai ievadot tos nesagremojamā veidā.

25. slaids
Fosfora izmantošana
Pašlaik plaši izmanto ortofosforskābi. Tās galvenais patērētājs ir fosfātu un kombinēto mēslojumu ražošana. Šiem nolūkiem visā pasaulē ik gadu tiek iegūti ap 100 milj.t fosforu saturošas rūdas.Fosfora mēslojums palīdz ne tikai palielināt dažādu kultūru ražu, bet arī dod augiem ziemcietību un izturību pret citiem nelabvēlīgiem klimatiskajiem apstākļiem, rada apstākļus. ātrākai labības nogatavošanai apgabalos ar īsu veģetācijas periodu. Tiem ir arī labvēlīga ietekme uz augsni, veicinot tās strukturēšanu, augsnes baktēriju attīstību, mainot citu augsnē esošo vielu šķīdību un nomācot dažas no tā rezultātā radušās kaitīgās organiskās vielas. Daudz ortofosforskābes patērē pārtikas rūpniecība. Fakts ir tāds, ka atšķaidīta fosforskābe garšo ļoti patīkami un tās mazās piedevas marmelādēm, limonādēm un sīrupiem būtiski uzlabo to garšu. Dažiem fosforskābes sāļiem ir tāda pati īpašība. Kalcija hidrogēnfosfāti, piemēram, jau sen ir iekļauti cepamajos pulveros, uzlabojot rullīšu un maizes garšu. Interesanti ir arī citi fosforskābes rūpnieciskie pielietojumi. Piemēram, ir novērots, ka koksnes impregnēšana ar pašu skābi un tās sāļiem padara koksni nedegošu. Uz šī pamata tagad tiek ražotas ugunsdrošas krāsas, nedegošas fosfāta koksnes plātnes, nedegošas fosfāta putas un citas. Būvmateriāli. Dažādi fosforskābes sāļi tiek plaši izmantoti daudzās nozarēs, celtniecībā, dažādās tehnoloģiju jomās, komunālajos saimniecības un ikdienas dzīvē, lai aizsargātu pret radiāciju, mīkstinātu ūdeni, cīnītos pret katlu nogulsnēm un ražotu dažādas mazgāšanas līdzekļi. Fosforskābe, kondensētās skābes un dehidrogenēti fosfāti kalpo kā katalizatori ogļūdeņražu dehidratācijas, alkilēšanas un polimerizācijas procesos. Īpašu vietu ieņem fosfororganiskie savienojumi kā ekstraktanti, plastifikatori, smērvielas, šaujampulvera piedevas un absorbenti saldēšanas iekārtās. Skābie alkilfosfātu sāļi tiek izmantoti kā virsmaktīvās vielas, antifrīzi, speciālie mēslošanas līdzekļi, lateksa antikoagulanti utt. Skābie alkilfosfāti tiek izmantoti urāna rūdas šķidrumu ekstrakcijas apstrādei.

26. slaids
Fosfors 1. Uzrakstiet fosfora atoma elektronisko formulu. Paskaidrojiet, kas notiek ar atoma elektronisko konfigurāciju, kad tam ir visaugstākais oksidācijas stāvoklis. 2. Kādos oksidācijas stāvokļos fosfors var būt savienojumos? Sniedziet šo savienojumu piemērus. Uzrakstiet fosfora atoma elektronisko formulu oksidācijas stāvoklī +3. 3. Kādas ir galvenās atšķirības starp fizisko un ķīmiskās īpašības sarkanais un baltais fosfors. Kā var atdalīt sarkano fosforu no baltajiem piemaisījumiem? 4. Aprēķināt fosfīna relatīvo blīvumu no ūdeņraža un gaisa. Vai fosfīns ir vieglāks vai smagāks par šīm gāzēm? 5. Kā var veikt pāreju no sarkanā uz balto fosforu un otrādi? Vai šie procesi ir ķīmiskas parādības? Paskaidrojiet atbildi. 6. Aprēķināt fosfora masu, kas jāsadedzina skābeklī, lai iegūtu fosfora (V) oksīdu, kas sver 3,55 g? 7. Sarkanā un baltā fosfora maisījumu, kas sver 20 g, apstrādāja ar oglekļa disulfīdu. Neizšķīdušo atlikumu atdala un nosvēra, tā masa 12,6 g Aprēķina baltā fosfora masas daļu sākotnējā maisījumā. 8. Kāds ir veids ķīmiskā saite savienojumos: a) РН3; b) PCl5; c) Li3P. Polārajās vielās norādiet kopējo elektronu pāru pārvietošanās virzienu. 9. Fosfīnu var iegūt, sālsskābei iedarbojoties uz kalcija fosfīdu. Aprēķiniet fosfīna tilpumu (normālos apstākļos), kas veidojas no 9,1 g kalcija fosfīda. Produkta iznākuma masas daļa ir 90%.

27. slaids
Fosforskābe un tās sāļi
1. Uzrakstiet reakcijas vienādojumus starp fosforskābi un šādām vielām: a) magnija oksīds; b) kālija karbonāts; c) sudraba nitrāts; d) dzelzs sulfāts (II). 2. Uzrakstiet vienādojumus reakcijām starp fosforskābi un kālija hidroksīdu, kuru rezultātā veidojas 3 veidu sāļi: vidēji un divi skābie. 3. Kura no skābēm ir spēcīgāka oksidētāja: slāpekļa vai ortofosforskābe? Paskaidrojiet atbildi. 4. Uzrakstiet reakciju vienādojumus, ar kuriem var veikt šādas pārvērtības: P → P205 → H3P04 → Na3P04 → Ca3(P04)2 P04)2 → Ca(H2P04)2 Uzrakstiet šo reakciju vienādojumus. 6. Izmantojot elektroniskā līdzsvara metodi, izvēlieties koeficientus šādu redoksreakciju shēmās: a) RN3 + O2 → P2O5 + H2O b) Ca3 (PO4) 2 + C + SiO2 → CaSiO3 + P + CO skābes 40% kann. iegūt no 100 kg smaga fosforīta ar Ca3 (PO4) 2 masas daļu 93%? 8. No dabīgā fosforīta, kas sver 310 kg, iegūta fosforskābe, kas sver 195 kg. Aprēķināt Ca3(PO4)2 masas daļu dabiskajā fosforītā. 9. Ūdens šķīdums, kas satur fosforskābi, kas sver 19,6 g, tika neitralizēta ar kalcija hidroksīdu, kas sver 18,5 g Nosaka iegūto CaHPO4 2H2O nogulšņu masu. 10. Ir fosforskābes šķīdums, kas sver 150 g (H3PO4 masas daļa 24,5%). Aprēķiniet amonjaka tilpumu (normālos apstākļos), kas jāizlaiž caur šķīdumu, lai iegūtu amonija dihidrogēnfosfātu. 11. Kāds sāls veidojas, ja šķīdumam, kas satur 4,9 g H3PO4, pievieno 2,8 g kālija hidroksīda? Aprēķiniet iegūtā sāls masu

28. slaids
Minerālmēsli
1. Kādus slāpekļa un fosfātu mēslošanas līdzekļus jūs zināt? Uzrakstiet reakciju vienādojumus to iegūšanai. Kāpēc augiem nepieciešams slāpeklis un fosfors? 2. Noteikt fosfora (V) oksīda masas daļu CaHPO4 2H2O nogulsnēs. 3. Fosfora (V) oksīda masas daļa superfosfātā ir 20%. Nosaka ievadāmā superfosfāta masu augļu koks, ja normālai koka attīstībai nepieciešams fosfors ar svaru 15,5 g 4. Slāpekļa masas daļa mēslošanas līdzeklī ir 14%. Viss slāpeklis ir iekļauts mēslošanas līdzeklī urīnvielas CO(NH2)2 sastāvā. Aprēķiniet urīnvielas masas daļu šajā mēslošanas līdzeklī. 5. Superfosfātā fosfora (V) oksīda masas daļa ir 25%. Aprēķiniet Ca(H2PO4)2 masas daļu šajā mēslošanas līdzeklī. 6. Aprēķiniet amonija sulfāta masu, kas jāņem, lai 5 hektāru platībā augsnē ievadītu 2 tonnas smagu slāpekli. Kāda mēslojuma masa katram jāievieto kvadrātmetru augsne? 7. Aprēķiniet amonija nitrāta masu, kas jāpielieto 100 ha platībā, ja slāpekļa masai uz 1 ha ir jābūt 60 kg. 8. Zem augļu koka augsnē jāievada fosfora (V) oksīds, kas sver 0,4 kg. Kāda superfosfāta masa šajā gadījumā jāņem, ja asimilējamā fosfora (V) oksīda masas daļa tajā ir 20%? 9. Zem augļu koka jāpievieno amonija nitrāts, kas sver 140 g (slāpekļa masas daļa nitrātā ir 35%). Nosaka amonija sulfāta masu, ko var izmantot, lai pievienotu tādu pašu slāpekļa daudzumu.

29. slaids
Literatūra: 1. F.G.Feldmanis, G.E.Rudzītis. ĶĪMIJA. Mācību grāmata 9.klases izglītības iestādēm. - M., 5. izdevums, APGAISMĪBA, 1997. gads. 2. ĶĪMIJA. Atsauces materiāli. Ju.D. Tretjakova redakcijā, - M., IZGLĪTĪBA, 1984. 3. ĶĪMIJA. Skolēnu rokasgrāmata, - M., 1995.g. 4. ĶĪMIJA. Enciklopēdija bērniem. 17.sējums, AVANTA, 2000.g 5. Vēzers V.-J., Fosfors un tā savienojumi, tulk. no angļu valodas, - M., 1963.g. 6. Internets: http://school-sector.relarn.ru/nsm/chemistry/
2. slaids
Periodiskās sistēmas VA-grupā atrodas nemetāli slāpeklisN un fosfors P, pusmetāla arsēns As, kā arī antimons Sb un bismuts Bi, kas tiek klasificēti kā nemetāli.
3. slaids
VA grupas elementu atomiem uz ārējā elektronu slāņa ir 5 elektroni. Viņu ārējā elektronu slāņa elektroniskā konfigurācija ir ns2np3, piemēram: slāpeklis - 2s2p3, fosfors - 3s23p3.
Ķīmiskajos savienojumos slāpekļa un fosfora atomi var uzrādīt oksidācijas pakāpi no -3 līdz +5.
4. slaids
slāpeklis dabā
Slāpeklis apzīmē ar simbolu N (lat. Nitrogenium, t.i. "dzemdēt salpetru"). Vienkāršā viela slāpeklis (N2) normālos apstākļos ir diezgan inerta gāze, bezkrāsaina, bez garšas un smaržas. Slāpeklis diatomisku N2 molekulu veidā veido lielāko daļu atmosfēras, kur tā saturs ir 78,084 tilpuma% (tas ir, aptuveni 3,87 1015 tonnas).
5. slaids
slāpeklis kosmosā
Ārpus Zemes slāpeklis ir atrodams gāzveida miglājos, Saules atmosfērā, Urānā, Neptūnā, starpzvaigžņu telpā u.c. Slāpeklis ir 4. visbiežāk sastopamais elements Saules sistēmā (pēc ūdeņraža, hēlija un skābekļa).
6. slaids
Fosfors dabā
Fosfors dabiski sastopams fosfātu veidā. Tādējādi kalcija fosfāts Ca3(PO4)2 ir minerāla apatīta galvenā sastāvdaļa. Fosfors ir atrodams visās zaļo augu daļās un vēl vairāk augļos un sēklās. Satur dzīvnieku audos, ir daļa no olbaltumvielām un citiem būtiskiem organiskiem savienojumiem (ATP, DNS), ir dzīvības elements. Apatīts
7. slaids
Vienkāršā viela slāpeklis sastāv no diatomiskām N2 molekulām. N2 molekulā slāpekļa atomi ir saistīti ar trīskāršu kovalentu nepolāru saiti. Trīskāršās saites enerģija ir augsta un sasniedz 946 kJ/mol. Tāpēc saites pārraušana un slāpekļa atomu un molekulu veidošanās notiek tikai temperatūrā virs 3000°C. Augstā saišu stiprība molekulās nosaka slāpekļa ķīmisko inerci.
8. slaids
Brīvā stāvoklī fosfors veido vairākas allotropās modifikācijas, kuras sauc par balto, sarkano un melno fosforu.
9. slaids
Vienkāršākajā P4 molekulā katrs no četriem fosfora atomiem ir kovalenti saistīts ar pārējiem trim. Baltais fosfors sastāv no šādām tetraedriskas formas molekulām. Lieto inertā atmosfērā nūju (lietņu) veidā, to uzglabā bez gaisa zem attīrīta ūdens slāņa vai īpašā inertā vidē.
10. slaids
Ķīmiski baltais fosfors ir ārkārtīgi aktīvs! Piemēram, tas jau istabas temperatūrā lēnām oksidējas ar gaisa skābekli un spīd (bāli zaļš mirdzums). Šāda veida spīduma parādību ķīmisko oksidācijas reakciju dēļ sauc par hemiluminiscenci (dažreiz kļūdaini par fosforescenci). Baltais fosfors ir ļoti toksisks. Nāvējošā baltā fosfora deva pieaugušam vīrietim ir 0,05-0,1 g.
11. slaids
Sarkanajam fosforam ir atomu polimēra struktūra, kurā katrs fosfora atoms ir saistīts ar trīs citiem atomiem ar kovalentām saitēm.Sarkanais fosfors nav gaistošs, ūdenī nešķīstošs un nav toksisks. To izmanto sērkociņu ražošanā.
Gaismā un sildot līdz 300 ° C bez gaisa baltais fosfors pārvēršas sarkanajā fosforā.
12. slaids
Karsējot zem spiediena, kas ir aptuveni 1200 reizes lielāks par atmosfēras spiedienu, baltais fosfors pārvēršas melnajā fosforā, kuram ir atomu slāņains kristāliskais režģis. Melnais fosfors pēc savām fizikālajām īpašībām ir līdzīgs metālam: tas vada elektrību un mirdz. Ārēji tas ir ļoti līdzīgs grafītam.Melnais fosfors ir ķīmiski vismazāk aktīvā fosfora forma.
13. slaids
1830. gadā franču ķīmiķis Šarls Soria izgudroja fosfora sērkociņus, kas sastāvēja no bartoleta sāls, baltā fosfora un līmes maisījuma. Šie sērkociņi bija viegli uzliesmojoši, jo aizdegās pat no savstarpējas berzes kastē un berzējot pret jebkuru cietu virsmu, piemēram, zābaka zoli. Baltā fosfora dēļ tie bija indīgi.1855. gadā zviedru ķīmiķis Johans Lundstrēms uz smilšpapīra virsmas uzklāja sarkano fosforu un ar to aizstāja sērkociņu galviņas sastāvā balto fosforu. Šādi sērkociņi veselībai vairs nebija kaitīgi, tie viegli uzliesmoja uz iepriekš sagatavotas virsmas un praktiski neaizdega spontāni. Johans Lundstrēms patentē pirmo "zviedru sērkociņu", kas saglabājies gandrīz līdz mūsdienām. 1855. gadā Lundstrēma sērkociņi tika apbalvoti ar medaļu Pasaules izstādē Parīzē. Vēlāk fosfors tika pilnībā izņemts no sērkociņu galviņu sastāva un palika tikai izklājumā (rīvē).Attīstoties "zviedru" sērkociņu ražošanai, sērkociņu ražošana, izmantojot balto fosforu, tika aizliegta gandrīz visās valstīs.
14. slaids
Vienkāršākā viela slāpeklis N2 ir ķīmiski neaktīvs un, kā likums, ķīmiskās reakcijās nonāk tikai augstā temperatūrā.Slāpekļa oksidējošās īpašības izpaužas reakcijā ar ūdeņradi un aktīvajiem metāliem. Tātad ūdeņradis un slāpeklis savienojas katalizatora klātbūtnē augstā temperatūrā un augstā spiedienā, veidojot amonjaku:
No metāliem normālos apstākļos slāpeklis reaģē tikai ar litiju, veidojot litija nitrīdu:
15. slaids
Fosfora oksidējošās īpašības izpaužas, kad tas mijiedarbojas ar visaktīvākajiem metāliem:
Slāpekļa un fosfora reducējošās īpašības izpaužas, kad tie mijiedarbojas ar skābekli. Tātad slāpeklis reaģē ar skābekli aptuveni 3000˚С temperatūrā, veidojot slāpekļa oksīdu (II):
16. slaids
Fosforu oksidē arī skābeklis, tādējādi uzrādot reducējošās īpašības. Bet dažādām fosfora modifikācijām ir atšķirīga ķīmiskā aktivitāte. Piemēram, baltais fosfors viegli oksidējas gaisā istabas temperatūrā, veidojot fosfora (III) oksīdu:
Baltā fosfora oksidēšanos pavada luminiscence. Baltais un sarkanais fosfors aizdedzoties aizdegas un sadeg ar žilbinoši spilgtu liesmu, veidojot baltus fosfora (IV) oksīda dūmus:
17. slaids
Deg baltais fosfors
18. slaids
Ķīmiski aktīvākais, toksiskākais un degošākais baltais fosfors. Tāpēc to ļoti bieži izmanto aizdedzinošajās bumbās.Diemžēl fosfora munīcija tiek izmantota arī 21. gadsimtā!
Sarajevas aplenkuma laikā fosfora šāviņus izmantoja Bosnijas serbu artilērija. 1992. gadā šādas čaulas nodedzināja Orientālistikas institūta ēku, kā rezultātā tika iznīcināti daudzi vēstures dokumenti. - 2003.-2004.gadā tos izmantoja Lielbritānijas izlūkdienesti Basras apkaimē Irākā. - 2004. gadā ASV izmantoja pret partizānu pagrīdi Irākā kaujā par Fallūdžu. 2006. gada vasarā, Otrā Libānas kara laikā, artilērijas šāviņus ar balto fosforu izmantoja Izraēlas armija. 2009. gadā operācijas Cast Lead laikā Gazas joslā Izraēlas armija izmantoja ar starptautiskajiem tiesību aktiem atļauto munīciju, kas satur balto fosforu. Kopš 2009. gada palestīniešu teroristi ir pielādējuši savas raķetes ar balto fosforu.
19. slaids
Klīstošo uguņu parādīšanos vecajos kapos un purvos izraisa fosfīna PH3 un citu fosforu saturošu savienojumu aizdegšanās gaisā. Gaisā fosfora un ūdeņraža savienojuma produkti spontāni aizdegas, veidojot gaišu liesmu un fosforskābes pilienus, kas ir fosfora (V) oksīda mijiedarbības produkts ar ūdeni. Šie pilieni rada neskaidras "spoka" kontūras.
20. slaids
Galvenais slāpekļa pielietojums ir amonjaka ražošana. Slāpekli izmanto arī, lai radītu inertu vidi sprāgstvielu žāvēšanai un vērtīgu gleznu un manuskriptu glabāšanā. Turklāt elektriskās kvēlspuldzes ir piepildītas ar slāpekli.
Vienkāršu vielu pielietojums Amonjaka ražošana Lielākā daļa mūsdienu lampu ir pildītas ar ķīmiski inertām gāzēm. Slāpekļa N2 maisījumi ar argonu Ar ir visizplatītākie to zemo izmaksu dēļ.